黄芪甲苷对乌拉坦诱导肺癌小鼠的防治作用及其机制
2021-02-22陈贡斌刘海燕郭银谋高田慧
周 威,陈贡斌,刘海燕,郭银谋,高田慧
(1.商丘市第一人民医院肿瘤科,河南 商丘 476100;2.河南省人民医院肿瘤科,河南 郑州 450000)
肺癌是全球癌症相关死亡的主要原因之一[1]。尽管在过去的几十年中,新的诊断和治疗方法不断发现,但每年仍有约180万人死于肺癌,其中85%的患者为非小细胞肺癌(non-small cell lung cancer,NSCLC)[2]。肺癌的常规治疗方法以手术治疗、放射治疗、化学治疗和支持性护理(包括临终护理)为主,多数患者的预后和生活质量较差,术后肿瘤复发率及转移率高,易产生多药耐药性,因此,需要开发新的方法和药物用于肺癌的治疗和预防。近年来,有研究发现,植物来源的化合物具有潜在的抗癌活性[3]。黄芪为我国传统中草药,含有多种活性物质,如多糖、皂苷、黄酮等,其中黄芪甲苷又称为黄芪甲素IV(astragalosideⅣ,AS-Ⅳ),是黄芪主要的皂苷类有效活性成分,具有抗肿瘤、抗纤维化、抗炎、抗氧化、调节免疫和代谢性疾病等作用[4-5]。Wnt/β-连环蛋白(β-catenin)信号通路是Wnt信号通路的经典途径,在细胞增殖分化、人类器官发育和多种肿瘤的发生中起关键效应[6]。Wnt-1、β-catenin是该信号通路中的关键分子,C-myc和细胞周期蛋白D1(Cyclin D1)是其下游信号通路的主要靶基因,在肿瘤细胞的增殖和凋亡过程中扮演重要角色[7]。目前,已有研究证实,AS-Ⅳ在体内和体外均对肺癌有抑制作用,但具体机制尚不清楚[8]。因此,本研究采用腹腔注射乌拉坦建立小鼠肺癌模型,通过观察肺癌组织中Wnt/β-catenin信号通路蛋白表达来探讨AS-Ⅳ对肺癌的预防与治疗作用及其可能机制,以期为AS-Ⅳ的临床应用提供理论依据。
1 材料与方法
1.1 实验动物美国癌症研究所小鼠100只,雌雄各半,体质量18~22(20±2)g,6~8周龄,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2017-0011,实验动物及饲养条件符合《实验动物管理条件》要求。
1.2 主要试剂与仪器AS-Ⅳ(纯度>98%)购自南京泽朗医药科技有限公司(国药准字Z51020664),乌拉坦(纯度>99%)购自北京化工厂(国药准字H37022259),苏木精-伊红(hematoxylineosin,HE)染色试剂盒、放射性免疫沉淀法(radioimmunoprecipitation assay,RIPA)裂解液、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、脱脂奶粉、聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜、蛋白Marker、TRIzol购自北京索莱宝科技有限公司,二喹啉甲酸蛋白定量试剂盒购自北京鼎国昌盛生物技术有限公司,癌胚抗原(carcinoembryonic antigen,CEA)、糖 链 抗原125(carbohydrate antigen 125,CA125)酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测试剂盒购自武汉伊莱瑞特生物科技有限公司,聚合酶链反应(polymerase chain reaction,PCR)试剂盒及引物购自日本Takara公司,Wnt-1、β-catenin、C-myc、Cyclin D1、甘油醛-3-磷酸脱氢 酶 (glyceraldehyde-3-phosphate dehydrogenase,GAPDH)兔源单克隆抗体及羊抗兔二抗购自美国CST公司,中性树胶购自国药集团化学试剂有限公司;YLS-1A多功能小鼠自主活动记录仪购自安徽正华生物仪器设备有限公司,AE223电子天平购自上海舜宇恒平科学仪器有限公司,MET VX200-T型涡旋振荡器购自施锐(上海)贸易有限公司,DW-86L626超低温冰箱购自海尔集团,YA.ZD-10普通型电热蒸馏水器购自上海申安医疗器械厂,RM2245切片机购自德国莱卡公司,7500型定量PCR仪购自美国Applied Biosystems公司,DYCZ-24KS型双板垂直电泳仪购自北京六一仪器厂,G:BOX多功能凝胶成像系统购自美国Syngene公司,Multiskan MK3酶标仪购自赛默飞世尔科技(中国)有限公司,IX53显微镜购自日本奥林巴斯公司,TGL16MB高速冷冻离心机购自长沙湘智离心机仪器有限公司。
1.3 实验方法
1.3.1 动物分组与各组干预措施将小鼠随机分为对照组、模型组、低剂量AS-Ⅳ组、中剂量AS-Ⅳ组和高剂量AS-Ⅳ组,每组20只。对照组小鼠腹腔注射生理盐水,其他4组小鼠腹腔注射乌拉坦溶液600 mg·kg-1制备肺癌模型,每周注射1次,持续10周[9]。
从造模当天开始,低剂量AS-Ⅳ组、中剂量AS-Ⅳ组和高剂量AS-Ⅳ组小鼠分别灌胃给予AS-Ⅳ12.5、25.0、50.0 mg·kg-1,对照组和模型组小鼠灌胃等量蒸馏水,每天1次,连续19周。实验结束时,对照组、模型组、低剂量AS-Ⅳ组、中剂量AS-Ⅳ组和高剂量AS-Ⅳ组分别有19、16、17、17、18只存活小鼠。
1.3.2 生理指标记录与样本采集从造模当天开始记录各组小鼠体质量、自主活动次数(将小鼠放置于自主活动记录仪中,记录5 min内小鼠自主活动次数),每2周1次。至第19周实验结束时,各组小鼠使用乙醚吸入麻醉后摘眼球取血,于4℃冰箱中静置2 h,3 000 r·min-1(离心半径为12.5 cm)离心10 min后取血清,分装于EP管中,置于-80℃冰箱中保存。各组小鼠麻醉取血后脱臼处死,取肺组织置于冰上,生理盐水清洗至无血丝,计算肺癌发生率(荷瘤小鼠数/检测小鼠数×100%)和肺肿瘤数量(通过直接观察并计数肺组织表面形成的肿瘤结节获得),取平均值。各组小鼠一部分肺组织置于40 g·L-1多聚甲醛中固定,用于制作组织病理切片;一部分肺组织冻存于-80℃超低温冰箱中用于实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,qRT-PCR)及Western blot法检测肺组织中β-catenin、C-myc、Cyclin D1 mRNA和蛋白表达量。
1.3.3 HE染色观察各组小鼠肺组织病理学变化取各组小鼠肺组织,置于40 g·L-1多聚甲醛中固定48 h,清洗后置于不同浓度梯度乙醇中进行梯度脱水,制作肺组织蜡块,冰上预冷切片,切片厚度为4μm。组织切片置于载玻片上,应用二甲苯脱蜡30 min,于不同浓度梯度乙醇溶液中复水,然后使用HE染液分别染细胞核和细胞质,脱水后用中性树胶封片,置于显微镜下观察各组小鼠肺组织水肿、细胞核增生、肺基本形态等病理变化情况。
1.3.4 ELISA法检测各组小鼠血清中肿瘤标志物CEA、CA125水平取各组待测血清加入到反应孔中,每孔100μL,每组分别设4个复孔,37℃孵育90 min,弃掉孔内液体,加入100μL生物素化抗体工作液,37℃孵育60 min,弃掉孔内液体,洗涤3次,加入100μL酶结合物工作液,37℃孵育30 min后弃掉孔内液体,洗涤5次,每孔加入90μL底物溶液,37℃孵育15 min,加入50μL终止液,450 nm波长下检测吸光度值,按照标准曲线计算各组小鼠血清中CEA、CA125水平。
1.3.5 qRT-PCR 法检测各组小鼠肺组织中Wnt-1、β-catenin、C-myc和Cyclin D1 mRNA相对表达量称取0.1 g小鼠肺组织,冰上研磨,加1 mL TRIzol裂解液提取总RNA,以总RNA为模版反转录合成cDNA,作为荧光定量模版。引物由日本Takara公司设计合成。Wnt-1正向引物序列为5′-CTGCAGAGCATGGACTCGTC-3′,反向引物序列为5′-CCGTTGAAGAGAGTGGAGTG-3′,片段长度247 bp;β-catenin正向引物序列为5′-TGCAGTTCGCCTTCACTATG-3′,反向引物序列为5′-ACTAGTCGTGGAATGGCACC-3′,片段长度162 bp;C-myc正向引物序列为5′-ATGCCCCTCAACGTTAGC-3′,反向引物序列为5′-AGCTCGCTCTGCTGCTGC-3′,片段 长度143 bp;Cyclin D1正向引物序列为5′-AACACATCATCCCCAAACAC-3′,反向引物序列为TCACACTTCATCACTCTGGA,片段长度196 bp;GAPDH正向引物序列为5′-TGCTTCACCACCTTCTTGA-3′,反向引物序列为5′-TCACCATCTTCCAGGAGC-3′,片段长度456 bp;所有样品均以GAPDH为内参。反应体系:三磷酸脱氧核糖核苷酸(deoxy-ribonucleoside triphosphates,dNTPs)0.5μL,5×Buffer 2.5μL,Taq酶0.3μL,MgCl21.5μL,cDNA模板2.0μL,上下游引物各1.0μL,加去离子水至总体积为25.0μL。反应条件:95℃预变性5 min,95℃变性30 s,62℃退火30 s,72℃延伸30 s,共40个循环;再次72℃延伸10 min,4℃5 min终止反应。实验重复3次。采用2-△△Ct法计算目的基因mRNA相对表达量。
1.3.6 Western blot法检测各组小鼠肺组织中Wnt-1、β-catenin、C-myc、Cyclin D1蛋白相对表达量取0.1 g小鼠肺组织剪碎后冰上研磨,3 000 r·min-1(离心半径为12.5 cm)离心10 min,取沉淀,加入蛋白裂解液,提取肺组织蛋白,二喹啉甲酸蛋白定量试剂盒测定蛋白浓度。然后进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,上样后80 V电泳2 h,60 V转膜2 h,50 g·L-1脱脂奶粉封闭2 h,随后将条带放入10 mL的Wnt-1、β-catenin、C-myc、Cyclin D1兔源一抗稀释液中,稀释比例均为1∶1 000,4℃孵育12 h,第2天应用加了吐温的三子醇胺缓冲盐水(tris buffered saline tween,TBST)清洗3次,每次10 min,然后加入羊抗兔二抗(1∶2 000),37℃孵育2 h,TBST清洗3次后滴加增强电化学发光液,反应1 min后置于凝胶成像系统显影。内参蛋白为GAPDH,使用Image J软件分析各蛋白对应的灰度值,以目的蛋白灰度值与内参蛋白灰度值的比值表示目的蛋白相对表达量。
1.4 统计学处理应用SPSS 25.0软件进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验,多样本均数的比较采用单因素方差分析,两两比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 5组小鼠体质量和自主活动次数比较结果见表1和表2。造模后第1周和第3周,5组小鼠体质量比较差异无统计学意义(P>0.05);造模后第5周至第19周,模型组小鼠体质量低于对照组,差异均有统计学意义(P<0.05);低剂量AS-Ⅳ组、中剂量AS-Ⅳ组和高剂量AS-Ⅳ组小鼠体质量分别从第5、7、11周开始高于模型组,差异均有统计学意义(P<0.05);造模后第1周至第5周,低剂量AS-Ⅳ组、中剂量AS-Ⅳ组和高剂量AS-Ⅳ组小鼠体质量比较差异无统计学意义(P>0.05);造模后第7周至第19周,低剂量AS-Ⅳ组、中剂量AS-Ⅳ组小鼠体质量均从第7周开始高于高剂量AS-Ⅳ组,第11周至19周低于高剂量AS-IV组,差异有统计数意义(P>0.05)低剂量AS-Ⅳ组小鼠体质量从第15周开始低于AS-Ⅳ中剂量组,差异均有统计学意义(P<0.05)。
造模后第1周和第3周,5组小鼠自主活动次数比较差异无统计学意义(P>0.05)。造模后第5周至第19周,模型组小鼠自主活动次数显著低于对照组,中剂量AS-Ⅳ组和高剂量AS-Ⅳ组小鼠自主活动次数从第11周开始高于模型组,低剂量组小鼠自主活动次数从第13周开始高于模型组,差异均有统计学意义(P<0.05)。从第1周至第9周,低剂量AS-Ⅳ组、中剂量AS-Ⅳ组和高剂量AS-Ⅳ组自主活动次数比较差异无统计学意义(P>0.05)。造模后第11周至第19周,低剂量AS-Ⅳ组和中剂量AS-Ⅳ组小鼠自主活动次数分别从第11周和第13周开始低于高剂量AS-Ⅳ组,低剂量AS-Ⅳ组小鼠自主活动次数从第11周开始低于中剂量AS-IV组,差异均有统计学意义(P<0.05)。
表1 5组小鼠体质量比较Tab.1 Comparison of body weight of mice among the five groups (±s)

表1 5组小鼠体质量比较Tab.1 Comparison of body weight of mice among the five groups (±s)
注:与对照组比较a P<0.05;与模型组比较b P<0.05;与高剂量AS-Ⅳ组比较c P<0.05;与中剂量AS-Ⅳ组比较d P<0.05。
?
表2 5组小鼠自主活动次数比较Tab.2 Comparison of the number of autonomous activities of mice among the five groups (±s)

表2 5组小鼠自主活动次数比较Tab.2 Comparison of the number of autonomous activities of mice among the five groups (±s)
注:与对照组比较a P<0.05;与高剂量AS-Ⅳ组比较b P<0.05;与中剂量AS-Ⅳ组比较c P<0.05;与模型组比较,d P<0.05。
?
2.2 5组小鼠肺癌发生率和肺肿瘤数量比较结果见表3。低剂量AS-Ⅳ组、中剂量AS-Ⅳ组和高剂量AS-Ⅳ组小鼠肺癌发生率和肺肿瘤数量低于模型组,差异均有统计学意义(P<0.05);中剂量AS-Ⅳ组、高剂量AS-Ⅳ组小鼠肺癌发生率和肺肿瘤数量低于低剂量AS-Ⅳ组,差异均有统计学意义(P<0.05);高剂量AS-Ⅳ组小鼠肺癌发生率和肺肿瘤数量低于中剂量AS-Ⅳ组,差异均有统计学意义(P<0.05)。
表3 5组小鼠肺癌发生率和肺肿瘤数量比较Tab.3 Comparison of the incidence of lung cancer and the number of lung tumors of mice among the five groups(±s)
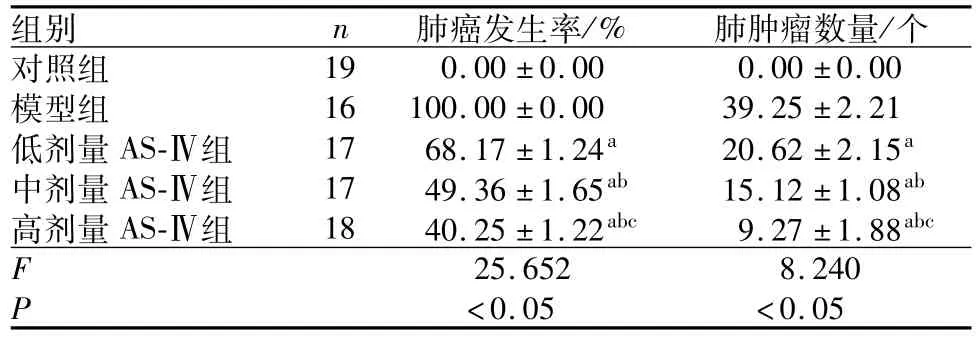
表3 5组小鼠肺癌发生率和肺肿瘤数量比较Tab.3 Comparison of the incidence of lung cancer and the number of lung tumors of mice among the five groups(±s)
注:与模型组比较a P<0.05;与低剂量AS-Ⅳ组比较b P<0.05;与中剂量AS-Ⅳ组比较c P<0.05。
?
2.3 5组小鼠肺组织病理形态学比较结果见图1。肺组织HE染色切片显示,对照组小鼠肺组织形态正常,无增生和炎症细胞浸润现象;模型组小鼠肺组织中细胞核密集,被大量肿瘤细胞浸润,出现明显瘤区,失去原有肺组织形态;低剂量AS-Ⅳ组、中剂量AS-Ⅳ组和高剂量AS-Ⅳ组小鼠肺组织病理学变化较模型组显著改善,肺组织结构基本清晰,较少出现细胞核密集增生和炎症细胞浸润情况。
2.4 5组小鼠血清肿瘤标志物CEA和CA125水平比较结果见表4。模型组、低剂量AS-Ⅳ组、中剂量AS-Ⅳ组和高剂量AS-Ⅳ组小鼠血清中CEA和CA125水平均高于对照组(P<0.05);低剂量AS-Ⅳ组、中剂量AS-Ⅳ组和高剂量AS-Ⅳ组小鼠血清中CEA和CA125水平低于模型组(P<0.05);中剂量AS-Ⅳ组、高剂量AS-Ⅳ组小鼠血清中CEA和CA125水平低于低剂量AS-Ⅳ组(P<0.05),高剂量AS-Ⅳ组小鼠血清中CEA和CA125水平低于中剂量AS-Ⅳ组(P<0.05)。
2.5 5组小鼠肺组织Wnt-1、β-catenin、C-myc和Cyclin D1 mRNA相对表达量比较结果见表5。模型组、低剂量AS-Ⅳ组、中剂量AS-Ⅳ组和高剂量AS-Ⅳ组小鼠肺组织中Wnt-1、β-catenin、C-myc和Cyclin D1 mRNA相对表达量均高于对照组,差异有统计学意义(P<0.05);低剂量AS-Ⅳ组、中剂量AS-Ⅳ组和高剂量AS-Ⅳ组小鼠肺组织中Wnt-1、β-catenin、C-myc和Cyclin D1 mRNA相对表达量均低于模型组,差异有统计学意义(P<0.05);中剂量AS-Ⅳ组、高剂量AS-Ⅳ组小鼠肺组织中Wnt-1、β-catenin、C-myc和Cyclin D1 mRNA相对表达量低于低剂量AS-Ⅳ组,差异有统计学意义(P<0.05);高剂量AS-Ⅳ组小鼠肺组织中Wnt-1、β-catenin、C-myc和Cyclin D1 mRNA相对表达量低于中剂量AS-Ⅳ组,差异有统计学意义(P<0.05)。
表4 5组小鼠血清中CEA和CA125水平比较Tab.4 Comparison of the levels of serum CEA and CA125 of mice among the five groups (±s)
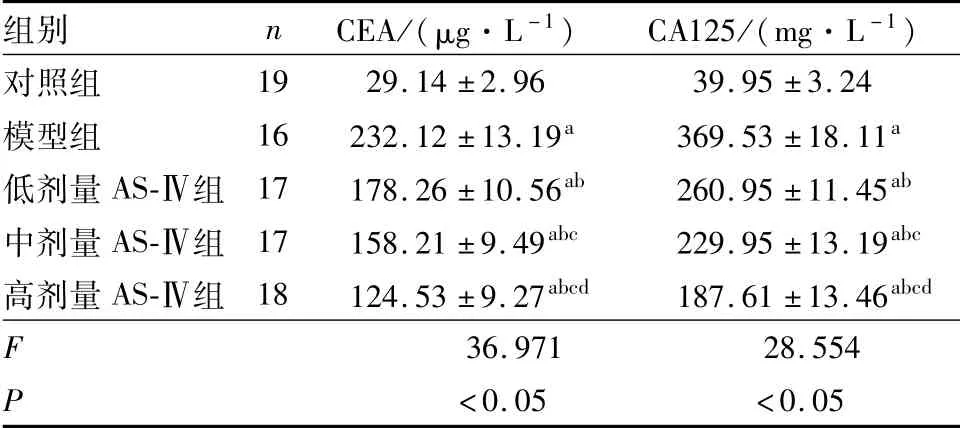
表4 5组小鼠血清中CEA和CA125水平比较Tab.4 Comparison of the levels of serum CEA and CA125 of mice among the five groups (±s)
注:与对照组比较a P<0.05;与模型组比较b P<0.05;与低剂量AS-Ⅳ组比较c P<0.05;与中剂量AS-Ⅳ组比较d P<0.05。
组别 n CEA/(μg·L-1) CA125/(mg·L-1)对照组19 29.14±2.96 39.95±3.24模型组 16 232.12±13.19a 369.53±18.11a低剂量AS-Ⅳ组 17 178.26±10.56ab 260.95±11.45ab中剂量AS-Ⅳ组 17 158.21±9.49abc 229.95±13.19abc高剂量AS-Ⅳ组 18 124.53±9.27abcd 187.61±13.46abcd F 36.971 28.554 P <0.05 <0.05
表5 各组小鼠肺组织中Wnt-1、β-catenin、C-myc和cyclin D1 mRNA相对表达量比较Tab.5 Comparison of the relative expression of Wnt-1,β-catenin,C-myc and cyclin D1 mRNA in lung tissues of mice among the five groups (±s)
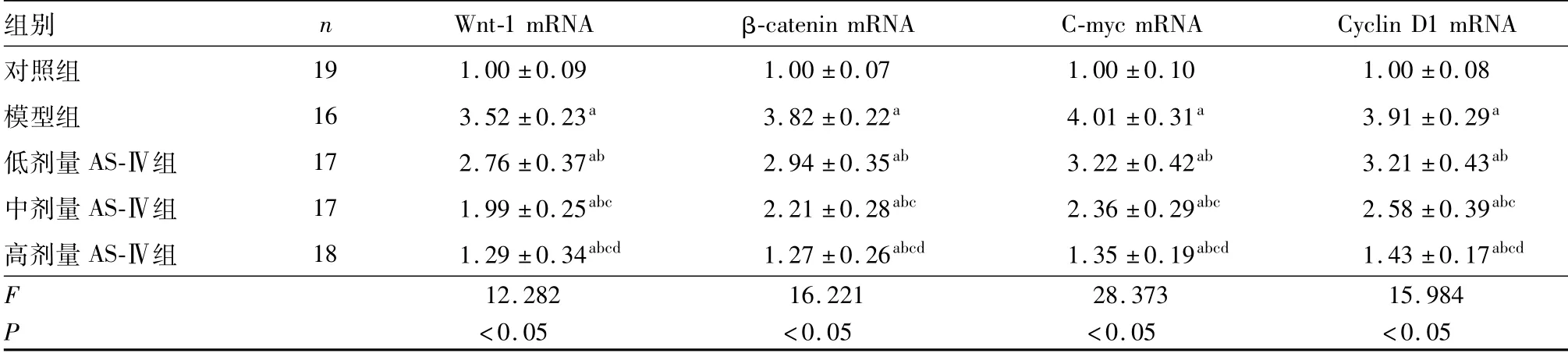
表5 各组小鼠肺组织中Wnt-1、β-catenin、C-myc和cyclin D1 mRNA相对表达量比较Tab.5 Comparison of the relative expression of Wnt-1,β-catenin,C-myc and cyclin D1 mRNA in lung tissues of mice among the five groups (±s)
注:与对照组比较a P<0.05;与模型组比较b P<0.05;与低剂量AS-Ⅳ组比较c P<0.05;与中剂量AS-Ⅳ组比较d P<0.05。
组别 n Wnt-1 mRNA β-catenin mRNA C-myc mRNA Cyclin D1 mRNA对照组19 1.00±0.09 1.00±0.07 1.00±0.10 1.00±0.08模型组 16 3.52±0.23a 3.82±0.22a 4.01±0.31a 3.91±0.29a低剂量AS-Ⅳ组 17 2.76±0.37ab 2.94±0.35ab 3.22±0.42ab 3.21±0.43ab中剂量AS-Ⅳ组 17 1.99±0.25abc 2.21±0.28abc 2.36±0.29abc 2.58±0.39abc高剂量AS-Ⅳ组 18 1.29±0.34abcd 1.27±0.26abcd 1.35±0.19abcd 1.43±0.17abcd F 12.282 16.221 28.373 15.984 P <0.05 <0.05 <0.05 <0.05
2.6 5组小鼠肺组织中Wnt-1、β-catenin、C-myc和Cyclin D1蛋白相对表达量比较结果见图2和表6。模型组、低剂量AS-Ⅳ组、中剂量AS-Ⅳ组小鼠肺组织中Wnt-1、β-catenin、C-myc和Cyclin D1蛋白相对表达量均高于对照组,差异有统计学意义(P<0.05);高剂量AS-Ⅳ组小鼠肺组织中C-myc蛋白表达量高于对照组,差异有统计学意义(P<0.05);高剂量AS-Ⅳ组和对照组小鼠肺组织中Wnt-1、β-catenin、Cyclin D1蛋白相对表达量比较差异无统计学意义(P>0.05)。低剂量AS-Ⅳ组、中剂量AS-Ⅳ组和高剂量AS-Ⅳ组小鼠肺组织中Wnt-1、β-catenin、C-myc和Cyclin D1蛋白相对表达量低于模型组,差异有统计学意义(P<0.05);中剂量AS-Ⅳ组、高剂量AS-Ⅳ组小鼠肺组织中Wnt-1、β-catenin、C-myc和Cyclin D1蛋白相对表达量低于低剂量AS-Ⅳ组,差异有统计学意义(P<0.05);高剂量AS-Ⅳ组小鼠肺组织中Wnt-1、β-catenin、C-myc和Cyclin D1蛋白相对表达量低于中剂量AS-Ⅳ组,差异有统计学意义(P<0.05)。
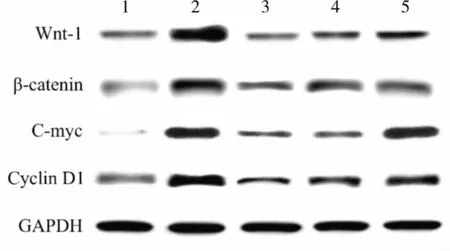
图2 各组小鼠肺组织中Wnt-1、β-catenin、C-myc和Cyclin D1蛋白相对表达量Fig.2 Relative expression of Wnt-1,β-catenin,C-myc and Cyclin D1 protein in the lung tissues of mice in each group
表6 5组小鼠肺组织中Wnt-1、β-catenin、C-myc和Cyclin D1蛋白相对表达量比较Tab.6 Comparison of the relative expression of Wnt-1,β-catenin,C-myc and Cyclin D1 protein in the lung tissues of mice among the five groups (±s)
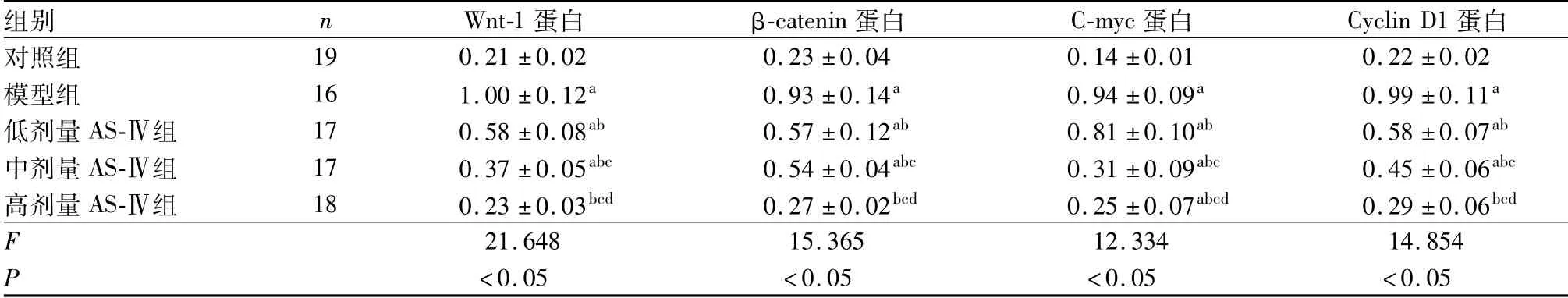
表6 5组小鼠肺组织中Wnt-1、β-catenin、C-myc和Cyclin D1蛋白相对表达量比较Tab.6 Comparison of the relative expression of Wnt-1,β-catenin,C-myc and Cyclin D1 protein in the lung tissues of mice among the five groups (±s)
注:与对照组比较a P<0.05;与模型组比较b P<0.05;与低剂量AS-Ⅳ组比较c P<0.05;与中剂量AS-Ⅳ组比较d P<0.05。
组别 n Wnt-1蛋白 β-catenin蛋白 C-myc蛋白 Cyclin D1蛋白对照组19 0.21±0.02 0.23±0.04 0.14±0.01 0.22±0.02模型组 16 1.00±0.12a 0.93±0.14a 0.94±0.09a 0.99±0.11a低剂量AS-Ⅳ组 17 0.58±0.08ab 0.57±0.12ab 0.81±0.10ab 0.58±0.07ab中剂量AS-Ⅳ组 17 0.37±0.05abc 0.54±0.04abc 0.31±0.09abc 0.45±0.06abc高剂量AS-Ⅳ组 18 0.23±0.03bcd 0.27±0.02bcd 0.25±0.07abcd 0.29±0.06bcd F 21.648 15.365 12.334 14.854 P <0.05 <0.05 <0.05 <0.05
3 讨论
肺癌是全球范围内最致命的恶性肿瘤,也是癌症相关死亡的主要原因[10]。尽管免疫疗法和靶向药物的研发飞速发展,但化学治疗仍然是肺癌治疗的基石,然而化学治疗同时也损伤机体正常组织和细胞,给患者带来了除疾病之外的生理和心理上的不适[11-12]。黄芪是豆科黄芪属植物,根入药,具有益气补虚的功效。AS-Ⅳ是黄芪水提物中的主要化合物之一,对心血管、肺、肾和脑具有保护作用[13]。目前已有研究证明,AS-Ⅳ在体外试验中对肺癌细胞具有一定的抑制作用,但在体内试验中对肺癌的作用及其作用机制尚不清楚[14-15]。Wnt家族是一组涉及多种细胞功能的蛋白质,可触发多条细胞内信号转导途径,Wnt/β-catenin信号通路是Wnt信号通路的经典途径[16-17]。研究证明,Wnt信号通路在多种癌症中均被上调,在维持肿瘤干细胞特性、耐药性、侵袭和转移过程中具有关键作用,该通路的激活是恶性肿瘤形成的关键步骤[18-19]。本研究以Wnt/β-catenin信号通路为切入点,采用乌拉坦诱导的小鼠肺癌模型探究AS-Ⅳ对肺癌的作用及其作用机制。
本研究结果显示,与对照组比较,乌拉坦诱导的肺癌模型组小鼠体质量和自主活动数均呈现降低趋势,与模型组比较,高剂量AS-Ⅳ组、中剂量AS-Ⅳ组和低剂量AS-Ⅳ组小鼠的体质量分别从第11、7、5周开始显著增高,中剂量AS-Ⅳ组、高剂量AS-Ⅳ组小鼠从第11周开始自主活动次数增加,低剂量AS-Ⅳ组小鼠从第13周开始活动次数显著增加,表明AS-Ⅳ可显著改善肺癌小鼠的生存质量。肺癌发生率、肺肿瘤数量、肺组织病理切片HE染色和血清肺癌标志物检测结果显示,与对照组比较,模型组小鼠的肺癌发生率为100.00%,肺肿瘤数量和血清中肺癌标志物CEA和CA125水平显著增加,肺组织呈现细胞密集增生、肺泡正常形态消失、肺组织肿胀现象,同时可见肺组织中分布大面积瘤区,与文献[9]造模结果一致,表明肺癌模型建立成功。与模型组比较,高剂量AS-Ⅳ组、中剂量AS-Ⅳ组和低剂量AS-Ⅳ组小鼠的肺癌发生率和肺肿瘤数量显著降低,血清中肺癌标志物CEA和CA125表达水平显著降低,而且呈剂量依赖性;肺泡组织结构基本清晰,未见大面积细胞核浓染、畸变、密集增生等肺组织癌变情况,肺组织形态得到了显著改善;这表明AS-Ⅳ具有抑制乌拉坦诱导癌症发生的作用,且此种抑制作用呈剂量依赖性。Wnt/β-catenin信号通路是癌症发生过程中的关键途径,Wnt信号的开启可抑制β-catenin的降解,随后β-catenin易位进入细胞核,导致C-Myc和Cyclin D1等靶基因转录[20]。本研究结果显示,模型组小鼠肺组织中Wnt-1、β-catenin、C-myc、Cyclin D1 mRNA和蛋白表达水平均显著高于对照组,表明Wnt/β-catenin信号通路的活化与乌拉坦诱导的肺癌密切相关。与模型组比较,高剂量AS-Ⅳ组、中剂量AS-Ⅳ组和低剂量AS-Ⅳ组小鼠肺组织中Wnt-1、β-catenin、C-myc、Cyclin D1 mRNA和蛋白表达水平显著降低,且呈剂量依赖性,表明AS-Ⅳ可能通过抑制Wnt/β-catenin信号通路的活化发挥抑癌作用。
综上所述,AS-Ⅳ可能通过下调Wnt-1、β-catenin、C-myc、Cyclin D1的表达,抑制Wnt/β-catenin信号通路的活化,显著改善肺癌小鼠的生存质量和肺组织病理变化,降低血清中肺癌标志物水平,从而发挥预防和治疗肺癌的作用。但肺癌的发生机制复杂,且本研究仅在动物实验中开展,AS-Ⅳ对肺癌的治疗作用仍需要更多的实验研究加以验证。
