Sirt3基因过表达慢病毒载体的构建及其在人神经母细胞瘤SH-SY5Y细胞中的表达
2021-02-22张静怡邓永宁屈秋民
张静怡,邓永宁,张 萌,屈秋民
(1.河南省人民医院老年医学科,郑州大学人民医院,河南 郑州 450003;2.西安交通大学第一医院神经内科,陕西西安 710061)
Sirtuins(Sirt)是一种烟酰胺腺嘌呤二核苷酸依赖的Ⅲ型组蛋白去乙酰化酶,Sirt家族有Sirt1~Sirt7等7个成员[1-2]。Sirt3主要分布于脑、肝脏、心脏、肾脏、骨骼肌及棕色脂肪组织中[3]。由于Sirt3主要位于线粒体内,而线粒体是产生ATP和活性氧及细胞代谢的场所,因此,Sirt3在越来越多的线粒体功能障碍相关疾病中成为研究热点[4-6]。有研究发现,Sirt3可以延长老年男性的寿命[7]。越来越多的研究发现,Sirt3与神经退行性疾病相关,如在阿尔茨海默病[8-9]、亨廷顿病[10-11]、肌萎缩侧索硬化症[12-13]等疾病模型中均发现Sirt3具有神经保护作用。帕金森病是神经退行性疾病中第二大疾病,严重限制患者的活动能力,影响患者的生活质量,给患者和社会带来沉重的医疗、经济负担,但其发病机制仍不明确。因此,探索其发生、发展的分子机制,寻找有效的治疗靶点尤为重要。大量研究表明,线粒体功能障碍[14]、氧化应激[15]、泛素蛋白酶系统异常及α-突触核蛋白沉积[16]等机制导致黑质多巴胺能神经元变性死亡可能与帕金森病的发病相关。目前,关于Sirt3在帕金森病发病中作用的研究较少。SH-SY5Y细胞来源于人神经母细胞瘤细胞,其具有神经细胞典型的形态特点,且具有儿茶酚胺能神经元以及多巴胺能神经元特性,因此,在帕金森病体外细胞模型制备中,SH-SY5Y是常用的细胞[17]。本研究拟通过构建Sirt3基因过表达慢病毒载体并转染SH-SY5Y细胞,从而获得稳定Sirt3基因过表达的细胞株,为后续研究Sirt3在帕金森病发病机制中的作用提供基础。
1 材料与方法
1.1 细胞、试剂与仪器293T细胞购自中国科学院上海细胞所,人神经母细胞瘤SH-SY5Y细胞购自美国ATCC公司,限制性内切酶购自美国New England Biolabs公司,聚合酶链反应(polymerase chain reaction,PCR)基因克隆试剂盒购自美国Clontech公司,质粒抽提试剂盒购自美国Promega公司,GV341载体Ubi-MCS-3FLAG-SV40-puromycin、pHelper 1.0载体、pHelper 2.0载体病毒滴度测定试剂盒购自上海吉凯基因技术有限公司,细胞培养基、胎牛血清、胰蛋白酶购自美国Hyclone公司,Lipofectamine 2000购自美国Invitrogen公司,RNA提取试剂盒购自美国Axygen公司,反转录试剂盒、实时荧光定量PCR(real-time quantitative PCR,qRT-PCR)试剂盒购自日本Takara公司,Western blot试剂盒、二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量检测试剂盒购自西安先锋生物科技有限公司,Sirt3兔抗多克隆抗体购自英国Abcams公司,β-actin鼠抗单克隆抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗兔免疫球蛋白G(immunoglobulin G,IgG)购自美国Santa Cruz公司;稳压DNA电泳仪购自美国Bio-Rad公司,阳性克隆测序采用美季生物技术,凝胶成像仪购自上海天能科技有限公司,PCR仪购自美国Applied Biosyste ms公司。
1.2 实验方法
1.2.1 Sirt3基因过表达慢病毒载体的制备
1.2.1.1 Sirt3基因片段的获取从GenBank上查找人Sirt3基因的序列(NM_012239),据此设计用于Sirt3基因扩增的特异性引物,引物中含交换配对碱基、酶切位点,并将含有目的基因5′端部分序列用于PCR获取目的基因。引物序列如下:Sirt3上游引物序列为5′-CCAACTTTGTGCCAACCGGTCGCCACCATGGCGTTCTGGGGTTGG-3′,Sirt3下游引物序列为5′-AATGCCAACTCTGAGCTTTTTGTCTGGTCCATCAAGC-3′。应用PCR扩增Sirt3基因片段。配制反应体系20μL[双蒸水12.4μL,5×Taq缓冲液4.0μL,三磷酸脱氧核苷酸1.6μL,上、下游引物各0.4μL,模板1.0μL,Taq聚合酶0.2μL],反应条件:94℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸2 min,共30个循环;72℃延伸10 min。然后将PCR产物置于质量分数1.0%琼脂凝胶中进行电泳,电泳完毕后进行漂洗、染色,并用凝胶成像系统进行拍照。
1.2.1.2 重组质粒的构建在AgeI、NheI酶切位点对Ubi-MCS-3FLAG-SV40-puromycin载体进行双酶切,PCR扩增,琼脂糖电泳分离纯化,获得线性化载体。将PCR扩增的目的基因产物连接入线性化表达载体,其产物转化大肠杆菌感受态细胞,应用氨卞霉素抗性细菌培养基进行筛选,将克隆质粒分为阴性对照组、空白对照组、阳性对照组、DNA Marker组、1-8号重组质粒组共12个组,分别加入双蒸水、空载自连质粒、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、DNA Marker组、1~8号重组质粒,行PCR凝胶电泳鉴定,对PCR鉴定阳性的克隆进行测序和比对分析。
1.2.2 慢病毒载体的包装与滴度测定
1.2.2.1 慢病毒载体的包装将制备好的重组病毒质粒及pHelper 1.0、pHelper 2.0载体质粒分别进行高纯度无内毒素抽提,按照Lipofectamine 2000转染使用说明书进行共转染293T细胞。转染前24 h,应用2.5 g·L-1胰蛋白酶消化对数生长期293T细胞,将消化后的293T细胞重新接种于15 cm细胞培养皿。向离心管中加入所制备的各DNA 溶液(GV341载 体)20 μg、pHelper 1.0载 体15μg、pHelper 2.0载体10μg,将稀释后的DNA与稀释后的Lipofectamine 2000进行混合,混合液转移至293T细胞的培养液中进行转染,转染后8 h更换为完全培养基,培养48 h后,收集富含慢病毒颗粒的细胞上清液,于4℃下4 000×g离心10 min,除去细胞碎片。以0.45μm滤器过滤上清液,置于40 mL超速离心管中,于4℃下4 000×g离心后将病毒浓缩液移出,分装后保存于病毒管中,置于-80℃冰箱中长期保存。
1.2.2.2 慢病毒载体滴度的测定应用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)测定病毒滴度。首先将病毒液稀释至1×107倍,并将标准品稀释,将稀释过的标准品和病毒样品加入微孔板,每孔200μL,用封板膜将微孔板密封好后放入37℃烘箱,静置1.5 h后加入100μL人类免疫缺陷病毒1型(human immunodeficiency virus type 1,HIV-1)P24检测抗体,对照孔除外。将板封好放入37℃烘箱1 h,洗板后每孔加入100μL底物,室温避光放置30 min。最后每孔加入100μL终止液终止反应。在15 min内,于酶标仪上读取样品450 nm处吸光度值。根据ELISA试剂盒提供的病毒浓度与滴度换算关系(104TU·L-1=103 pg·L-1),换算得到病毒滴度为1.2×1012TU·L-1。
1.2.3 慢病毒感染SH-SY5Y细胞取SH-SY5Y细胞,复苏并传代。取对数生长期SH-SY5Y细胞用2.5 g·L-1胰蛋白酶消化,制成细胞悬液,将细胞悬液接种于6孔板中培养,待细胞融合度达到约30%,根据预实验中确定好的细胞感染指数(multiplicity of infection,MOI),计算并在每个孔中加入病毒浓缩液。将SH-SY5Y细胞随机分为空白对照组、阴性对照组和Sirt3组。空白对照组SH-SY5Y细胞仅加入普通培养基;阴性对照组SH-SY5Y细胞转染阴性对照病毒;Sirt3组SH-SY5Y细胞转染Sirt3过表达慢病毒。转染3 d后,Sirt3组SH-SY5Y细胞中加入含3 mg·L-1嘌呤霉素的完全培养基培养3 d,获得稳定转染细胞株。
1.2.4 qRT-PCR 检测各组SH-SY5Y 细胞中Sirt3 mRNA相对表达量收集感染3 d并经嘌呤霉素筛选后的各组SH-SY5Y细胞,采用TRIzol法提取细胞总RNA。使用Takara反转录试剂盒进行反转录,将mRNA转录为cDNA,然后以cDNA为模板扩增Sirt3基因;使用qRT-PCR试剂盒检测各组细胞中Sirt3 mRNA表达水平,采用2-ΔΔCt法计算Sirt3 mRNA相对表达水平。
1.2.5 Western blot检测各组SH-SY5Y细胞中Sirt3蛋白表达量收集感染慢病毒3 d并经嘌呤霉素筛选后的SH-SY5Y细胞,使用裂解液、蛋白酶抑制剂制备蛋白样品,BCA蛋白定量试剂盒测定蛋白样品浓度,在蛋白样品中加入上样缓冲液,100℃煮沸5 min使蛋白变性。使用Western blot试剂盒制胶、上样、电泳,然后转移至聚偏氟乙烯膜上,将聚偏氟乙烯膜浸入封闭液中,室温下封闭2 h。将膜置于一抗(Sirt3兔抗多克隆抗体1∶1 000、β-actin鼠抗单克隆抗体1∶5 000)中,4℃孵育过夜,漂洗后滴加羊抗兔IgG二抗(1∶10 000),室温孵育,最后在暗室中应用发光液及X光片夹进行电化学发光。应用Image-J软件分析条带的灰度值。Sirt3蛋白相对表达量以Sirt3蛋白灰度值与β-actin蛋白灰度值比值表示。实验重复3次,取均值。
1.3 统计学处理应用SPSS 24.0统计软件进行数据统计与分析,计量资料以均数±标准差(±s)表示,2组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Sirt3基因琼脂糖凝胶电泳结果Sirt3基因序列PCR扩增产物琼脂糖凝胶电泳结果显示,产物大小约1 242 bp(图1),符合GenBank中获得的理论值,说明获取了Sirt3基因。
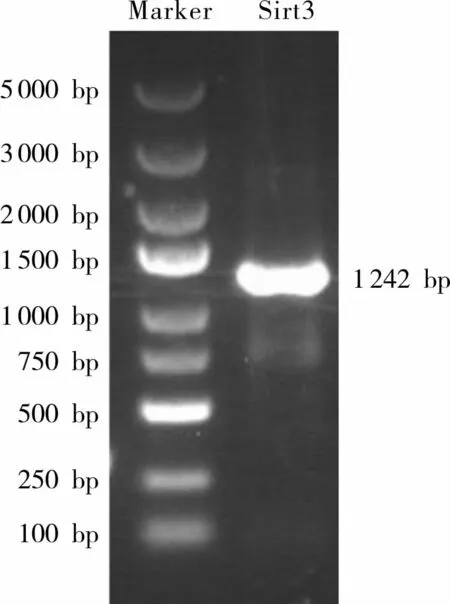
图1 Sirt3基因PCR扩增产物琼脂糖凝胶电泳结果Fig.1 Agarose gel electrophoresis result of Sirt3 gene PCR amplification products
2.2 重组慢病毒阳性克隆琼脂糖凝胶电泳及测序结果将重组质粒进行PCR扩增及琼脂凝胶电泳鉴定,得到长度约772 bp的阳性克隆PCR产物条带(图2);对PCR鉴定阳性克隆进行测序和比对分析,测序结果与目的基因序列完全一致(图3),表明成功构建了重组质粒。
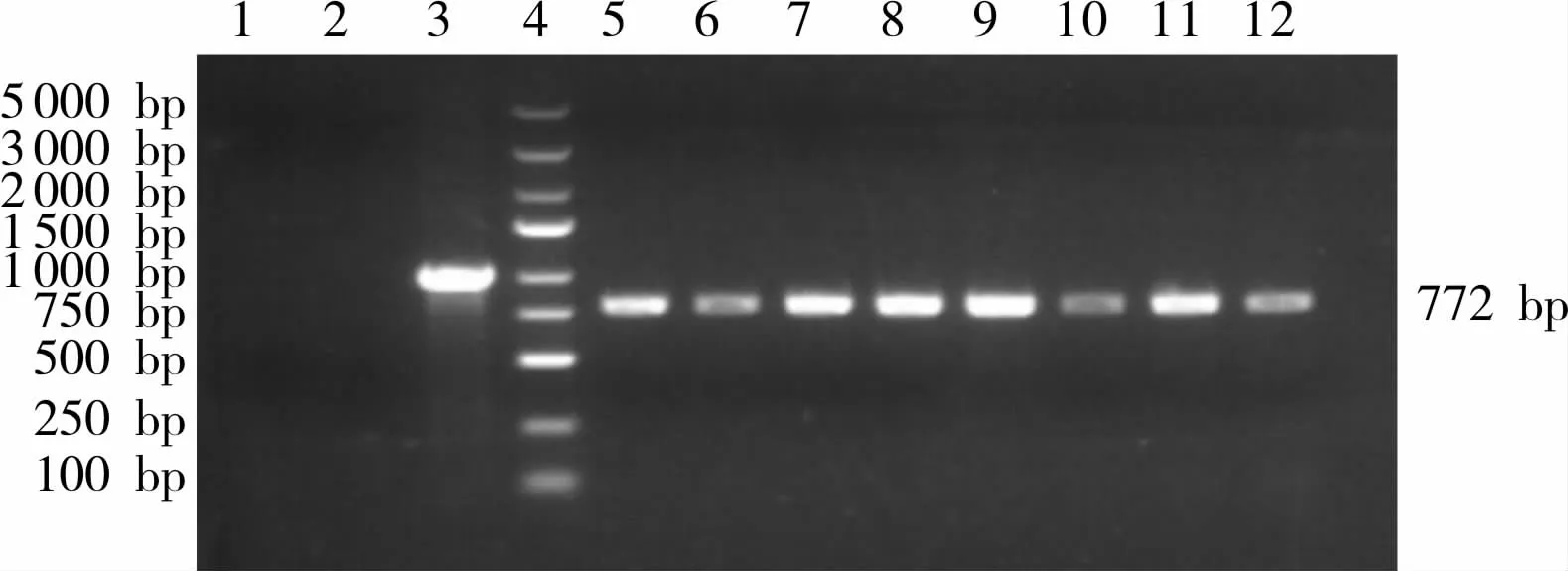
图2 重组慢病毒阳性克隆琼脂糖凝胶电泳结果Fig.2 Agarose gel electrophoresis results of recombinant lentivirus positive clones
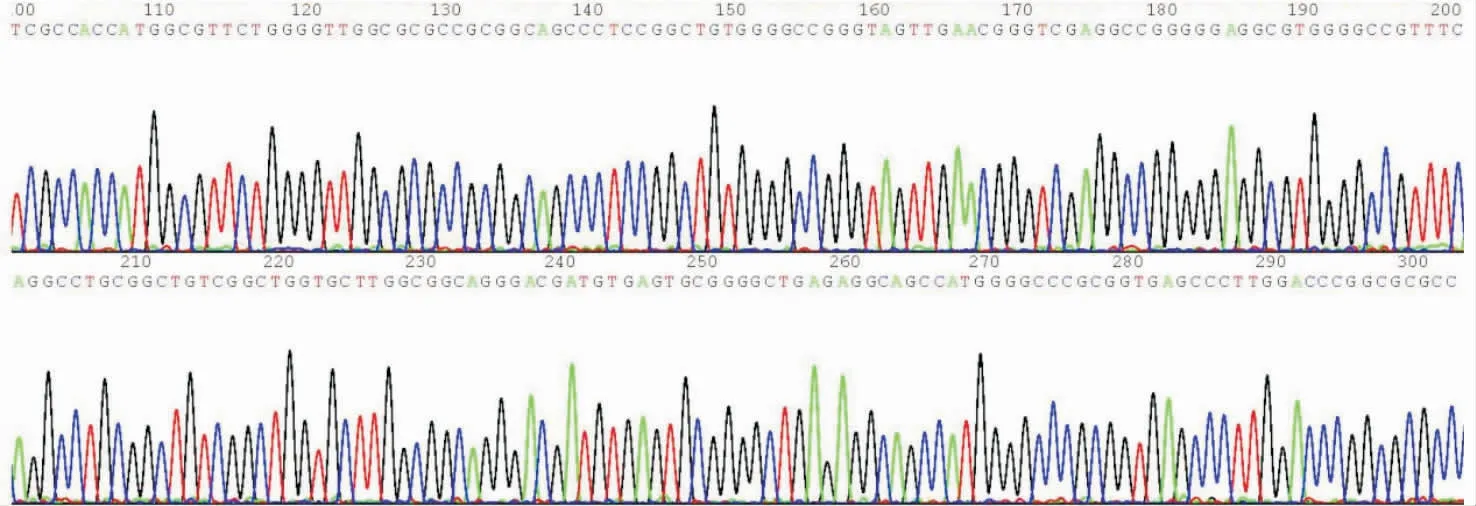
图3 重组慢病毒阳性克隆的部分测序结果Fig.3 Partial sequencing result of recombinant lentivirus positive clones
2.3 3组SH-SY5Y细胞中Sirt3 mRNA相对表达量比较空白对照组、阴性对照组及Sirt3组SH-SY5Y细胞中Sirt3 mRNA相对表达量分别为1.000 2±0.063 5、1.164 5±0.344 7、7.599 0±0.263 1。Sirt3组SH-SY5Y细胞中Sirt3 mRNA相对表达量高于空白对照组和阴性对照组,差异有统计学意义(t=-42.23、-25.70,P<0.01);空白对照组与阴性对照组SH-SY5Y细胞中Sirt3 mRNA相对表达量比较差异无统计学意义(t=-0.812,P>0.05)。
2.4 3组SH-SY5Y细胞中Sirt3蛋白相对表达量比较结果见图4。空白对照组、阴性对照组及Sirt3组SH-SY5Y细胞中Sirt3蛋白相对表达量分别为0.231 3±0.006 8、0.294 8±0.014 9、0.555 3±0.044 7。Sirt3组SH-SY5Y细胞中Sirt3蛋白相对表达量高于空白对照组和阴性对照组,差异有统计学意义(t=-12.414、-9.580,P<0.01);空白对照组与阴性对照组SH-SY5Y细胞中Sirt3蛋白相对表达量比较差异无统计学意义(t=-6.727,P>0.05)。
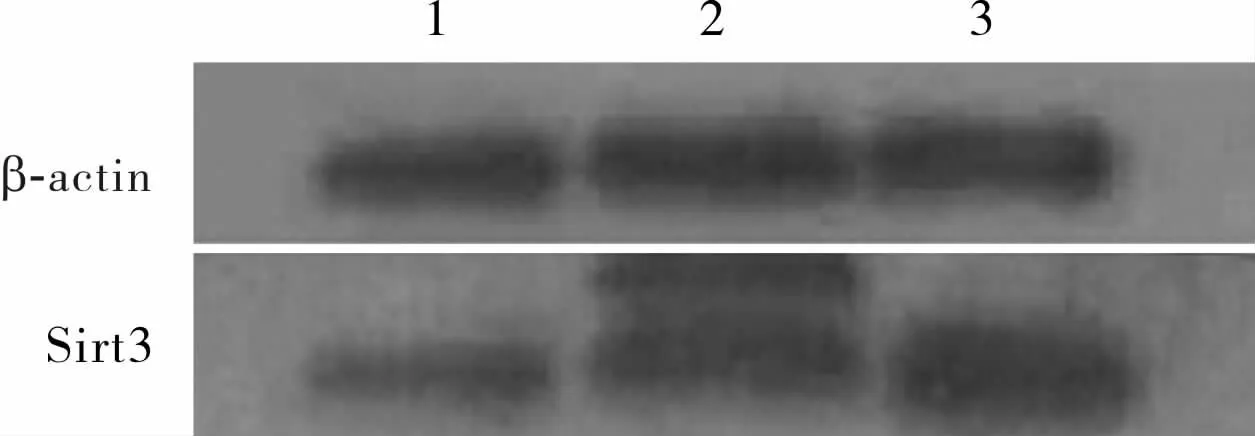
图4 3组重组慢病毒转染SH-SY5Y细胞中Sirt3蛋白表达(Western blot)Fig.4 Expression of Sirt3 protein in SH-SY5Y cells transfected by recombinant lentivirus(Western blot)
3 讨论
近年来,越来越多的研究证明,Sirt家族是治疗与衰老相关疾病的重要干预靶点[5,18]。Sirt家族中Sirt3、Sirt4、Sirt5主要位于线粒体内[19]。针对Sirt3的生物功能研究发现,Sirt3可通过去乙酰化各种酶调控线粒体内的能量代谢平衡[20]、减少线粒体产生的活性氧、超氧化物等对细胞的损伤[21],同时Sirt3还可以修复损伤的线粒体DNA[22]。基于Sirt3在线粒体代谢、减轻氧化应激损伤方面的研究结果[7],Sirt3在神经退行性疾病的作用也受到了关注。帕金森病作为神经退行性疾病中的第二大疾病,主要发生于65岁以上老年人,且以黑质纹状体多巴胺能神经元的进行性变性死亡为主要特点,主要临床症状为静止性震颤、肌强直、运动迟缓、姿势异常[23]。线粒体功能障碍在帕金森病的发病机制中扮演着重要角色。在α-突触核蛋白基因突变的帕金森小鼠中,Sirt3可通过稳定线粒体能量代谢对神经元起到保护作用[24]。研究发现,在1-甲基-4-苯基吡啶离子诱导的帕金森病小鼠中,Sirt3的增加减少了氧化应激,从而对神经元起到保护作用[25]。以上研究说明,Sirt3可以成为帕金森病治疗干预的新靶点,因此,进一步研究Sirt3在帕金森病中的保护机制及其信号通路等分子机制具有重要意义。慢病毒载体是以HIV为基础发展起来的基因治疗载体,能感染绝大多数的细胞,包括分裂细胞和非分裂细胞。慢病毒载体的基因组可以整合于宿主基因组,从而长时间、稳定地表达外源基因。实验研究表明,慢病毒可以成功转染细胞,提高转基因效率[26]。
本研究通过PCR扩增了Sirt3目的基因,凝胶电泳结果表明成功获取了Sirt3基因;然后将Sirt3基因插入慢病毒载体构建重组病毒质粒,通过对阳性克隆进行PCR鉴定及测序比对发现,测序结果与目的基因序列完全一致,说明成功构建了Sirt3过表达慢病毒载体。应用Sirt3过表达慢病毒载体感染SH-SY5Y细胞,qRT-PCR及Wester blot检测结果表明,Sirt3组SH-SY5Y细胞中Sirt3 mRNA和蛋白相对表达量显著高于空白对照组和阴性对照组,空白对照组与阴性对照组SH-SY5Y细胞中Sirt3 mRNA和蛋白相对表达量比较差异无统计学意义,说明可以通过Sirt3过表达慢病毒载体的成功构建,获得稳定过表达Sirt3的SH-SY5Y细胞株。
综上所述,本研究成功构建了Sirt3基因过表达慢病毒载体,并获得稳定表达Sirt3基因的SH-SY5Y细胞株,为后续研究Sirt3在帕金森病细胞模型中的生物学作用奠定了基础,并为研究Sirt3神经保护作用中上游及下游靶基因的具体机制提供了条件。
