益生菌制剂调控畜禽肠道健康与消化道微生物互作的免疫机制
2021-02-22赵金波张智慧赵文江韩永胜
赵金波 , 张智慧 , 李 伟 , 赵文江 , 韩永胜
(1.黑龙江省农业科学院畜牧兽医分院,黑龙江齐齐哈尔 161005;2.黑龙江省牧草育种与种质资源利用工程技术研究中心,黑龙江齐齐哈尔161005)
畜禽肠道不仅是营养物质吸收及排毒器官,也是机体内重要的免疫器官。 畜禽体内80%左右的免疫器官来源于肠道, 并且肠道内有60% ~70%的肠道淋巴相关组织分布在肠道内的各个部位, 对促进机体特异性免疫功能和非特异性免疫功能的发挥具有重要意义。有研究表明,肠道健康发挥营养物质代谢调控、肠道上皮细胞修复、肠道黏膜免疫激活、宿主行为调控、抵抗病原微生物等重要作用(Hooper,2015;Blaser,2014),因此本文从免疫制剂角度探讨益生菌制剂调控畜禽肠道健康机制,为开发益生菌产品提供理论参考。
1 益生菌制剂的种类与作用
1.1 益生菌制剂种类 益生菌制剂是指由单一益生菌制成的单一菌制剂或多种不同益生菌配伍制成的复合菌制剂。可以分成厌氧菌类,如嗜酸乳酸杆菌、干酪乳酸杆菌、拉曼乳酸杆菌等;双歧杆菌类,如长双歧杆菌、短双歧杆菌等;革兰氏阳性菌类,如粪链球菌、乳球菌等;需氧菌类,如枯草芽孢杆菌,还有一些酵母菌类。
1.2 益生菌制剂作用特点 限抗时代的到来,给抗生素替代品的发展带来了机遇和挑战。益生菌、酶制剂、酸化剂、植物精油、中草药发酵剂等一系列产品应运而生, 为我国无抗养殖业带来了福音和挑战。 益生菌制剂作为一类相对成熟的抗生素替代品,具有以下几个作用特点:
1.2.1 预防动物疾病 益生菌制剂中的有益微生物进入动物机体后,与有害菌在肠道进行竞争定植,夺取竞争位点,进而抑制有害菌的生长繁殖,从而使肠道中的菌群处于正常水平。同时,微生物产生初级代谢产物和有机酸,能够降低肠道内pH,从而杀灭有害菌;也能直接刺激肠道免疫细胞发挥体液免疫和细胞免疫,进而起到预防动物疾病的作用。
1.2.2 促进动物生长 益生菌制剂饲喂动物之后,许多菌体会产生大量的菌体蛋白,其中富含多种微生物,特别是维生素B12、叶酸和生物素,这些营养物质在促进动物生长、繁殖、妊娠、哺乳等重要生理环节,发挥直接的作用,此外,一些未知生长因子也能促进动物生长,增加产蛋和产奶量,提高生产性能。
1.2.3 减少环境污染 益生菌制剂被畜禽采食后,与肠道的微生态系统和宿主协同作用,提高了蛋白质利用效率,减少有害气体的排放,改善了舍内环境卫生,对畜牧业节能减排有积极的促进作用。
1.2.4 改善畜产品品质 益生菌抑制能够大幅度减少养殖过程中抗生素、 化学药物以及激素类药物的使用量,进而能够提高畜产品品质和安全性。
2 肠道健康与消化道微生物互作机制
2.1 影响肠道健康的因素
2.1.1 肠道内病原微生物及其产生毒素 病原微生物主要包括细菌、病毒和寄生虫等,这些微生物都能够产生内毒素和外毒素, 其中外毒素大部分是由革兰氏阳性菌产生的,诸如肉毒毒素、肠毒素等, 内毒素是由革兰氏阴性菌产生的, 诸如脂多糖。 这些病原菌及其产生的毒素会影响肠道屏障功能、 肠道生理结构的完整性, 最终引起畜禽便秘、有眼屎、泪斑、生长缓慢、呛毛等亚健康现象。
2.1.2 日粮中大量抗营养因子的存在 抗营养因子是植物在自然选择过程中形成的, 诸如大豆中的凝集素、高粱中的单宁等,都会影响营养物质在肠道中的消化吸收和物质转运。
2.1.3 肠道中微生态失衡 肠道中大量有害菌滋生,有益微生物在受到抑制,从而引起肠道微生态失衡,进而影响畜禽肠道健康。
2.1.4 日粮结构和环境条件 日粮中功能性氨基酸的供给、 饲料粉碎粒度的大小以及肠道pH 都会影响肠道健康,另外,畜禽所处的环境条件,诸如温度、湿度、有害气体等也都会影响肠道健康。
2.2 消化道微生物分布及其种类 肠道作为畜禽机体最大的组织器官,内部栖居大量微生物,畜禽从出生到成年阶段, 微生物的数量有助于胃肠道免疫系统组织的建立和细胞的发育及免疫因子的分泌。肠道中分布三种类型的微生物,第一种是肠道优势菌,诸如双歧杆菌和拟杆菌等;条件致病菌,在肠道菌群平衡是无害的,在特定的条件下,就会变成有害菌, 这类菌有肠道球菌、 葡萄球菌等;病原微生物,这种微生物在机体免疫力低下的情况下,可以引起机体感染疾病,这类菌有变形杆菌、魏氏梭菌等。
2.3 肠道健康与消化道微生物互助机制 畜禽肠道健康与消化道内微生物的分布、 数量以及种类有密切关系。 畜禽可能通过消化道微生物有三种互助机制维护肠道健康(图1)。
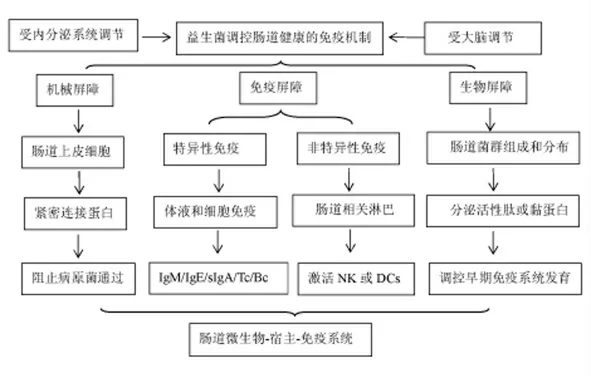
图1 消化道微生物三种互助机制
3 益生菌制剂对畜禽肠道免疫的调控机制
3.1 对应激条件下肠道免疫功能的调控 畜禽集约化养殖过程中应激广泛存在生产的各个环节。有研究表明,益生菌制剂在缓解断奶仔猪应激方面表现出积极的促进作用。 钟晓霞等(2020)在断奶仔猪日粮中添加甘露寡糖和复合益生菌制剂, 采用高通量测序技术对断奶仔猪结肠内容物进行了16S rRNA 基因测序, 发现乳酸杆菌属是结肠内的优势菌属。 乳酸菌在调节肠道免疫功能上主要表现为两个方面:(1)能够激发机体非特性免疫应答,刺激嗜中性粒细胞、单核巨嗜细胞以及自然杀伤细胞的活力, 进而发挥肠道内相关淋巴组织的功能。 (2) 能够激发机体的特异性免疫应答,增强机体T 细胞和B 细胞的活性,发挥肠道的细胞免疫功能, 也能够增强血清和肠道黏膜上的IgA、IgM 以及IgG 的分泌水平, 发挥肠道的体液免疫功能。 犊牛饲养是肉牛养殖过程中最为重要环节,决定着后期育肥效果。犊牛一般饲养情况下也容易出现应激,调控好瘤胃内环境参数,能够减少应激带来的不利影响。 聂炼等(2019)利用基因工程技术, 将抗菌肽CC31 基因在枯草芽孢杆菌中表达, 进而获得可以分泌抗菌肽的基因工程菌 WB800N-CC31, 将 WB800N-CC31 复合益生菌饲喂3 ~4 月龄的西门塔尔牛,结果表明,抗菌肽生产出的工程菌能够提高菌体蛋白和挥发性脂肪酸的含量,降低瘤胃的pH,这也表明工程菌能够提高瘤胃中的挥发性脂肪酸、 菌体蛋白和氨态氮的总体含量。 添加益生菌可以有效缓解断奶应激带来的不利影响。 张海涛等(2009)用纳豆枯草芽孢杆菌饲喂7 日龄的奶公犊牛, 通过电镜观察发现, 饲喂纳豆枯草芽孢杆菌的奶公犊牛的瘤胃微生物定植的种类和数量有所增加, 这也表明以乳酸杆菌、 枯草芽孢杆菌和丁酸梭菌为主要成分的益生菌制剂可能在益生菌定植共生过程中,能够协助宿主对抗病原菌等应激原的侵袭, 而幼畜在早期机体肠道内部形成复杂的微生物系统和完善的GALT 体系需要很长时间。因此,益生菌制剂能够有效激发机体肠道中的特异性免疫机制和非特异性免疫机制,从而提高机体的抗病能力。
3.2 对疾病条件下肠道免疫功能的调控 随着畜禽养殖规模化和集约化不断推进,畜禽呈现免疫抑制性疾病增多、新增疾病增多、多种疾病交叉感染的发病特点,进而畜禽养殖中出现了“亚健康”的状况。畜禽亚健康主要表现为肠道功能紊乱、便秘、泪斑、免疫力低下,进而影响畜产品的质量和安全。益生菌制剂在调节畜禽亚健康的机制上主要体现在增强畜禽机体免疫力。 张伟等(2016)用鼠李糖乳酸杆菌通过促进EGFR 非依赖Akt 激活,增加肠上皮细胞紧密连接屏障完整性,进一步限制F4+ETEC 侵袭,减弱F4+ETEC 引起的肠上皮细胞黏蛋白层破坏及凋亡;也表明益生菌影响了细菌感染的肠道上皮细胞发挥的免疫功能,增加了肠道屏障功能,维持了病菌感染的畜禽肠道菌群平衡。 其中乳酸菌在调控畜禽肠道炎症反应上, 具有重要的促进作用,Cao 等(2013)用产气荚膜梭菌感染肉鸡后,在日粮中添加益生菌表现出回肠的IL-10 表达水平和含量增加,IFN-Y 和TLR2 的水平降低。 这个研究也表明益生菌能够缓解病原菌对畜禽机体的影响,提高机体的抗病力。Rahimi 等(2003)用产气芽孢杆菌感染火鸡后,在火鸡日粮中添加益生菌,能够降低回肠中有害菌的数量,但是对免疫器官却没有显著影响。鲍玉林等 (2017) 在犊牦牛精料日粮中添加0、0.5、1.0 g/kg的微生态制剂,结果显示添加0.5 g/kg 和1.0 g/kg 组免疫球蛋白 IgG、IgA、IFN-γ 含量显著提高。 益生菌在缓解患病畜禽肠道健康上可能是有三种途径:(1)益生菌能够增强肠道上皮细胞屏障功能;(2)激发畜禽机体体液免疫和细胞免疫,抑制病原菌在肠道中定植数量;(3) 通过调控畜禽肠道黏膜SIgA 主效因子,进而发挥抗菌、抗病毒的功能。
3.3 对畜禽肠道黏膜SIgA 分泌和肠道组织形态学的调控 肠道免疫是由特异性免疫系统和非特异性免疫系统组成,肠道黏膜SIgA 分泌在激发肠道免疫中发挥重要作用。 益生菌制剂对畜禽肠道黏膜SIgA 分泌有着积极的促进作用,可能是益生菌发挥免疫功能最为重要的机制之一。 曾兴有等(2016)用微生态制剂饲喂樱桃谷肉鸭,结果表明,在肉鸭饲粮中添加300 mg/kg 微生态制剂,可以提高樱桃谷肉鸭胸腺指数、脾脏指数、十二指肠SIgA含量。 刘虎传等(2012)研究表明,在饲粮中添加益生菌制剂可显著增加仔猪断奶后第21 天血清IgG含量(P <0.05),其余时间有增加的趋势,但差异不显著; 益生菌组的空肠黏膜SIgA 和回肠黏膜SIgA 含量高于对照组, 并且第21 天的回肠黏膜SIgA 含量显著高于对照组(P < 0.05)。犊牛饲养中使用重组嗜酸乳杆菌可诱导肠黏膜免疫反应,促进肠黏膜分泌SIgA,增强肠黏膜免疫功能。肠道黏膜中的SIgA 对畜禽肠道免疫的作用,主要在由肠黏膜固有层中的IgA 浆细胞分泌, 是参与黏膜局部免疫的主要抗体, 通过与相应病原微生物 (细菌、病毒等) 结合,阻止病原体黏附到细胞表面,从而在局部抗感染中发挥重要作用 (王友湘和陈庆森,2007), 这也提示益生菌能刺激机体发挥SIgA的体液免疫功能,进而提高畜禽抗病力。
肠道是机体内重要的营养物质消化吸收器官,肠绒毛能极大地扩大营养物质的吸收面积,较高的绒毛高度/隐窝深度有利于营养物质的吸收(Mao 等,2016),梁明振等(2013)在断奶仔猪日粮中添加 6×109cfu 的丁酸梭菌和 1×1010cfu 的粪肠球菌,显著增加了空肠绒毛长度,绒毛高度/隐窝深度,降低了隐窝深度。 李玲茜等(2020)发现,添加复合益生菌组蛋雏鸡十二指肠和空肠的绒毛高度及绒腺比提高(P <0.05);复合益生菌组蛋雏鸡血清 IgA、IgG 含量提高(P < 0.05);复合益生菌组空肠 IL-4、IL-6 mRNA 相对表达量提高 (P < 0.05),海洋红酵母菌组空肠IL-4 mRNA 相对表达量提高(P < 0.05),枯草芽孢杆菌组空肠 IL-6 mRNA 相对表达量提高(P <0.05),这都提示益生菌制剂在改善肠道形态结构和肠道免疫功能上具有重要的促进作用。 李云锋等(2011)发现,用枯草芽孢杆菌能够提高仔猪小肠IgA 分泌细胞的数量, 添加益生菌制剂显著提高了断奶后第21 天仔猪血清IgG 和回肠 SIgA 含量, 空肠SIgA 的含量有所提高,但无显著差异。 这表明添加益生菌制剂可以改善断奶仔猪的体液免疫和黏膜免疫功能。
3.4 对畜禽肠道屏障功能和肠道免疫相关基因表达的影响 肠道上皮紧密连接蛋白是构成肠道屏障功能的结构基础, 其可以缓解病原菌对肠道上皮连接蛋白的损伤, 诱导肠道炎症因子损伤及肠道屏障结构的完整性和通透性(刑爽和冯京海,2019),进而引起畜禽机体免疫功能的抑制。 肠道细胞间连接紧密程度, 一方面决定着病原菌是否可以通过肠道屏障结构进入体内, 另一方面可以选择性的决定小分子营养物质的吸收和运转。 在病理条件下, 益生菌可以通过肠细胞连接蛋白表达和分布, 进而影响出现病毒性或细菌性肠道疾病。 有研究表明,在体外细胞培养条件下,将大肠杆菌K88 与肠道上皮细胞共同培养后,发现猪肠道上皮细胞的通透性明显下降, 其主要原因可能是降低了肠道上皮细胞Occuldin、Claudin-1 以及ZO-1 的表达和分布, 从而影响了肠道屏障功能(Yu 等,2018)。 乳酸菌可以有效调控肠道上皮细胞蛋白的表达和分布,改善病畜的肠道屏障功能,缓解肠道黏膜的损伤程度。体外试验条件下,罗伊氏乳酸杆菌能够显著增加结肠炎小鼠隐窝底部连接蛋白Occuldin 和ZO-1 的表达, 改善肠道屏障功能(Liu 等,2015)。 乳酸菌也可以调节肠道炎症细胞因子的平衡, 进而提高病畜肠道上皮细胞紧密连接蛋白的完整性。有研究发现,植物乳酸菌可以缓解大肠杆菌K88 感染猪肠道上皮细胞细胞系 IPEC-J12 的 IL-1β、IL-8 以及 TNF-α 表达水平, 肠道紧密连接蛋白恢复正常表达水平(Mao等,2016), 其中诱导产生的 TNF-α 和 IFN-γ 也可以影响肠道紧密连接蛋白的表达 (AL-Sadl,2016;Lee,2015)。
益生菌调控肠道免疫功能除了受肠道屏障功能完整性影响之外,还受肠道免疫miRNA 相关基因表达的影响。miRNA 可以参与肠道上皮细胞增殖、 细胞因子分泌和肠道免疫功能调控(Moein等,2019)。 有研究发现 miRNA 在结肠炎患者中11 个相关miRNA 位点中 miR-192 表达明显下降, 这个表达位点可以靶向调控巨嗜细胞炎症蛋白的表达,进而提高TNF-α 的大量产生,降低肠道屏障功能的完整性(姚俊等,2018)。在牛肠道中双歧杆菌和乳酸杆菌的数量与miRNA 中的miR-15/16、miR-29 和 miR-196 表达呈正相关(Slatter等,2019), 这也就提示益生菌能够调控宿主miRNA 相关基因的表达,影响淋巴组织和免疫细胞的发育,提高畜禽的抗病力。 同时,肠道菌群可分解营养物质产生的挥发性脂肪酸(乙酸、丙酸和丁酸),也可以调控肠道中的miRNA 的表达,进而影响肠道屏障功能。 其中丁酸还具有预防癌症的作用。有研究发现,在大鼠日粮中添加低聚糖可降低促癌基因miR-17 表达, 粪便中的丁酸含量却增加(Nielsen,2019),这也就提示益生菌可能是通过介导肠道miRNA 基因表达来影响肠道机械屏障、免疫屏障和生物屏障功能的。
4 发展趋势
益生菌制剂在调控畜禽肠道健康和宿主消化道微生物互作之间存在复杂的、潜在的关联,未来还需要从以下几点进行深入研究:(1)从营养物质与益生菌制剂组合效应角度出发, 按照氧化应激-炎症-免疫功能失调反应,研究益生菌制剂的作用机理。 (2) 建立益生菌制剂安全使用评价体系,通过无菌动物模型、菌群移植、肠道瘘管等方式实现益生菌制剂产业化发展。(3)针对不同生产目的的畜禽群体, 研制适用于不同生产需要的益生菌制剂,根据微生物对宿主的调控作用,确定复合益生菌制剂的主效菌。
