迷迭香脂溶性提取物在花生油中抗氧化性能研究
2021-02-18仝飞飞何际芳金永福王文庆郭海涛
(王 莹 仝飞飞 薛 刚 何际芳金永福 王文庆 郭海涛
(南阳理工学院1,南阳 473000)
(河南省工业微生物资源与发酵技术重点实验室2,南阳 473000)
(河南佳尚农业科技发展有限公司3,鲁山 467300)
(河南华牧生物科技有限公司4,社旗 473300)
油脂氧化是影响油脂品质的一个重要因素,氧化可分为自动氧化、光氧化和酶促氧化三种类型[1],以油脂的自动氧化最为常见[2-4]。油脂抗氧化的机理就是阻断油脂发生氧化,从而中断自由基的反应。抗氧化剂可分为合成抗氧化剂和天然抗氧化剂,合成的抗氧化剂主要有丁基羟基茴香醚 (BHA) 、二丁基羟基甲苯 (BHT) 、没食子酸丙酯 (PG) 、叔丁基对苯二酚 (TBHQ),天然抗氧化剂主要有生育酚、茶多酚、鼠尾草酸、鼠尾草酚等[5]。抗氧化剂的抗氧化能力测定指标为过氧化值[6]、共轭二烯类、酮类、DPPH自由基清除率[7]、ABTS自由基清除率[8]、脂肪酸组成[9,10]、非皂化物组成[11,12]。研究表明合成类抗氧化剂具有一定的毒性和致癌作用[13,14],采用天然抗氧化剂替代化学抗氧化剂成为现代食品抗氧化剂发展的趋势。迷迭香中含有黄酮类、萜类(包括单萜、二萜、三萜)、多支链烷烃、氨基酸及有机酸等多种化合物[15],董文宾等[16]认为目前已知迷迭香有萜类、黄酮类及迷迭香酸等约12种抗氧化活性成分,其中二萜类化合物主要包括二萜酚类和二萜醌类化合物,以脂溶性的鼠尾草酸和鼠尾草酚以及水溶性的迷迭香酸和迷迭香酚为主[17-19],是迷迭香中主要的抗氧化物质。鼠尾草酚的抗氧化活性和BHA相当,并且BHT和BHA的抗氧化活性只有迷迭香酚的1/5[20]。黄酮类化合物和三萜类化合物如熊果酸、齐墩果酸等这些物质同样具有较好的抗氧化性能[20, 21]。本研究将化学抗氧化剂BHA+BHT和天然抗氧化剂迷迭香脂溶性提取物添加至花生油中,经过对比花生油过氧化值、共轭二烯和酮类物质生成量、DPPH自由基清除率、ABTS自由基清除率、脂肪酸组成及非皂化物组成变化等指标差异,考察天然抗氧化剂迷迭香脂溶性提取物对花生油抗氧化性的影响,为企业生产添加迷迭香脂溶性提取物抗氧化剂的食用油产品提供参考。
1 材料与方法
1.1 材料与试剂
BHA、BHT为食品级,DPPH、ABTS、碘化钾、可溶性淀粉、氢氧化钾等试剂为分析纯。
迷迭香干叶、压榨花生油
1.2 仪器与设备
JMF320G多级闪蒸器,7890B气相色谱仪,BSA224S-CW电子天平, SB-5200DT超声波清洗机,752N紫外可见分光光度计等。
1.3 迷迭香脂溶物的制备
取迷迭香干叶按1∶10加入85%乙醇水溶液回流提取1.0 h,放出萃取液,再加入8倍85%乙醇水溶液,回流提取1.0 h离心,合并提取液,闪蒸仪浓缩至含酒精15%时,离心,沉淀干燥后即为迷迭香脂溶性粗品。迷迭香脂溶性粗品加2倍丙酮溶解,离心得上清液,浓缩作为鼠尾草酸产品(48.48%)混合物,沉淀干燥作为熊果酸+齐墩果酸(51.52%+7.65%)混合物。
1.4 花生油中抗氧化剂的添加
按照GB / T 2760—2014《食品安全国家标准 食品添加剂使用标准》确定BHA+BHT的添加量为5 mg/50 g+5 mg/50 g。由于目前国内无关于鼠尾草酸和齐敦果酸在油脂产品中添加量的具体标准,故依据其IC50[22]确定鼠尾草酸产品的添加量为17.90 mg/50 g,熊果酸+齐墩果酸(51.52%+7.65%)混合物的添加量为23.87 mg/50 g。准确称取4份花生油样各50 g,其中3份分别添加BHA+BHT、鼠尾草酸原料和齐墩果酸+熊果酸原料,以不添加任何抗氧化剂的花生油作为空白油样,其余操作均相同。
加入不同种类的抗氧化剂后,对各油样进行相同处理:常温条件下超声处理10 min,必要时可放入50 ℃水浴锅中加热10 min,待抗氧化剂完全溶解在花生油中后装入小油样瓶中,将处理好的4组花生油油样放置在63 ℃的电热鼓风干燥箱中,每隔0、5、10、15、20 d取出一部分样品测定油样的各项指标。
1.5 花生油抗氧化性能指标的测定方法
1.5.1 油样过氧化值的测定
参考国标GB/T 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》[23]测定油脂的过氧化值。
1.5.2 油样共轭二烯值、酮类物质的测定
方法参照GB/T 22500—2008[24]《动植物油脂 紫外吸光度的测定》。
1.5.3 油样 DPPH自由基清除能力的测定
吸取0.5 μL油样放入含5 mL无水乙醇的具塞试管中,振荡溶解后加2 mL 0.1 mmol/L DPPH溶液,于常温下暗处静置10 min后取出,在517 nm波长下测定吸光值,用无水乙醇作空白。根据式(1)计算油脂的DPPH自由基清除率。
清除率=(A0-A1)/A0×100%
(1)
式中:A0为DPPH溶液的吸光值;A1为油样的DPPH溶液的吸光值。
1.5.4 油样ABTS自由基清除能力的测定[25]
吸取配好的7 mmol/L ABTS 水溶液与2.45 mmol/L过硫酸钾溶液等体积混合后充分摇匀,置于黑暗处16 h后使用。取1 mL该混合液,用40 mL甲醇溶液调节混合液的吸光度,使其在734 nm下的吸光值范围为0.70±0.02,即为ABTS反应液。向试管中分别加入6 mL的ABTS反应液,进行编号,再分别吸取20 μL各油样按编号放入10 mL的具塞试管中,多次振荡混匀,静置8 min 后在734 nm波长下测吸光值,用甲醇溶液作空白。根据式(2)计算四组花生油油样的ABTS自由基清除率。
清除率=(A0-A1)/A0×100%
(2)
式中:A0为ABTS反应液的吸光值;A1为加入油样后ABTS反应液的吸光值。
1.5.5 油样脂肪酸和非皂化物的组成的测定[26]
1.5.5.1 样品处理
非皂化物:取0.3 g油样→加0.5 mol/L KOH—甲醇溶液3 mL,振荡摇匀→置于65 ℃水浴中皂化,期间不停地摇荡→30 min后取出,加3 mL正己烷进行萃取,静置0.5 h→吸取上清液于样品瓶中,即为非皂化物产品,取样测定含量。
皂化物:下层溶液→加0.2 mL BF3-乙醚溶液→置于65 ℃水浴中,振荡摇匀,甲酯化10 min→取出后立刻用自来水冲洗冷却→加入2 mL石油醚进行萃取,静置→吸取上清液于样品瓶中,即为皂化产品,取样测定测脂肪酸含量。
1.5.5.2 油样脂肪酸组成的测定
气相色谱分析条件:参照薛刚的检测方法[27]加以改进,FFAP色谱柱(30 m×0.32 mm×0.25 μm),进样口260 ℃,检测器270 ℃,140 ℃,流速1mL/min,保持0.5 min→8 ℃升温至165 ℃,保持2 min→2 ℃升为至185 ℃保持18 min,共33.6 min。进样量1 μL,分流比20∶1。
1.5.5.3 油样非皂化物组成的测定
气相色谱分析条件:DB-5柱(30 m×0.32 mm×0.25 μm),进样口300 ℃,检测器300 ℃,流速1.2 mL/min,240 ℃保持5 min→以5 ℃升为至310 ℃保持5 min,分流比8∶1。
2 结果和分析
2.1 油样过氧化值的变化
经过处理的花生油样品放进63 ℃恒温箱里放置,每隔5 d用硫代硫酸钠滴定法测定油样的过氧化值,测定结果见表1。
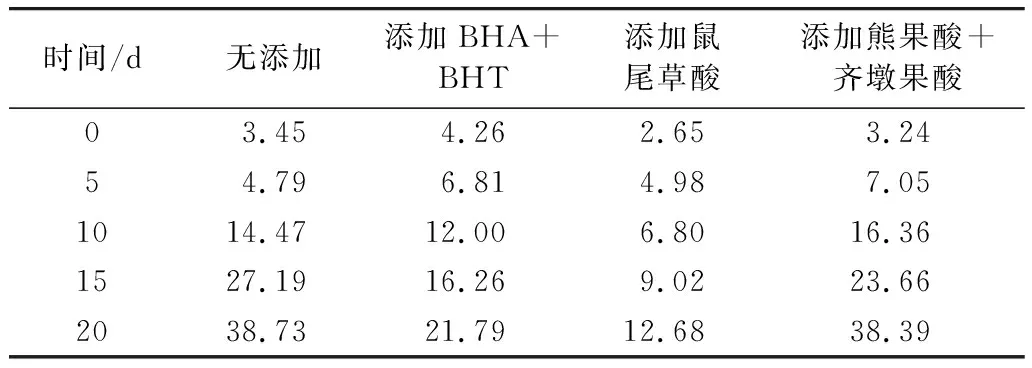
表1 花生油的过氧化值测定结果/mmol/kg
根据表1可知,经过20 d的高温加速氧化实验,油样的过氧化值均呈上升趋势,说明高温条件下油脂一直被氧化,油脂氧化过程的产物过氧化物积累,故油样的过氧化值均逐步递增。油样过氧化值增长幅度大小顺序为:无添加﹥熊果酸+齐墩果酸﹥BHA+BHT﹥鼠尾草酸,说明油样中添加BHA+BHT、鼠尾草酸、熊果酸+齐墩果酸都可有效减缓油脂过氧化值的增长,其中花生油中添加鼠尾草酸减缓油脂过氧化值的增长的效果最显著。
2.2 油样共轭二烯类、酮类物质的含量变化
经过处理的花生油样品放进63 ℃恒温箱里放置,每隔5 d用紫外分光光度法测定油样的共轭二烯值、酮类物质,测定结果见表2。
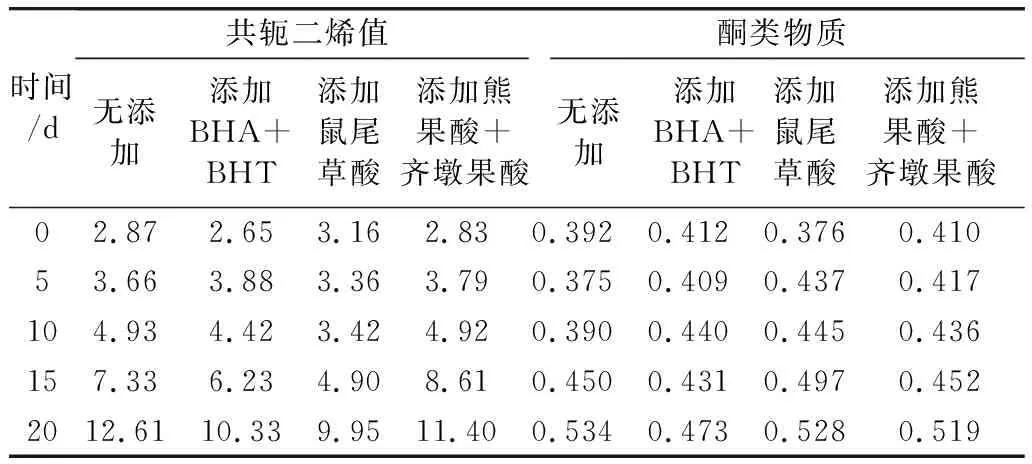
表2 几种花生油样品共轭二烯值及酮类物质含量的测定结果
根据表2可以看出,随着加热时间的增加,不断生成共轭二烯类物质,故油脂的吸光值逐步增加。油脂氧化过程中,油样中添加鼠尾草酸的花生油的共轭二烯值增长率最小,油样的共轭二烯值增长幅度大小顺序:无添加﹥熊果酸+齐墩果酸﹥BHA+BHT﹥鼠尾草酸,说明油样中添加抗氧化剂可有效抑制油脂共轭二烯类物质的生成,其中花生油中添加鼠尾草酸抑制油脂共轭二烯类物质生成的效果最显著。
由表2可知,经过20 d的高温加速氧化实验,油样中酮类物质的含量整体呈增长趋势,但油样之间酮类物质增幅趋势相近,说明鼠尾草酸、熊果酸+齐墩果酸和BHA+BHT对花生油中酮类物质的抑制作用差异不明显。
2.3 油样 DPPH自由基清除能力的变化
经过处理的花生油样品放进63 ℃恒温箱里放置,每隔5 d用DPPH法测油样的DPPH自由基清除率,测定结果见表3。
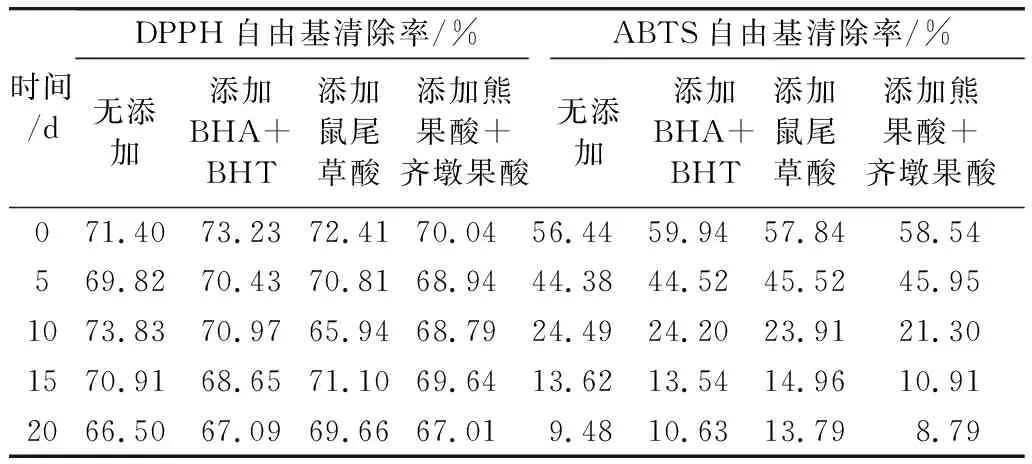
表3 几种花生油的自由基清除率测定结果
根据表2可知,随着高温储藏时间的增加,没添加抗氧化剂和添加抗氧化剂的油样DPPH自由基清除率整体呈下降趋势。其中添加鼠尾草酸的油样的DPPH自由基清除率的下降速率比其他3组油样缓慢,油样的DPPH自由基清除率下降幅度大小顺序:无添加﹥熊果酸+齐墩果酸﹥BHA+BHT﹥鼠尾草酸,说明油脂中抗氧化剂可有效减缓油脂DPPH自由基清除率的下降速率,其中花生油中添加鼠尾草酸的减缓效果最明显。
2.4 油样ABTS自由基清除能力的变化
经过处理的花生油样品放进63 ℃恒温箱里放置,每隔5 d用ABTS法测定油样的ABTS自由基清除率,测定并计算的结果见表2。经过20 d高温加速氧化实验,各种油样的ABTS自由基清除率均呈下降趋势,其中添加鼠尾草酸的油样的ABTS自由基清除率的下降速率比其他3组油样缓慢,油样的ABTS自由基清除率下降幅度大小顺序:熊果酸+齐墩果酸﹥无添加﹥BHA+BHT﹥鼠尾草酸,说明油样中添加BHA+BHT、鼠尾草酸、熊果酸+齐墩果酸均可有效减缓油脂ABTS自由基清除率的下降速率,其中花生油中添加鼠尾草酸的减缓效果最明显。
2.5 油样脂肪酸组成和非皂化物组成的含量变化
经过处理的花生油样品放进63 ℃恒温箱里放置,每隔5 d用气相色谱法测定油样的脂肪酸组成和非皂化物组成的含量,测定脂肪酸组成,结果见图1。
根据图1可知,油样的饱和脂肪酸组成变化趋势较为平缓,而不饱和脂肪酸整体呈现下降趋势,添加抗氧化剂的花生油油样能明显抑制不饱和脂肪酸的氧化,花生油中不饱和脂肪酸含量下降幅度大小:无添加﹥熊果酸+齐墩果酸﹥BHA+BHT﹥鼠尾草酸,说明花生油中添加抗氧化剂可抑制不饱和脂肪酸的氧化,其中添加鼠尾草酸抑制不饱和脂肪酸的氧化效果最显著。
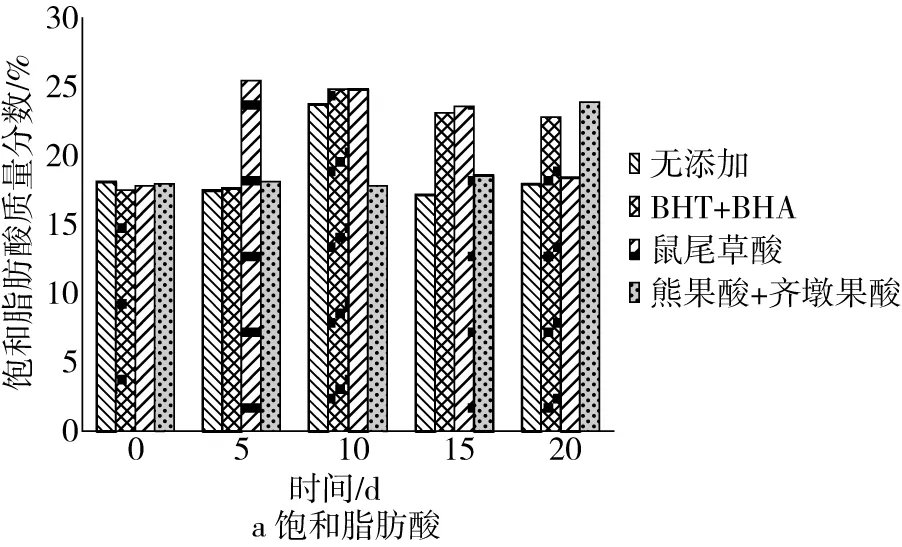
图1 花生油饱和脂肪酸和不饱和脂肪酸组成含量的变化
花生油中含有一定量的β-VE、γ-VE、α-VE、角鲨烯、菜籽甾醇、菜油甾醇、豆甾醇和β-谷甾醇,这8种非皂化物成分也具有一定的抗氧化活性。对实验中添加不同抗氧化剂所得的油样中非皂化物成分进行分析,结果如图2所示。
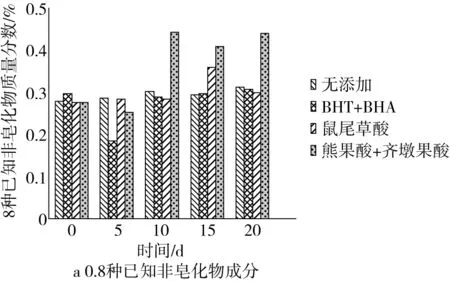
图2 花生油非皂化物成分含量的变化
根据图2可知,花生油油样的已知非皂化物呈先上升后下降的趋势,而其他非皂化物组分呈先下降后上升的趋势,说明花生油油样中β-VE、γ-VE、α-VE、角鲨烯、菜籽甾醇、菜油甾醇、豆甾醇和β-谷甾醇这8种非皂化物成分在20 d的高温贮藏阶段并没有明显被消耗,添加的迷迭香脂溶性提取物和BHA+BHT可有效减缓花生油的氧化速率。
3 结论
本研究把迷迭香脂溶性提取物鼠尾草酸、熊果酸+齐墩果酸和BHA+BHT添加到花生油中,经过20 d高温加速氧化实验,对比不同花生油油样的指标差异,研究迷迭香提取物在花生油中的抗氧化效果。由结果可知:鼠尾草酸对减缓花生油过氧化值增长、抑制共轭二烯类物质生成、减缓油脂DPPH自由基和ABTS自由基清除率下降的效果显著,可显著抑制油脂中不饱和脂肪酸的氧化,抗氧化效果优于BHA+BHT的,而熊果酸+齐墩果酸抗氧化效果略逊于BHA+BHT的。迷迭香提取物和BHA+BHT对花生油中酮类物质的抑制作用差异不明显。
