不同干燥方式对艾草品质的影响
2021-02-10于士军周怡倩徐志香徐馨怡刘金月
于士军,程 铭,周怡倩,王 伟,徐志香,徐馨怡,刘金月
1.滁州学院生物与食品工程学院,安徽滁州,239000;2.宣城市农产品质量安全监管局,安徽宣城,242000
中国是药用植物资源最丰富的国家之一,对药用植物的发现、使用和栽培,有悠久的历史。世界卫生组织报告显示,世界上将近80%的人口在其主要医疗保健中依靠非常规药物治疗,尤其是食用功能性草药[1]。艾草(ArtemisiaargyiLévl.et Van.),又名艾叶、香艾、艾蒿,为菊科多年生草本植物艾的叶。主要分布于北温带地区,特别是亚洲、欧洲和北美洲[2],中国大部分地区均产。《本草纲目》记载:艾草具有驱邪、净化之功效;驱寒止痛、美容养颜、延缓衰老之功能[3]。目前对艾草的研究多集中于可食用植物化学物质,如精油[4]、类黄酮、有机酸[5]、萜烯[6]、多糖[7]和香豆素[6]等,现代研究证明这些特征成分对健康有积极影响,具有抗氧化、抗肿瘤、抗菌消炎[8]、抗骨质疏松[9]、保护神经[10]和免疫调节[7]等作用,但不同干燥方式对艾草品质的影响方面的研究鲜见报道。
中药指纹图谱基于对中药物质群整体作用的认识,借助光谱和色谱等手段获得药物特征图谱,可用于鉴别中药真伪及评价其质量一致性,同时反映中药中多种成分的含量情况,对全面控制其质量尤为重要[11]。本文主要以艾草主要有效物质酚类化合物含量为指标,建立高效液相色谱指纹图谱,并比较不同干燥方式对艾草总黄酮含量及抗氧化活性的影响,综合考察较为常见的热风干燥、晒干和阴干3种干燥方式对艾草的影响,并进行主成分分析和聚类分析,以期为艾草干燥方式的选择提供理论依据。
1 材料与方法
1.1 仪 器
Agilent 1260II高效液相色谱仪,美国安捷伦公司,配备自动进样器、四元泵、DAD检测器、在线脱气装置、ChemStation工作站;BPG-9070A鼓风干燥箱,上海一恒科技有限公司;KQ3200DA数控超声波清洗器,深圳洁盟清洗设备公司;SpectraMax Plus384全波长酶标仪,Molecular Devices公司;JP-400B高速多功能粉碎机,永康市久品公司;MINI-10K+微型离心机,杭州米欧公司;HX-01N真空泵,顺信科技公司;FA2204B分析天平,上海越平公司;SFY-20红外线快速水分测定仪,深圳市冠亚电子科技有限公司。
1.2 试剂与样品
磷酸(分析纯),深圳市科天化玻仪器有限公司;甲醇(分析纯),甲醇(色谱纯),天津科密欧公司。去离子水、超纯水为实验室自制,其他试剂均为分析纯。
对照品木犀草苷(批号:MUST-15012204,质量分数>99.77%),绿原酸(批号:MUST-15041814,质量分数>99.39%),均购自成都曼思特生物科技有限公司;异绿原酸A(产品编号:I117946,质量分数>99.00%),芦丁(产品编号:R189033,质量分数>98.00%),表儿茶素(产品编号:E107318,质量分数>98.00%),购自上海阿拉丁生化科技股份有限公司;艾草样品采集自安徽省明光市涧溪镇祝岗村(N 118°16′1.65″,E 32°48′15.49″)。
1.3 方 法
1.3.1 样品干燥与制备
晒干干燥(SD):艾草平铺在纱网上,置于阳光直射下,温度25~30 ℃之间,光照强度6×104~105lx;阴干干燥(SHD):艾草平铺在纱网上,放在阴凉干燥通风的室内,平均温度为20~25 ℃;热风干燥(HAD):设定干燥温度60 ℃,风速2.5 m/s。以上干燥后样品控制含水分量在5%~10%左右。
用粉碎机对3种干燥方式处理的艾草样品进行粉碎,每次时间1 min,每次间隔10 min,粉碎5次,过80目筛。将3种方式干燥的粉状样品1式4份装入密封袋,存放于4 ℃冰箱中备用。
1.3.2 对照品溶液配制
分别精密称取对照品绿原酸、异绿原酸A、木犀草苷、芦丁和表儿茶素对照品适量,置于25 mL,用75%甲醇配置成含绿原酸102.00 g/mL、异绿原酸A 61.20 g/mL、木犀草苷52.00 g/mL、芦丁415.00 g/mL和表儿茶素78.80 g/mL。用0.22 m微孔滤膜过滤,得混合对照品溶液,备用。
1.3.3 供试品溶液配制
分别精确称取3种不同干燥方式获得的艾草样品粉末0.20 g,置20 mL离心管中,加入75%甲醇5 mL,每种样品做4个重复。在300 W、30 ℃条件下超声30 min(过程中每隔10 min须摇晃混匀),用离心机在8 000 r/m条件下离心5 min,然后用一次性注射器吸取上清液1 mL,通过有机系滤头(0.22 μm)过滤装入样品瓶中,得到供试品溶液。
1.3.4 色谱条件
色谱柱:Eclipse Plus C18色谱柱(250 mm×4.6 mm,5 m);流动相:0.5%磷酸水溶液(A)-甲醇(B);流速:1 mL/min;柱温:30 ℃;检测波长:320 nm;进样量:10 L。采用梯度洗脱:0~5 min,35% A;20 min,42% A;22 min,50% A;25 min,70% A;30min,70% A;33 min,35% A;37 min,35% A。
1.3.5 指纹图谱方法学考察
精密度试验取阴干干燥艾草制成的供试品溶液,在“1.3.4”项色谱条件下进样测定6次,以峰面积稳定、峰形良好、保留时间适宜的14号色谱峰为参照峰,计算其余色谱峰相对保留时间RSD为0.02%~0.18%,相对峰面积RSD为0.02%~3.57%,表明仪器精密度良好。
稳定性试验取热风干燥艾草制成的供试品溶液,于0、2、4、6、8、24 h在“1.3.4”项色谱条件下进样测定,测得共有峰相对保留时间RSD为0.25%~2.47%,相对峰面积RSD为0.23%~3.56%,表明溶液在24 h内稳定性良好。
重复性试验取晒干干燥艾草6份,每份0.20 g,按“1.3.3”项下方法制备供试品溶液,在“1.3.4”项色谱条件下进样测定,测得共有峰相对保留时间RSD为0.04%~0.28%,相对峰面积RSD为1.82%~5.06%,表明该方法重复性良好。
1.3.6 总黄酮含量的测定
移取各干燥方法的艾草总黄酮提取液1 mL,置10 mL容量瓶中,加入体积分数为5% NaNO20.4 mL,摇匀,放置10 min,再加入体积分数为10%的Al(NO3)3溶液0.4 mL,摇匀,放置6 min,最后加入体积分数为4% NaOH溶液4 mL,摇匀,用70%乙醇溶液定容至刻度线,静置15 min,于510 nm波长处测定吸光度A。以芦丁为标准对照,按上述方法,绘制标准曲线[12]。
1.3.7 抗氧化性的测定
参考文献[13-15]方法进行微调测定DPPH清除率,DPPH用无水乙醇配制成0.2 mmol/L溶液。依次在10 mL离心管中加入1 mL样品提取液和4 mL DPPH溶液,充分混匀,室温环境避光放置30min,在517 nm波长处测定吸光度值,平行测试3次,计算清除率。DPPH清除率=[A0-(A1-A2)]/A0,其中A1:1 mL样品提取液+4 mL DPPH溶液的吸光度;A2:1 mL样品提取液+4 mL无水乙醇的吸光度;A0:1 mL 75%甲醇+4 mL DPPH溶液的吸光度。
参考文献[16-17]并略做修改,采用铁氰化钾还原法测定不同方式干燥艾草的总还原力。吸取样品提取液1 mL于20 mL离心管中,依次加入0.2 mol/L磷酸缓冲溶液2.50 mL、1%铁氰化钾溶液2.50 mL,于50 ℃保温20 min,快速冷却,再加入10%三氯乙酸溶液2.50 mL,以3 000 r/min离心10 min,取上清液2.5 mL,依次加入无水乙醇2.50 mL、0.1%三氯化铁溶液0.50 mL,混匀,以0.20 mg/mL维生素C溶液做阳性对照,使用酶标仪于700 nm处测定吸光度。
参照文献[18-20]的方法测定不同方式干燥艾草清除羟基自由基能力。取样品提取液1 mL于20 mL离心管中,分别加入6 mmol/mL硫酸亚铁溶液1 mL、6 mmol/mL水杨酸-乙醇溶液1 mL、6 mmol/mL过氧化氢溶液1 mL、混合均匀,37 ℃水浴锅中恒温反应1 h,使用酶标仪于510 nm处测定体系吸光度(Ai);以蒸馏水取代过氧化氢溶液,测定吸光度(Aj);以蒸馏水取代待样品提取液,测定空白吸光度(A0),计算清除力。清除率=[1-(Ai-Aj)/A0]。
1.4 数据分析
数据处理采用中药色谱指纹图相似度评价系统、SIMCA、SPSS 23.0和Excel 2017等软件进行处理,通过单因素方差分析以及LSD多重比较法对不同方式干燥艾草中指标含量的差异显著性进行分析讨论,显著性水平P<0.05;然后从主成分分析、聚类分析以及相似度分析等方面探究不同干燥方式对艾草主要成分含量的影响和变化情况。
2 结果与分析
2.1 指纹图谱的生成
将HPLC检测得到的数据导入《中药色谱指纹图谱相似度评价系统(2012A版)》进行分析,选中间样品HAD1的指纹图谱为参照图谱,采用多样本平均数矢量综合作为共有模式矢量,时间宽度设定为0.50,对色谱峰进行多点校正和全峰匹配,得到指纹图谱。每种干燥方式的艾草平行实验4次一共12个指纹图谱,从下向上依次是热风、晒干和阴干干燥的艾草,共计27个色谱峰。3种方式干燥艾草的HPLC指纹谱图分别有27、25、27个峰。计算得到各色谱峰相对峰面积,如表1所示。

表1 高效液相色谱(HPLC)特征峰的相对峰面积
经与对照品溶液色谱图比对后,指认了样品图谱中6、15、16、17、22号峰色谱峰分别为绿原酸、异绿原酸A、木犀草苷、芦丁和表儿茶素,对照品色谱图(见图1)。
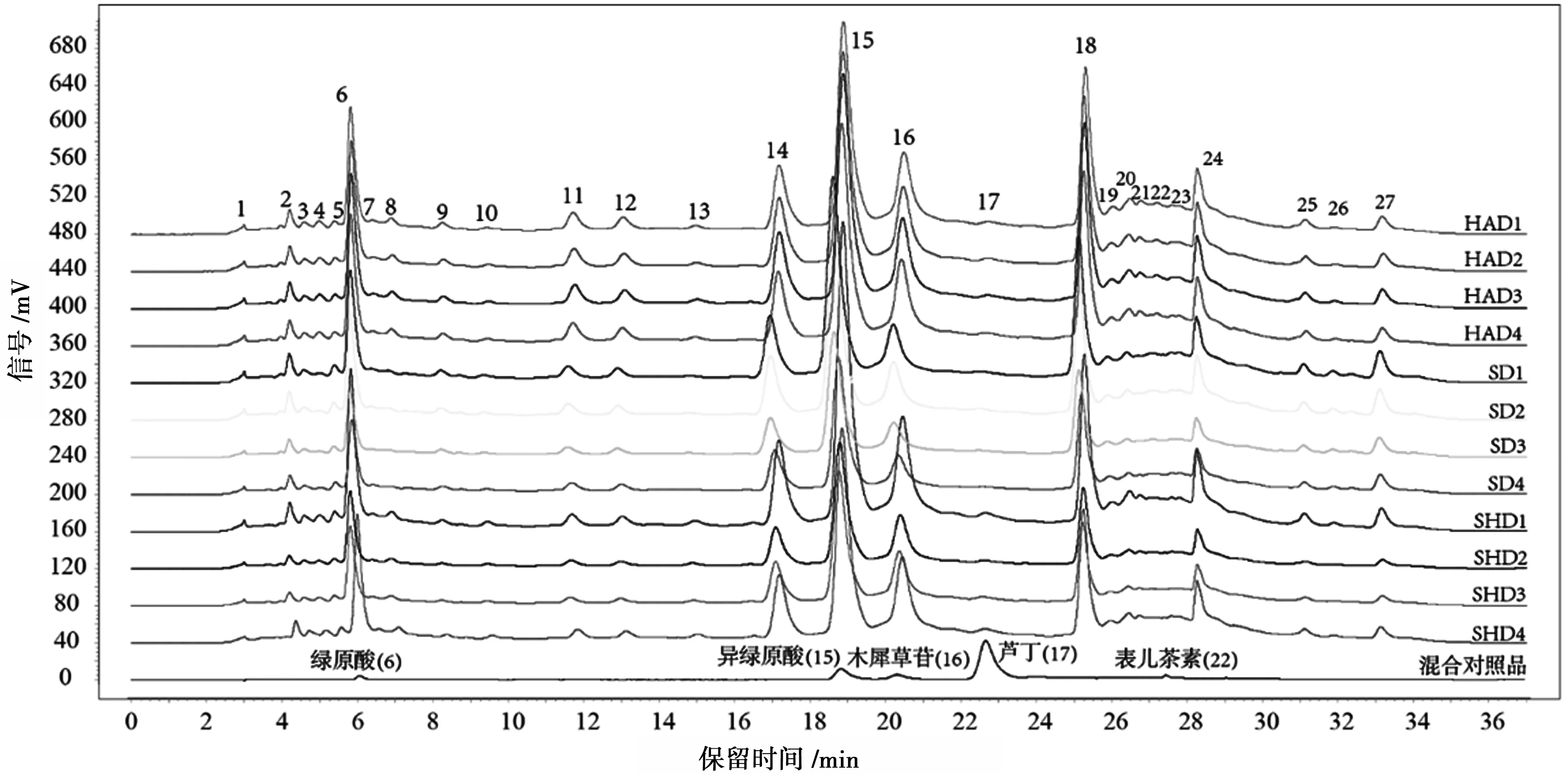
图1 不同方式干燥艾草HPLC指纹图谱
2.2 主成分分析
HPLC指纹图谱27个峰面积数据导入SIMCA 13.0软件,然后对其进行标准化处理,将处理后的峰面积进行主成分分析,结果见图2,相关矩阵的特征值及其方差见表2。提取得到5个主成分,其累积方差贡献率达到95.4%。其中前4个主成分的特征值大于1,他们的累计方差贡献率为91.5%。故前4个主成分能代表3种干燥方式下艾草样品中化合物组分含量91.5%的信息。
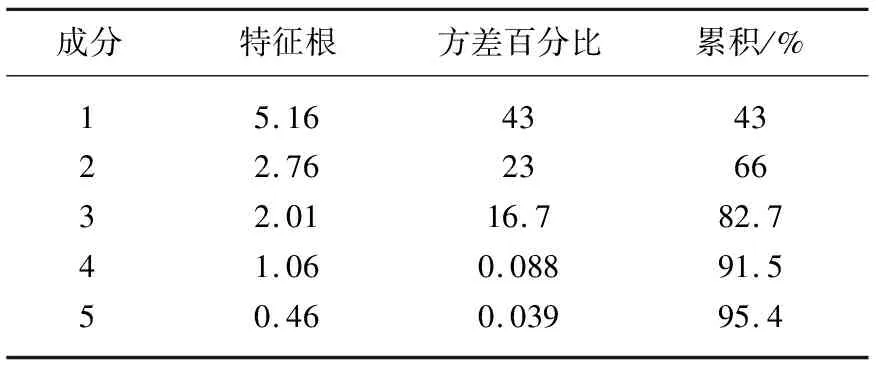
表2 主成分的特征值和贡献率
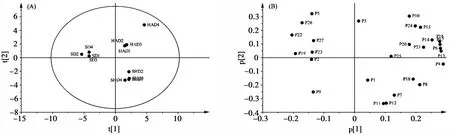
图2 主成分分析得分图和载荷图
PCA分析的得分图如图2(A)所示,可直观看到3种不同干燥方式艾草样品分布在不同区域,晒干艾草和阴干艾草样品分别聚为两簇,热风干燥4号样品距离其余3个热风干燥艾草距离稍远。主成分载荷图如图2(B)所示。艾草化学成分众多,多成分相互作用才是影响不同干燥方式间差异的重要原因。主成分的载荷图中指标与原点距离的远近可以直观地反映出各指标与各成分之间的关联度。从第一主成分看色谱峰4、6、13、14、16、17正向距离原点较远,第一主成分有较好的正相关性;色谱峰12和19负向距离原点较远,第一主成分有较好的负相关性。从第二主成分方向看,色谱峰3、5、10、15、24和26正向距离原点较远,表明他们与第二主成分有好的正相关性;色谱峰7、9、11和12负向距离原点较远,表明他们与第二主成分有好的负相关性。
2.3 聚类分析
以3种不同干燥方式样品的各峰的相对峰面积作为原始数据,获得一个矩阵,每列代表不同的样本,每行代表各峰的相对含量。为了保证结果的可靠性,利于综合测评分析,对原始指标数据进行Z值标准化处理,将数据标准化后用欧式距离法和Ward连接法运用NCSS进行系统聚类分析[21],结果见图3:将3种不同干燥方式的艾草样品直观分类,并按照不同重复试验聚为一簇(热风干燥和阴干干燥样品聚为一类,晒干样品自成一类)。综上所述,晒干干燥的艾草样品与热风、阴干两种方式干燥的艾草样品组成分差异较大,热风干燥和阴干干燥的艾草组成分较为接近。
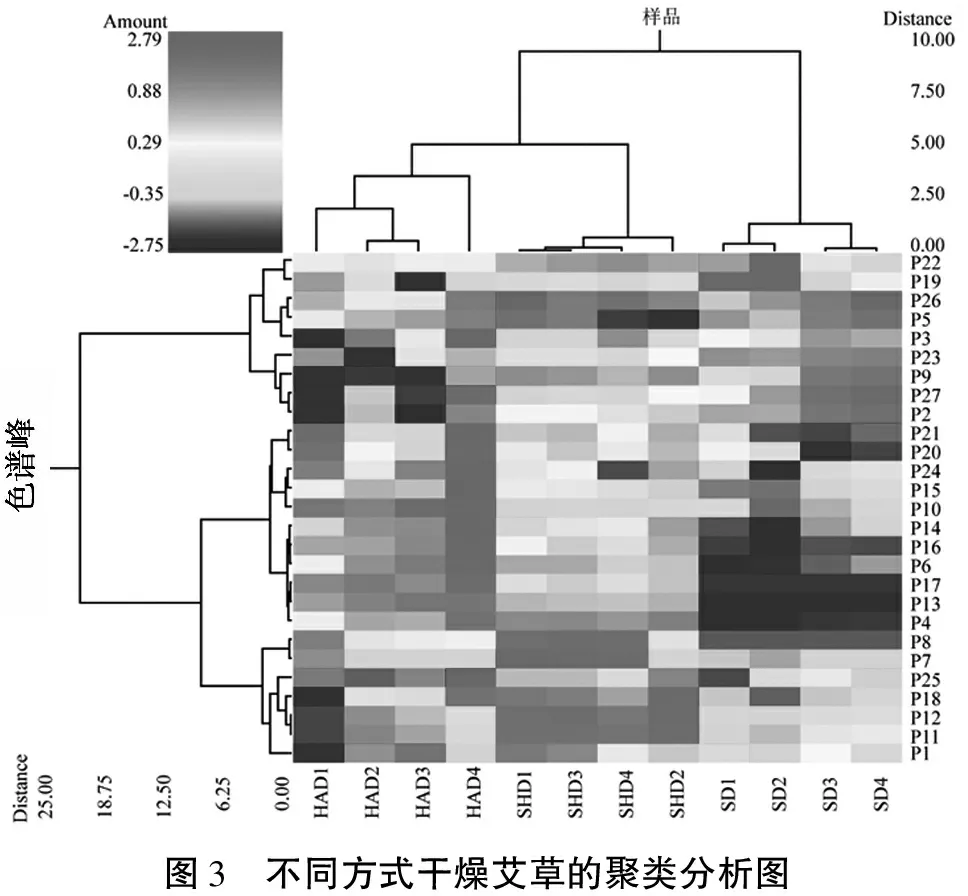
图3 不同方式干燥艾草的聚类分析图
2.4 绿原酸、异绿原酸A、木犀草苷、芦丁、表儿茶素和总黄酮含量的测定
以质量浓度为横坐标(x),峰面积为纵坐标(y),分别绘制标准曲线得到回归方程。结果分别为绿原酸y=10.39x-62.41,R2=0.999 3,线性范围5.10~102.00 μg/mL;异绿原酸Ay=23.71x-154.96,R2=0.999 4,线性范围6.12~61.20 μg/mL;木犀草苷y=47.35x-3.96,R2=0.999 7,线性范围5.20~52.00 μg/mL;芦丁y=29.41x-4.14,R2=0.999 7,线性范围8.30~415.00 μg/mL;表儿茶素y=12.89x-0.86,R2=0.999 8,线性范围7.88~78.80 μg/mL。计算出不同方式干燥艾草的绿原酸、异绿原酸A、木犀草苷、芦丁和表儿茶素的含量如表3所示。由表3可知,热风干燥的艾草中绿原酸、异绿原酸A、木犀草苷和芦丁的含量均高于其他2种方式干燥艾草中的含量。晒干艾草中表儿茶素含量显著高于热风和阴干干燥艾草中的含量,但是晒干艾草中未检测出芦丁。
以芦丁为标准对照,按上述方法,绘制标准曲线,得到回归方程y=8.287 6x+0.003 9(R2=0.993 8),结果表明芦丁在0~0.05 mg/mL与吸光度呈良好的线性关系,并根据标准曲线计算总黄酮的含量,结果见表3。由表3可知,不同干燥方式之间艾草总黄酮含量存在显著性差异(p<0.05)。在总黄酮含量对比中,从大到小依次为热风、阴干和晒干干燥艾草,热风干燥的艾草总黄酮含量最高为21.44 mg/g,晒干艾草中总黄酮含量最低为13.02 mg/g,阴干干燥总黄酮含量为14.95 mg/g。总黄酮含量因晒干而明显降低曾有报道[13-14]。阴干样品的总黄酮含量高于晒干样品,与蒲锐等[15]的试验结果一致。

表3 不同干燥方式艾草中绿原酸、异绿原酸A、木犀草苷、芦丁、表儿茶素和总黄酮含量 mg/g
2.5 不同干燥方法对艾草抗氧化活性的影响
由表4可知,热风、晒干和阴干干燥艾草提取物的DPPH自由基清除率都大于85%,分别达到87.77%、86.02%和87.23%,且差异不显著。总还原能力从大到小依次为晒干组、热风组、阴干组,其吸光度分别为0.86、0.74、0.63。晒干干燥与热风干燥之间的总还原力无显著性差异(p>0.05),与阴干干燥存在显著性差异(p<0.05)。热风干燥的艾草羟基自由基清除率最高,达到77.38%;其次为晒干艾草的羟基自由基清除率为74.41%,与热风干燥艾草之间差异不显著(p>0.05);阴干干燥处理下羟基自由基清除率最低为64.88%。
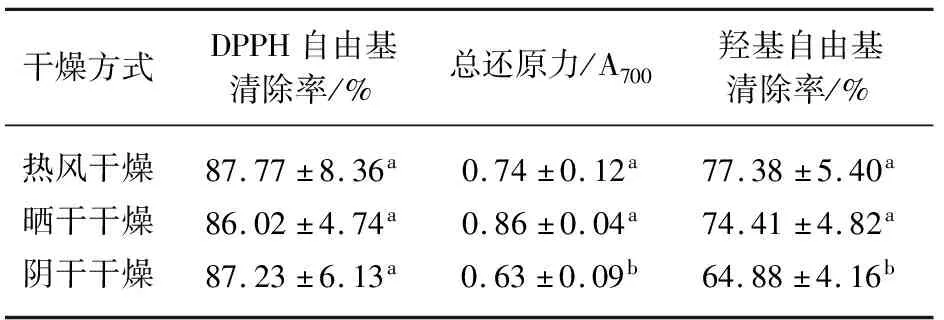
表4 不同干燥方式对艾草抗氧化能力的影响
3 结论与讨论
本文考察了提取方式和提取时间对提取效果的影响,比较了超声波30、45、60 min和微波提取10、20、30 s时的提取效果。对流动相的选择和检测波长也进行考察,检测了320 nm和360 nm的艾草样品出峰状况,同时考察了乙腈-水、乙腈-0.5%磷酸溶液和甲醇-0.5%磷酸溶液3种流动相体系。通过比较色谱峰峰形、峰面积、出峰数及各峰的分离度,最终确定检测波长为320 nm,甲醇-0.5%磷酸溶液为流动相,以75%甲醇超声30 min作为供试品溶液的提取方法。实验中对流动相的比例及梯度洗脱进行了探索,最终得到了本实验的流动相条件。
指纹图谱结合聚类分析法将3种干燥方式艾草主要分为两大类,热风干燥和阴干干燥艾草具有更高的相似性。利用主成分分析将不同干燥方式艾草图谱中的27个特征变量降维至5个主成分,并得出主成分分析得分图和载荷图,与聚类分析结果基本一致。
3种干燥方式相比,热风干燥的艾草总黄酮含量最高,阴干艾草次之、晒干艾草最低。所测定的3种抗氧化性指标中,热风干燥艾草的DPPH自由基和羟基自由基清除能力最强,晒干干燥的艾草总还原力最强,阴干干燥艾草最低。综上所述,热风干燥的艾草可较好地保持有效成分和抗氧化活性,且干燥效率较高、技术成熟,可在新鲜艾草中广泛推广。
