NPY受体在急性束缚应激大鼠mPFC和下丘脑中的表达及其与炎性因子的相关性
2021-02-10李晓晓陈家豪王文娇徐志卿1c
李晓晓,于 倩,陈家豪,王文娇,李 慧,徐志卿,1c
(1.首都医科大学基础医学院a.神经生物学系、北京神经修复与再生重点实验室;b.人体解剖与组织胚胎学系;c.病理学系,北京100069;2.天津市第三中心医院重症医学科,天津 300170)
应激是生物机体在经历强烈刺激时所出现的非特异性的全身性适应反应,可引起神经内分泌及代谢等的异常,且应激和情绪及学习记忆等生理机能密切相关[1]。束缚应激(RES)是一种非损伤性刺激,它与人类心身性疾病的过程十分相似,因此束缚应激模型是被大家公认的应激模型之一[2]。根据束缚时间的长短和次数,束缚应激可分为急性束缚应激和慢性束缚应激[3]。急性束缚应激会导致大脑皮质区域分泌的炎性因子增加,可以使大脑功能减退并导致神经元的损害[4]。前额叶内侧皮层(mPFC)是中枢神经系统内调节焦虑恐惧及应激反应的关键脑区之一,同时也是参与应激受损的重要脑区[5-6]。
神经肽Y(NPY)是由36个氨基酸组成的多肽,在不同的物种中具有高度保守性,是一种广泛分布在中枢和外周神经系统的神经递质。NPY共有6种受体,分别为Y1R、Y2R、Y3R、Y4R、Y5R和Y6R,均属于G蛋白偶联受体(GPCR),NPY信号主要通过结合和激活NPY受体发挥作用[7],NPY受体活化后与抑制性G蛋白Gi耦联而抑制腺苷酸环化酶活性,进而调节钙离子的释放,其中Y1R和Y2R在中枢神经系统中的表达最为广泛[8],是NPY产生抗压力反应的主要调节者。Y4R和Y5R在最近的抑郁症研究中逐渐受到关注,有研究[9]表明这2个受体主要与进食及胃肠蠕动有关,其中Y5R在调节焦虑状态和应激反应时发挥功能,其余3个受体的研究报道较少。小胶质细胞(Microglia)是存在于中枢神经系统中数量最多的巨噬细胞,在中枢神经系统中发挥免疫作用,是中枢免疫系统的第一道防线。小胶质细胞在神经炎症发生过程中发挥重要作用[10],它被激活后能分泌大量促炎细胞因子,如IL-1β、IL-6和TNF-α,这些炎症因子的释放又加剧小胶质细胞的激活,从而形成恶性循环[11]。NPY受体与其配体NPY结合后可以介导小胶质细胞与其他细胞相互作用[12],还可以抑制小胶质细胞激活从而起到抗炎作用[13-14]。
笔者前期研究[15]结果显示在慢性大鼠抑郁模型的mPFC脑区,NPY主要通过Y2R发挥抗抑郁作用。但在急性束缚应激大鼠模型中,NPY受体相关研究报道还很少。因此本研究通过急性束缚制备大鼠应激模型,观察NPY及其受体以及炎性因子在急性束缚应激模型中的表达和分布,为进一步研究NPY及其受体在情绪认知疾病中的作用提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
成年雄性SD大鼠,体重180~200 g,由北京维通利华实验动物技术有限公司提供。
1.1.2 实验试剂及药品
RNeasy Lipid Tissue Mini Kit购自QIAGEN公司,SuperScriptⅢ First-Strand和Power UpTMS YBRTMGreen Master Mix购自Thermo Fisher公司,NPY及Y5R等实时定量PCR引物由生物工程(上海)股份有限公司合成,Y5R及IL-1β抗体购自Abcam公司,内参β-actin等抗体购自Proteintech公司,Iba-1抗体购自Novus公司。
1.2 方法
1.2.1 实验动物分组和造模
SD大鼠购置后饲养于首都医科大学动物部,给予充足饲料及饮用水,饲养密度为3~4 只·笼-1,室温控制在20~25 ℃,空气湿度控制在40%~50%,给予12/12 h昼夜节律,正常饲养3 d,使其适应环境,将适应环境的动物随机分为对照组(CTL组)和急性束缚应激组(RES组)。CTL组大鼠正常饲养,RES组进行急性束缚应激模型制备,方法如下:将大鼠放到束缚盒内,依据大鼠体型大小调节挡板的前后位置,最佳束缚强度为大鼠在束缚盒内不能转头,束缚时间2 h。造模结束后,将动物静置30 min 后处死。本实验中动物模型建立和处理方法符合首都医科大学动物伦理学标准。
1.2.2 实时荧光定量PCR测定NPY及其受体mRNA的表达
大鼠麻醉后快速断头取脑,在RNase-free条件下分离出mPFC和下丘脑,快速液氮冷冻后置于-80 ℃中保存,用于后续RNA及蛋白的提取。依照RNeasy Lipid Tissue Mini Kit试剂盒说明书进行mPFC和下丘脑总RNA的提取,甲醛变性电泳检测RNA的完整性、NanoDrop2000测定RNA的浓度和纯度。取1 μg RNA,按照SuperScriptⅢFirst-Strand试剂盒说明书进行cDNA的合成。设计实时定量PCR引物,引物序列见表1。使用Thermo Fisher公司的SYBR荧光定量试剂盒进行基因水平的测定,反应条件如下:60 ℃ 2 min,95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min共40个循环,反应结束后10 ℃保存。每个样品重复3次,记录各样品与内参GAPDH的CT值,运用2-ΔΔCt法计算目的基因的相对表达量。
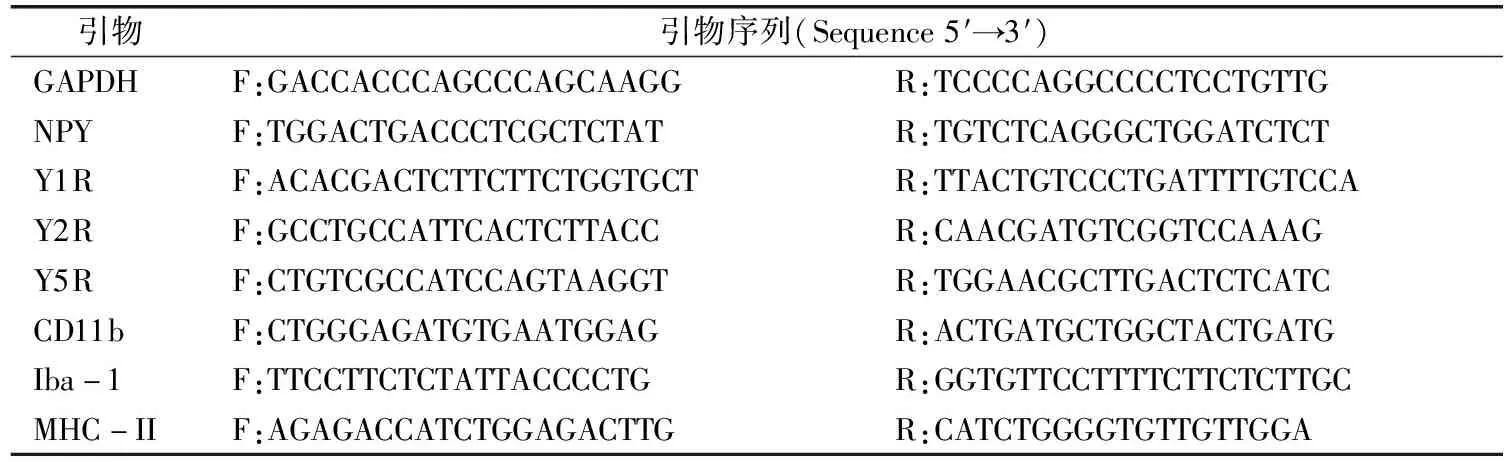
表1 荧光实时定量PCR引物序列
1.2.3 蛋白免疫印记实验分析NPY受体Y5R及IL-1β蛋白表达
取冷冻大鼠mPFC和下丘脑提取蛋白,迅速加入适量变形裂解液,匀浆超声后低温离心取上清,BCA法测定蛋白浓度,样品中加入上样缓冲液,沸水中煮沸离心取上清,5%的积层胶(80 mV,30 min)和10%分离胶(120 mV,70 min)进行SDS-PAGE电泳,电泳后将蛋白转移到PVDF膜上。5%脱脂牛奶室温封闭1 h后,分别加入一抗Y5R(Rabbit 1:10 000)、IL-1β(Rabbit 1:1000)、β-actin(Mouse 1:5000)、α-tubulin(Mouse 1:10 000)和GAPDH(Rabbit 1:1000),室温孵育4 h;洗膜后加入HRP标记的山羊抗小鼠或山羊抗兔二抗(1:5000),室温孵育1 h。洗膜后ECL化学发光,经显影和定影后得到显示条带的X光片。扫描成像后对条带进行分析,采用Image J软件测出条带的灰度,计算出各指标与其对应的β-actin等内参条带的灰度比值。
1.2.4 免疫荧光染色检测NPY受体Y5R及Iba-I的分布
6%水合氯醛(6 mL·kg-1)腹腔注射麻醉大鼠,4%多聚甲醛(PFA)灌注固定,灌注完成后4%PFA后固定4~6 h,转入30%蔗糖溶液中,4 ℃保存至沉底。干冰速冻后修整得到含有拟切片部位的脑组织块,参考大鼠脑立体定位图谱于冰冻切片机上行矢状面切片,厚度30 μm,将所得脑组织切片贴在玻片上进行免疫荧光化学染色。3% H2O2溶液室温打孔10 min,PBS漂洗后加入封闭液,室温封闭1 h;加入Y5R(Rabbit 1:250)及Iba-I(Goat 1:100)一抗过夜,漂洗后分别加入555标记的驴抗兔IgG(1:1000)和488标记的鸡抗山羊IgG(1:1000),室温避光孵育1 h;加入荧光染料Hoechst33258复染细胞核,避光孵育20 min,漂洗后封片,荧光显微镜下观察Y5R及Iba-I在mPFC的染色情况。
1.2.5 统计学方法
2 结果
2.1 NPY及其受体mRNA在mPFC和下丘脑中的表达
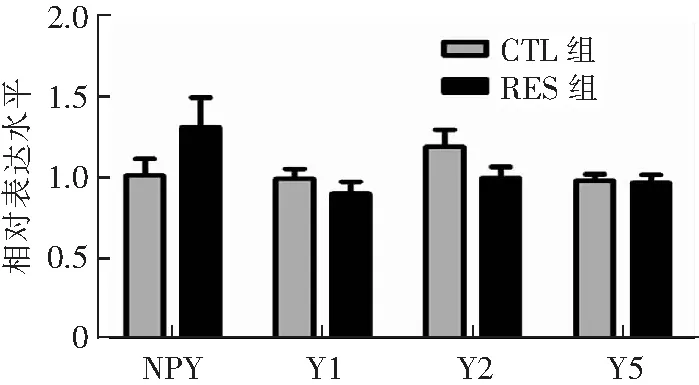
在mPFC中,RES组Y5R mRNA表达水平较CTL组显著降低(P<0.05),而NPY及其他受体mRNA表达水平与CTL组比较差异均无统计学意义(P>0.05),见图1。在下丘脑中,RES组NPY及其受体mRNA表达与CTL组比较差异均无统计学意义(P>0.05),见图2。

CTL组(n=6),RES组(n=8);*P<0.05 CTL组与RES组比较。
CTL组(n=6),RES组(n=8)。
2.2 炎性因子mRNA在mPFC和下丘脑中的表达
在mPFC中,RES组MHC-Ⅱ mRNA表达水平较CTL组显著升高(P<0.05),说明在急性束缚应激条件下,静息状态下的小胶质细胞被激活,见图3。在下丘脑中,RES组各炎性因子mRNA表达与CTL组比较差异均无统计学意义(P>0.05),见图4。
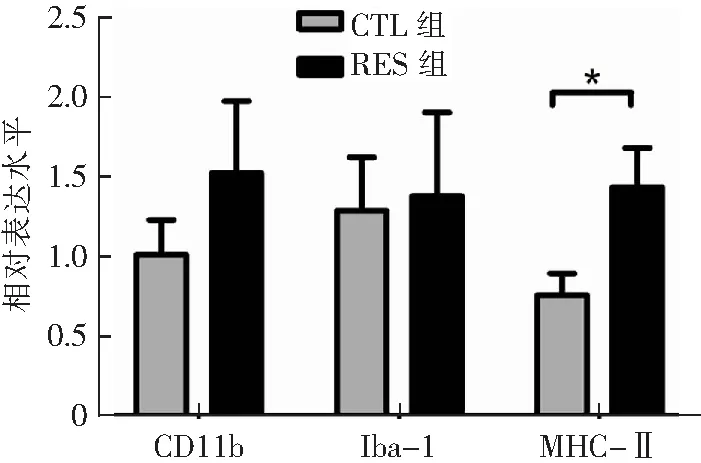
CTL组(n=6),RES组(n=8);*P<0.05 CTL组与RES组比较。

CTL组(n=6),RES组(n=8)。
2.3 NPY受体Y5R及炎性因子蛋白在mPFC与下丘脑中的表达
Western blot检测结果显示,在mPFC中,RES组NPY受体Y5R蛋白表达较CTL组明显降低(P<0.05),炎性因子IL-1β蛋白表达与对照组相比差异无统计学意义(P>0.05);在下丘脑中,RES组NPY受体Y5R蛋白和炎性因子IL-1β蛋白表达与对照组相比差异均无统计学意义(P>0.05)。见图5—6。
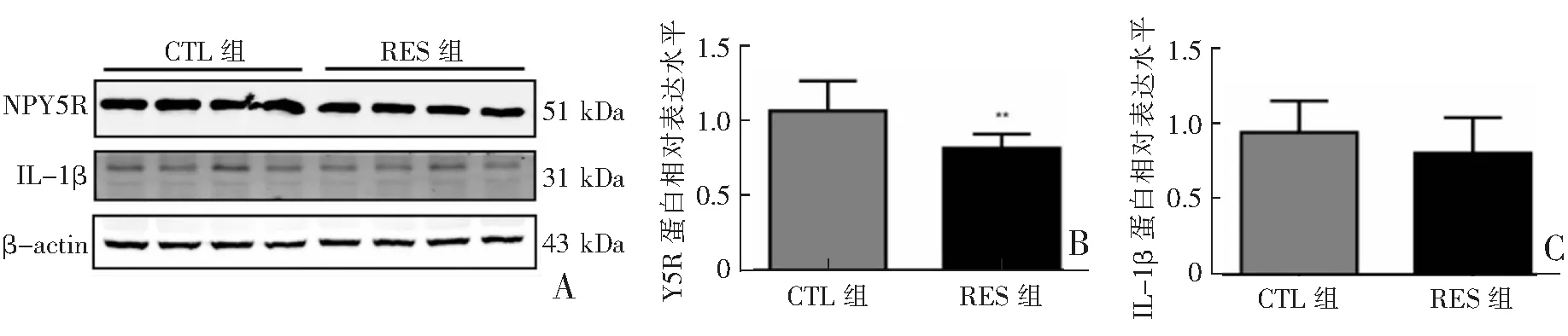
A:Western blot检测结果;B:NPY受体Y5R蛋白表达;C:炎性因子IL-1β蛋白表达;CTL组(n=4),RES组(n=4);**P<0.01 CTL组与RES组比较。
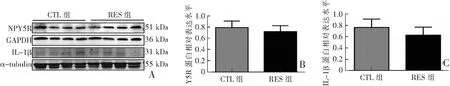
A:Western blot检测结果;B:NPY受体Y5R蛋白表达;C:炎性因子IL-1β蛋白表达;CTL组(n=4),RES组(n=4)。
2.4 NPY受体Y5R及小胶质细胞标志物Iba-1的共定位
免疫荧光染色结果显示,NPY受体Y5R在大鼠mPFC中广泛分布,镜下可见锥形或椭圆状的神经元,细胞核标记为蓝色,Y5R蛋白标记为红色,分布于神经元胞膜;RES组NPY受体Y5R的表达低于对照组。对照组小胶质细胞突起细长呈分枝状,处于未激活状态;RES组小胶质细胞突起粗短分支减少,呈“阿米巴”样的激活状态,RES组小胶质细胞标志物Iba-1表达低于对照组。但对照组和RES组均不存在Y5R和Iba-1共定位的现象,见图7。
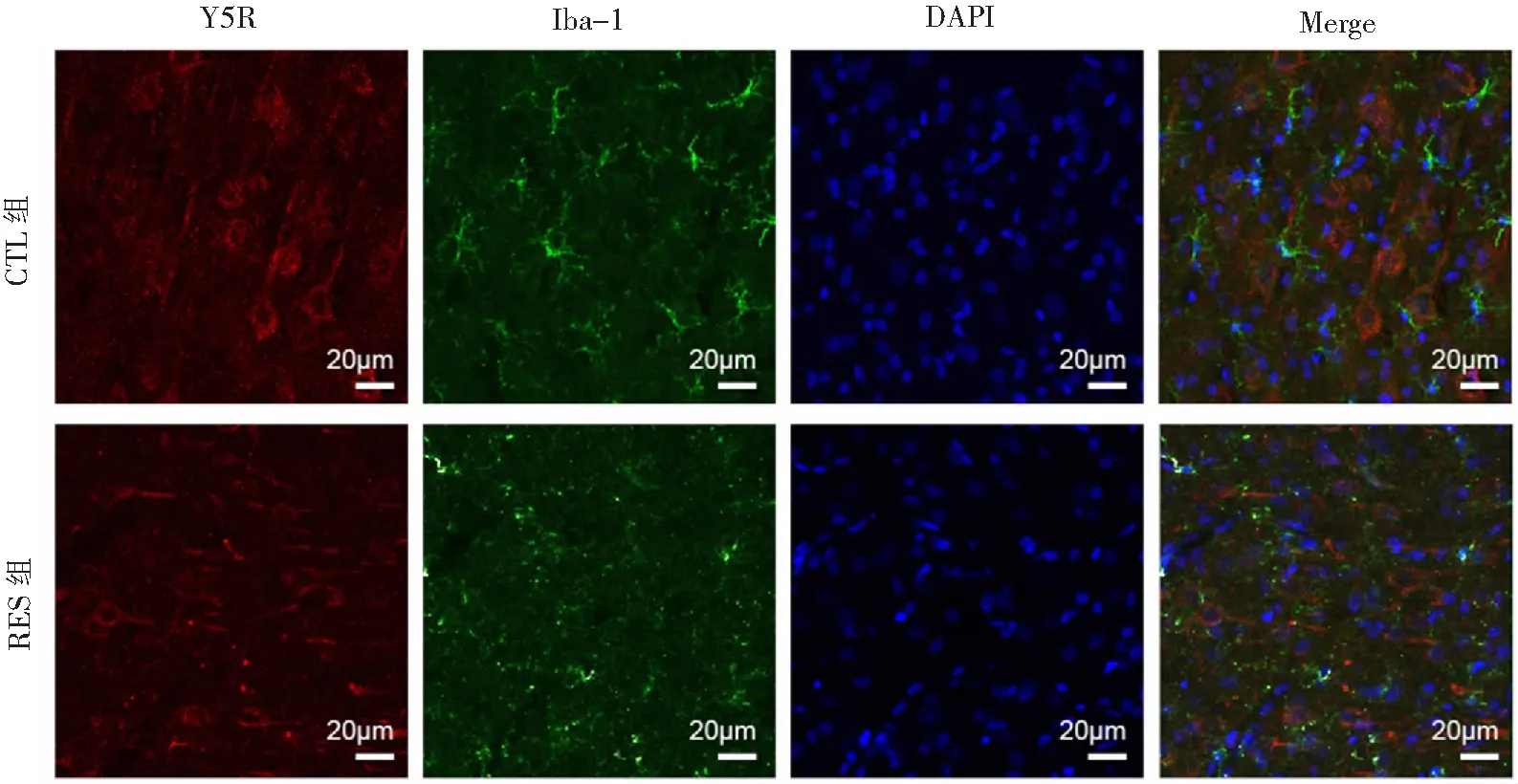
图7 免疫荧光染色结果
3 讨论
急性应激是当代社会的一种常见应激。在急性束缚应激动物模型制备中只给与动物一次束缚应激且束缚时间较短,常为几十分钟到几小时。应激可以导致糖皮质激素增加(人类为皮质醇,大鼠为皮质酮),激素的增加又会引起一系列病理生理过程。机体受到应激刺激后能激活下丘脑-垂体轴,引起ACTH和CORT的增加,继而导致后续炎症、免疫及行为发生改变[16]。NPY是分布在中枢和外周神经系统中的具有神经保护作用的内源性多肽,NPY可能通过其受体发挥免疫调节的作用,它与其相应受体结合后能够影响下游多条信号通路[17-18]。
本研究结果显示,NPY受体Y5R的mRNA水平在RES大鼠mPFC显著性下降,而在下丘脑却无变化,说明NPY受体Y5R呈现区域特异性降低;进一步的WB结果显示NPY受体Y5R蛋白水平也显著降低,而下丘脑NPY受体Y5R蛋白水平无变化,因此mPFC是RES大鼠模型的关键脑区。Y5R的表达在mPFC中显著降低,表明其参与了急性束缚应激的病理过程。笔者前期研究[15]结果显示,在LPS模型的mPFC脑区,NPY受体Y2R可通过抑制M1型小胶质细胞的NLRP3炎性信号通路发挥抗抑郁作用。但在急性束缚应激大鼠模型mPFC脑区炎性因子的变化,及降低的Y5R参与束缚应激的病理机制是否与小胶质细胞的神经炎性相关尚未见报道。
mPFC是与压力、认知、情绪障碍等密切相关的脑区,它可以将情绪信息转化为应激行为,是神经炎性反应的关键脑区[19]。小胶质细胞是中枢神经系统中发挥免疫作用的主要细胞,在外界刺激的作用下,静息态小胶质细胞分化为M1-型小胶质细胞,CD11b、Iba-1和MHC-Ⅱ是M1-型小胶质细胞的表面标志物,小胶质细胞通过分泌IL-1β、IL-6和TNF-α等炎性因子起到致炎性的作用[20]。本研究结果显示,在mPFC中,小胶质细胞的表面标志物MHC-Ⅱ的mRNA水平升高,表明小胶质细胞被激活;下丘脑的小胶质细胞的表面标志物却无变化。mPFC炎性因子蛋白水平的变化与mRNA水平的变化不一致,推测可能是因为真核基因表达在转录和翻译即mRNA和蛋白两个水平层面存在时间和位点的时空间隔;转录后加工、转录产物的降解及翻译后加工修饰等层面使得转录和翻译并不完全一致;再者由于检测时间点的不同,因为急性束缚应激模型造模时间比较短,当炎性因子的mRNA水平达到峰值的时候,蛋白水平还在增加中,所以出现炎性因子mRNA和蛋白水平表达不同步的现象。
小胶质细胞表面表达有多种神经肽及神经递质受体,这为研究中枢神经系统内神经肽及受体家族对神经炎性的调控作用提供依据。在急性束缚应激大鼠模型中,Y5R和小胶质细胞之间是否存在一定关联,本研究通过免疫荧光染色来进一步鉴定,结果证实Y5R和小胶质细胞的表面标志物Iba-1不存在共定位的情况,说明在急性束缚应激大鼠模型中,Y5R不是通过小胶质细胞发挥神经炎性的调控作用。有研究[21]报道,在培养的基底外侧杏仁核神经元脑片,NPY的反复刺激导致兴奋性的输出持续衰减,诱导树突发育不良,这是通过NPY激活Y5R实现。这提示在急性束缚应激大鼠模型中,Y5R的作用机制可能与突触可塑性等有关。
综上所述,本研究结果表明急性束缚应激大鼠mPFC脑区NPY受体Y5R的表达下降,急性应激导致炎性因子mRNA水平出现变化,但蛋白水平的变化没有显著差异。本研究首次证实Y5R和小胶质细胞的表面标志物Iba-1不存在共定位,推测Y5R的作用机制可能与突触可塑性相关,但具体机制还需进一步研究。
