MyoG基因多态性与瑶山鸡体尺、屠宰性能及肉质性状的关联分析
2021-02-09杨德凤李维刘洋张芸龚俞张蓝艺陈颖林家栋张福平唐继高
杨德凤 李维 刘洋 张芸 龚俞 张蓝艺 陈颖 林家栋 张福平 唐继高

摘要:【目的】探究肌細胞生成素基因(MyoG)多态性与瑶山鸡体尺、屠宰性能及肉质性状的关联性,从分子标记角度对瑶山鸡进行选育,更好地保护和开发利用瑶山鸡,同时为家禽MyoG基因研究提供参考依据。【方法】以150日龄出栏的健康瑶山鸡为研究对象,通过PCR扩增产物直接测序对瑶山鸡MyoG基因多态性进行检测,利用DNAStar对测序结果进行比对分析以确定MyoG基因SNP位点,通过RNAfold对瑶山鸡MyoG基因突变前后的mRNA二级结构进行预测,并以SPSS 18.0分析SNP位点与瑶山鸡体尺、屠宰性能及肉质性状的相关性。【结果】在瑶山鸡MyoG基因第3外显子上发现1个SNP位点(T17C位点),属于同义突变,存在3种基因型(CC型、CT型和TT型);T为优势等位基因,CT为优势基因型;有效等位基因数(Ne)接近2.00;多态信息含量(PIC)为0.35,呈中度多态(0.25<PIC<0.50)。在瑶山鸡样本中,除母鸡群体的胸宽、腿肌率、胸肌蒸煮损失率和腿肌蒸煮损失率存在基因型差异外,其他大部分性状指标的差异均不显著(P>0.05)。MyoG基因T17C位点突变致使其mRNA二级结构发生改变,进而导致其最小自由能由-452.60 kcal/mol降至-465.24 kcal/mol。不同基因型瑶山鸡生长、屠宰性能及肉质性状间的相关分析结果显示,3种基因型瑶山鸡在体尺、屠宰性能及肉质性状间的相关性大部分呈现相同规律,其中胸宽与胸深在不同基因型瑶山鸡中均呈极显著正相关(P<0.01)。【结论】瑶山鸡MyoG基因T17C位点存在3种基因型,属于同义突变,并未引起氨基酸及其蛋白结构和功能的明显变化,但其多态性对瑶山鸡体尺性状、屠宰性能和肉质性状有一定影响,因此可作为瑶山鸡分子选育的候选遗传标记。
关键词: 瑶山鸡;肌细胞生成素基因(MyoG);多态性;体尺性状;屠宰性能;肉质性状
中图分类号:S831.89 文献标志码: A 文章编号:2095-1191(2021)10-2887-09
Abstract:【Objective】To explore the relevance of myogenin (MyoG) gene polymorphism to body size, slaughter performance and meat traits of Yaoshan chickens. Breeding of Yaoshan chickens with regard to a molecular marker would better protect, develop and utilize Yaoshan chickens, and at the same time provide a reference for MyoG gene research in other chicken breeds. 【Method】The experiment involved 150-day-old healthy Yaoshan chickens, using PCR product direct sequencing technology on the Yaoshan chicken MyoG gene. Polymorphisms were detected, and DNAStar was used to compare and analyze the sequencing results to determine the SNP site of the MyoG gene. SPSS 18.0 was used to analyze the correlations between SNP locus andgrowth, slaughter performance and meat quality, and RNAfold was used to predict the mRNA secondary structure before and after MyoG gene mutation in Yaoshan chickens. 【Result】One SNP (T17C locus) was found in the third exon of the MyoG gene in Yaoshan chickens. It was a synonymous mutation, and there were three genotypes (CC, CT, TT); T was the dominant allele, and CT was the dominant genotype. The effective allele number (Ne) was close to 2.00, and the polymorphic information content (PIC) was 0.35, showing moderate polymorphism (0.25<PIC<0.50).In the Yaoshan chicken samples, except for the genotypic differences in breast width, leg muscle rate, chest muscle cooking loss rateand leg muscle cooking loss rate of the hen population, the differences in most other traits were not significant (P>0.05). The mutation at the T17C site of the MyoG gene changes its mRNA secondary structure, which in turn causes its minimum free energy to change from -452.60 kcal/mol to -465.24 kcal/mol. The results of correlation analysis among growth, slaughter and meat quality traits of different genotypes of Yaoshan chickens showed that most of the correlation analysis results among growth, slaughter and meat quality traits of the three genotypes showed the same trend. Among them,chest width and chest depth showed a very significant positive correlation in different genotypes of Yaoshan chickens (P<0.01). 【Conclusion】There are three genotypes at the T17C locus of the MyoG gene in Yaoshan chickens, which are synonymous mutations and do not cause significant changes in the structure and function of amino acids and their proteins. However, the polymorphism has animpact on body size, slaughter traits and meat quality of Yaoshan chickens, so it can be used as a candidate genetic marker for molecular breeding of Yaoshan chickens.
Key words:Yaoshan chicken; myogenin gene (MyoG); polymorphism; body measurements; slaughter performance; meat traits
Foundation item:Guizhou Science and Technology Plan Project (QKHZC〔2017〕2533-1)
0 引言
【研究意义】瑶山鸡又称瑶鸡,原产于贵州省荔波县,是由瑶山乡的本土品种改良培育而来,其成年公鸡体重可达2.45 kg,母鸡体重可达2.05 kg。瑶山鸡具有外表亮丽、生长速度快、耐粗饲放养、骨骼粗壮及背腰宽平等特点(林家栋等,2018),且中等体型,肉质鲜美细嫩,深受广大消费者的青睐。肌细胞生成素(Myogenin,MyoG)基因是生肌调节因子(Myogenic regulatory factors,MRFs)家族中的重要成员,是继生长激素和胰岛素生长因子之后新发现的功能性基因(栾兆进等,2015)。畜禽产肉能力与肌纤维的数量和生长速度密切相关,肌纤维是构成骨骼肌的基本单位,而MyoG基因在肌纤维生成过程中的作用尤为突出,属于肌肉生成的正调控因子(白俊艳等,2020)。因此,分析MyoG基因外显子多态性对深入探究畜禽的体尺、屠宰性能及肉质性状均具有重要意义。【前人研究进展】Wright等(1989)最先报道生肌决定因子MyoD家族(MyoD、MyoG、Myf-5和Myf-6)中的MyoG,在结构和功能上与MyoD家族的其他3个因子相关,进化上属于保守的碱性螺旋—环—螺旋肌肉特异性转录因子(Dasarathy et al.,2004;Berkes and Tapscott,2005;叶恒振,2018)。在肌肉形成的整个过程中,MyoG促使中胚层细胞分化为成肌细胞,进而融合为肌纤维,从肌纤维形成及前体肌细胞的增殖和定型,到个体自身出生后的功能完善及成熟,均有MyoG基因参与(Pas and Visscher,1994;Hughes and Schiaffino,1999;周国利等,2005),可激活与肌肉生成相关基因的转录,并提高肌肉细胞分化(Sabourin et al.,1999;田佳,2014)。刘红丽等(2015)研究发现,MyoG基因5'端非编码区(5'-UTR)序列多态性与泸宁鸡的肝脏重、屠宰率及胸肌率等屠宰性能指标均存在一定关联性;郭赛(2019)研究表明,MyoG基因多态性与藏鸡的腿肌和胸肌呈显著关联,即MyoG基因可作为藏鸡肌肉生长发育的候选基因。一般认为屠宰率在80%以上及全净膛率在60%以上时,其肉用性能良好(贾汝敏等,2005)。赵振华等(2012)、李乃宾等(2014)、苏红卫等(2014)研究表明,多项体尺指标与屠宰性能存在显著或极显著相关性。蒋会梅等(2015)研究威宁鸡体尺与屠宰性能间的相关性时发现,威宁鸡的体尺性状存在性别差异。韩顺顺等(2016)通过分析彭县黄鸡体尺性状与屠宰性能的相关性,发现彭县黄鸡体尺性状与绝大多数屠宰性能呈显著相关。【本研究切入点】MyoG基因是控制肌肉生长发育的一个关键基因(Jia et al.,1992;李莉鑫等,2019),但至今有关瑶山鸡MyoG基因多态性与其肌肉形成的相关性鲜见研究报道。【拟解决的关键问题】以MyoG基因为候选基因,寻找其编码区(CDS)序列SNP位点,分析MyoG基因多态性与瑶山鸡体尺、屠宰性能及肉质性状的关联性,从分子标记角度对瑶山鸡进行选育,以期更好地保护和开发利用瑶山鸡,同时为家禽MyoG基因研究提供参考依据。
1 材料与方法
1. 1 试验材料
随机抽取60羽150日龄出栏的健康瑶山鸡,公母各半,由贵阳绿源禽业有限公司提供,为相同条件下全价饲养的同批次瑶山鸡。Mixture溶液、Ezup柱式血液动物基因组DNA抽提试剂盒、DL2000 DNA Marker、GoldView染料及琼脂糖等试剂购自生工生物工程(上海)股份有限公司;ddH2O和TBE缓冲液由高原山地动物遗传育种与繁殖教育部重点实验室自制。主要仪器设备:Thermo NANODROP 2000紫外分光光度计(赛默飞世尔科技有限公司),DYCZ-24F电泳仪(北京六一仪器厂),BioSens SC 710凝胶成像系统(上海山富科技仪器有限公司),Bio-Rad C1000 TouchTM Thermal Cycler PCR仪(美国Bio-Rad公司),C-LM型肌肉嫩度计和pH测定仪[汉钠仪器(上海)有限公司]。
1. 2 指标测定
于瑶山雞翅下静脉采血,肝素钠抗凝,编号后 -20 ℃保存;屠宰性能按《家禽生产性能名词术语和度量统计方法》进行测定。
式中,M1为蒸前重,M2为蒸后重,W1为压前重,W2为压后重。
1. 3 DNA提取
采用Ezup柱式血液动物基因组DNA抽提试剂盒提取DNA,以紫外分光光度计测定其浓度和纯度,其浓度在25~170 ng/μL,OD260/OD280在1.70~1.86。1.0%琼脂糖凝胶电泳检测结果如图1所示。
1. 4 引物设计与合成
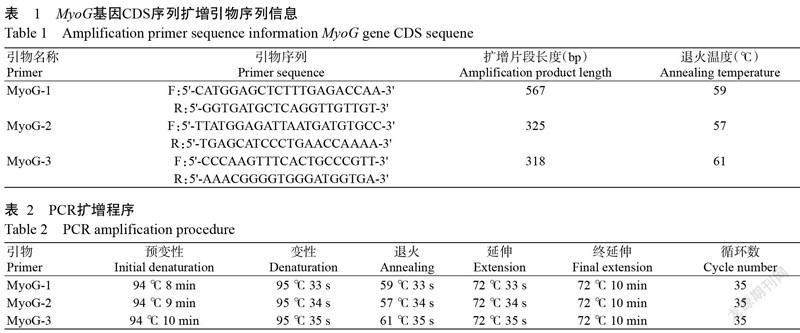
参照NCBI已公布的家鸡MyoG基因CDS序列(GenBank登录号NC_006113.4),利用Primer Premier 5.0分别对MyoG基因的3个外显子(MyoG-1、MyoG-2和MyoG-3)设计引物,并委托赛默飞世尔科技有限公司合成,引物序列信息见表1。
1. 5 MyoG基因外显子PCR扩增
PCR反应体系20.0 μL:2×Taq PCR Master Mix 12.0 μL,DNA模板2.0 μL,上、下游引物各1.5 μL,ddH2O 3.0 μL。扩增程序见表2,PCR扩增产物以1.0%琼脂糖凝胶电泳进行检测。
1. 6 PCR产物测序分析
将PCR扩增产物送至赛默飞世尔科技有限公司进行测序。以NCBI已公布的鸡全基因组为参照,采用DNAStar对测序结果进行比对分析,并根据测序分析结果确定MyoG基因SNP位点。
1. 7 mRNA二级结构预测
通过RNAfold(http://rna.tbi.univie.ac.at/cgi-bin/RNAfold.cgi/)在线预测瑶山鸡MyoG基因mRNA二级结构。
1. 8 统计分析
采用SPSS 18.0对各测定指标进行单因素方差分析(One-way ANOVA)及相关分析。
2 结果与分析
2. 1 瑶山鸡MyoG基因外显子PCR扩增结果
选用设计的3对引物对瑶山鸡基因组DNA进行PCR扩增,以1.0%琼脂糖凝胶电泳检测PCR扩增产物,结果(图2)表明,PCR扩增片段大小与预期结果一致,说明设计的3对引物特异性良好。
2. 2 PCR扩增产物测序分析结果
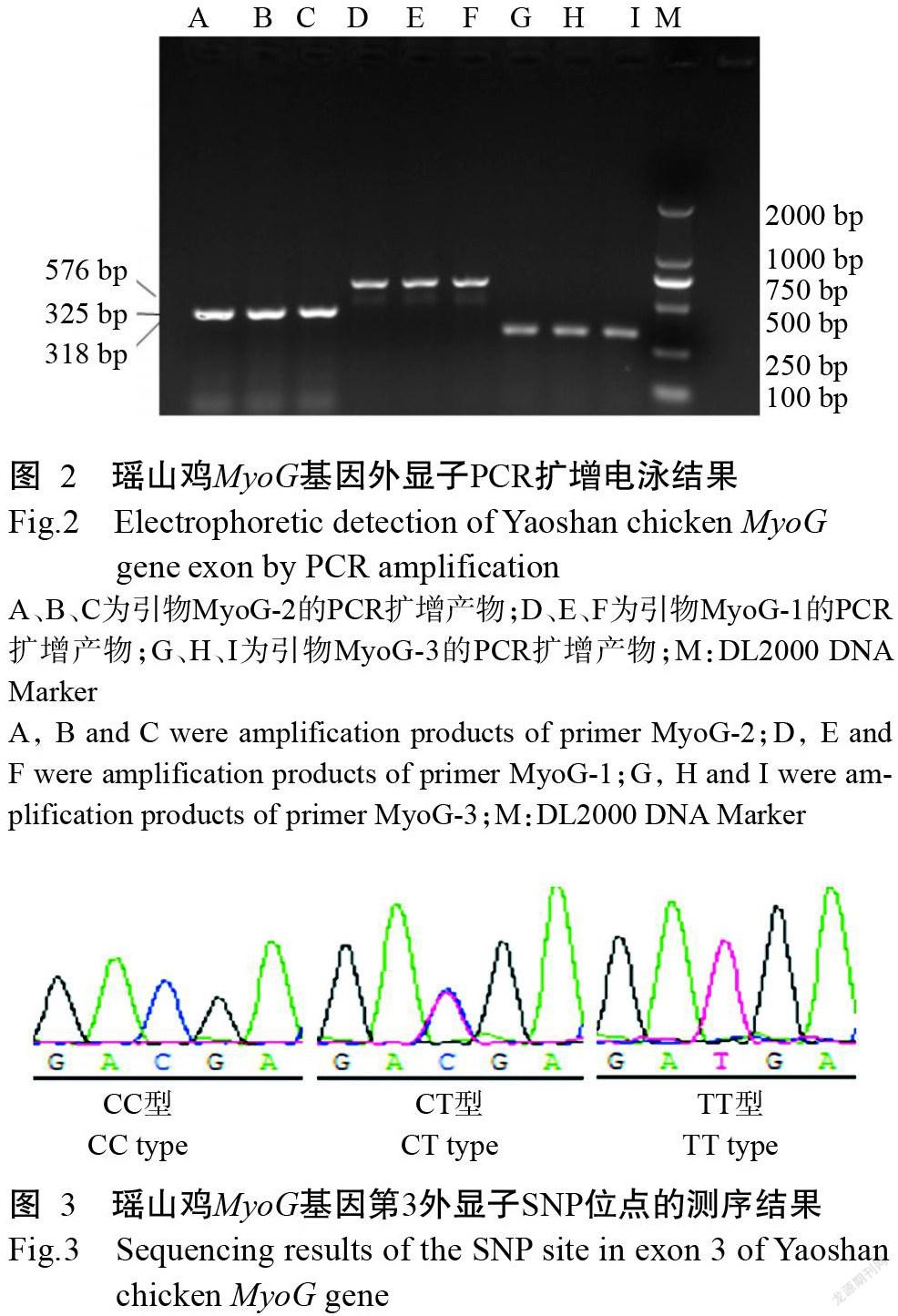
由于以MyoG-1和MyoG-2为引物的PCR扩增片段中未发现突变位点,因此未进行测序分析。以MyoG-3为引物的PCR扩增产物送至赛默飞世尔科技有限公司测序,并将测序结果与家鸡MyoG基因CDS序列(NC_006113.4)进行比对,结果在瑶山鸡MyoG基因第3外显子T17C处发现3种基因型(图3),即CC型、CT型和TT型,且此SNP位点为同义突变,并未引起编码的氨基酸改变。
2. 3 瑶山鸡MyoG基因遗传学分析结果
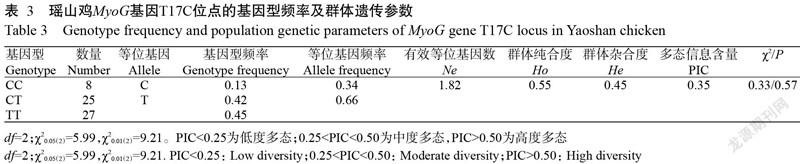
统计各基因型的个体数,计算瑶山鸡MyoG基因T17C位点的基因型频率和基因频率,结果(表3)表明,T为优势等位基因,CT为优势基因型;有效等位基因数(Ne)接近2.00;多态信息含量(PIC)为0.35,呈中度多态(0.25<PIC<0.50)。卡方(χ2)适合性检验发现,瑶山鸡MyoG基因T17C位点处于Hardy-Weinberg平衡状态。
2. 4 MyoG基因多态性与瑶山鸡体尺、屠宰性能及肉质性状的关联分析结果
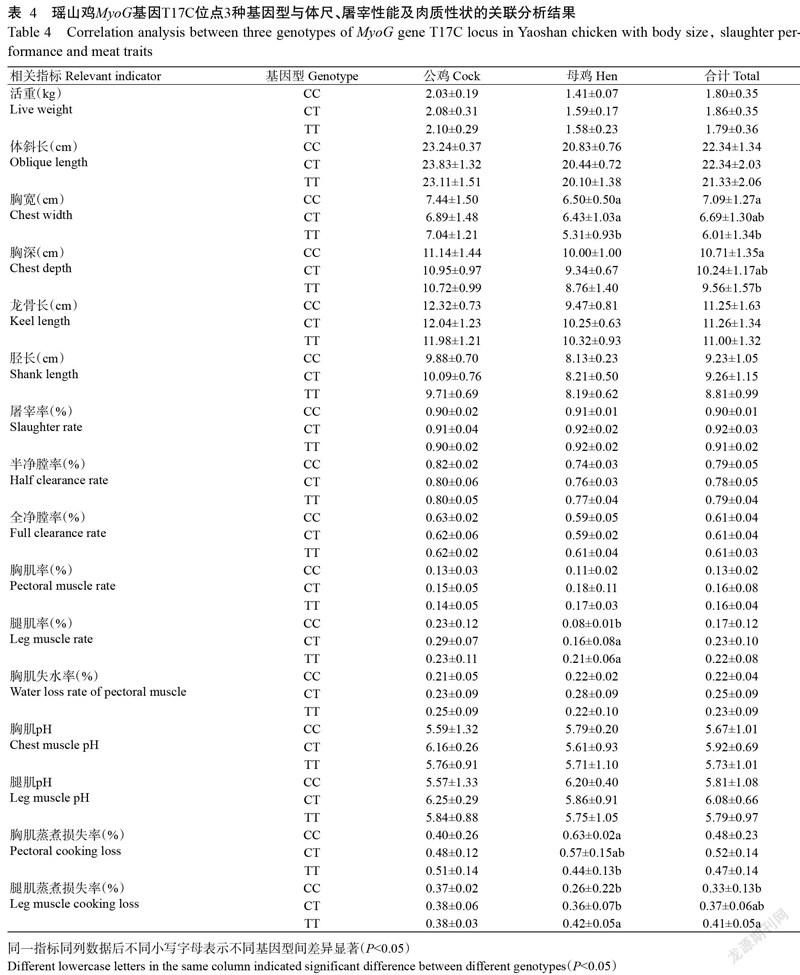
2. 4. 1 体尺性状关联分析 对瑶山鸡群体的体尺性状指标(体斜长、胸宽、胸深、龙骨长和胫长)与MyoG-3基因T17C位点进行关联分析,结果(表4)表明:在公鸡群体中,所有体尺性状指标的差异均不显著(P>0.05,下同);在母鸡群体中,胸宽在CC型和CT型的差异不显著,但显著高于TT型(P<0.05,下同),其余體尺性状指标的差异均不显著。在瑶山鸡群体中,胸宽和胸深在3种基因型中的表现一致,表现为CC型>CT型>TT型,且CC型显著高于TT型;其余体尺性状指标的差异均不显著。
2. 4. 2 屠宰性能关联分析 对瑶山鸡群体的屠宰性能指标(屠宰率、半净膛率、全净膛率、胸肌率和腿肌率)与MyoG-3基因T17C位点进行关联分析,结果(表4)表明,仅母鸡群体的腿肌率表现为CC型显著低于CT型和TT型,且CT型与TT型间差异不显著。
2. 4. 3 肉质性状关联分析 对瑶山鸡群体的肉质性状指标(胸肌失水率、胸肌pH、腿肌pH、胸肌蒸煮损失率和腿肌蒸煮损失率)与MyoG-3基因T17C位点进行关联分析,结果(表4)表明:在公鸡群体中,所有肉质性状指标的差异均不显著;在母鸡群体中,胸肌蒸煮损失率表现为CC型显著高于TT型,而腿肌蒸煮损失率恰好相反,表现为CC型显著低于TT型,其余肉质性状指标在3种基因型间的差异均不显著。在瑶山鸡群体中,腿肌蒸煮损失率表现为TT型>CT型>CC型,且TT型显著高于CC型。
2. 5 瑶山鸡MyoG基因mRNA二级结构预测结果
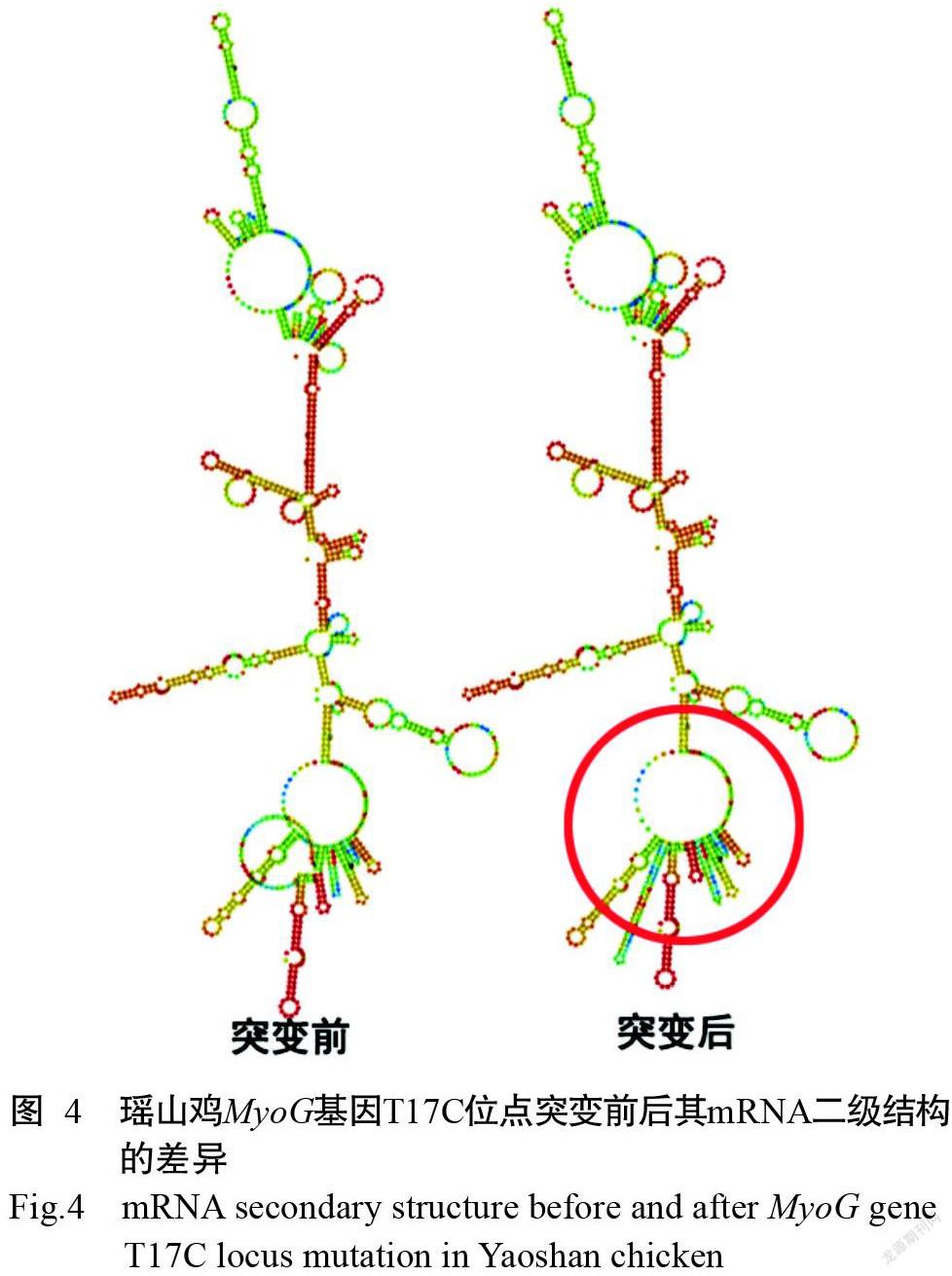
通过RNAfold对瑶山鸡MyoG基因突变前后的mRNA二级结构进行预测,结果(图4)表明,MyoG基因T17C位点突变致使其mRNA二级结构发生改变,进而导致mRNA二级结构最小自由能降低,由 -452.60 kcal/mol降至-465.24 kcal/mol,影响mRNA二级结构稳定性,即突变后稳定性增加。
2. 6 不同基因型瑶山鸡体尺、屠宰性能及肉质性状间的相关分析结果
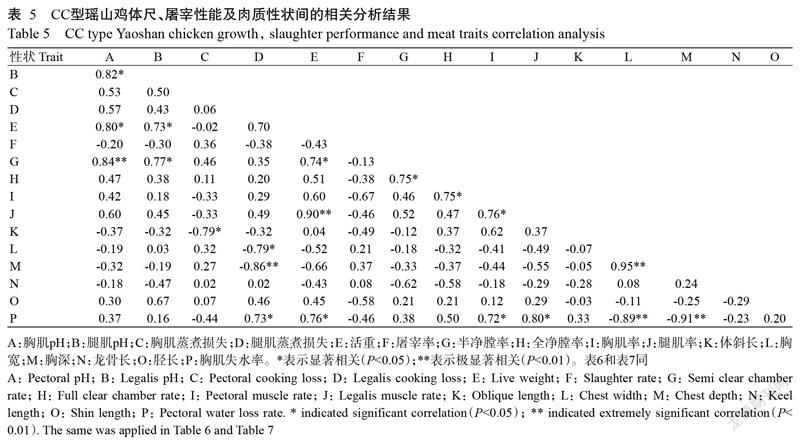
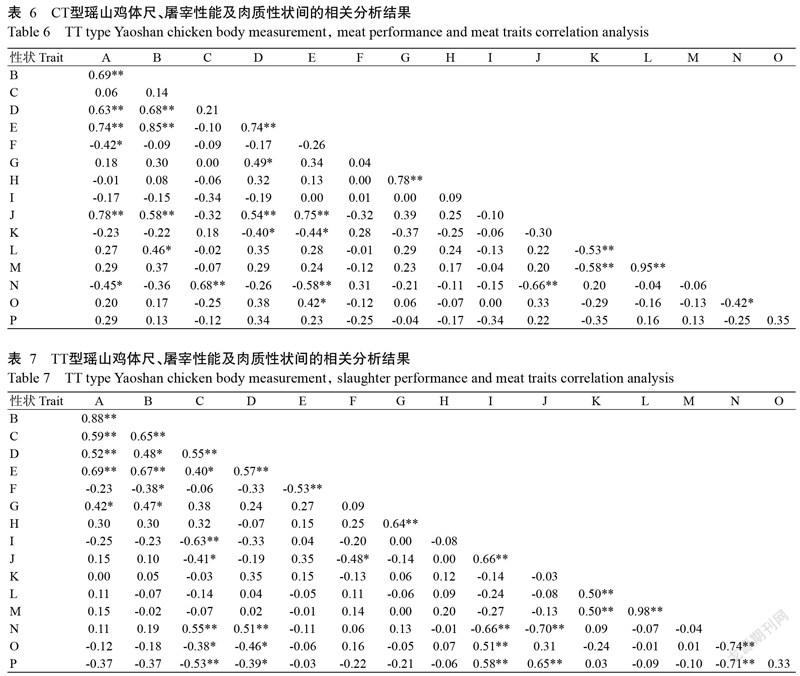
对瑶山鸡MyoG基因T17C位点3种基因型分别进行体尺、屠宰性能及肉质性状间的相关分析,结果显示,在CC型瑶山鸡(表5)中:胸肌pH与半净膛率、活重与腿肌率、胸宽与胸深均呈极显著正相关(P<0.01,下同),对应的相关系数依次为0.84、0.90和0.95;腿肌蒸煮损失率与胸深、胸宽与胸肌失水率、胸深与胸肌失水率则呈极显著负相关,对应的相关系数依次为-0.86、-0.89和-0.91;胸肌蒸煮损失率与体斜长、腿肌蒸煮损失率与胸宽均呈显著负相关,相关系数均为-0.79。在CT型瑶山鸡(表6)中:胸肌pH与腿肌pH、腿肌蒸煮损失率、活重和腿肌率,腿肌pH与腿肌蒸煮损失率、活重和腿肌率,胸肌蒸煮损失率与龙骨长,腿肌蒸煮损失率与活重和腿肌率,活重与腿肌率,半净膛率与全净膛率,胸宽与胸深均呈极显著正相关;而活重与龙骨长、腿肌率与龙骨长、体斜长与胸宽和胸深均呈极显著负相关,其相关系数依次为-0.58、-0.66、-0.53和-0.58;胸肌pH与屠宰率和龙骨长、腿肌蒸煮损失率与体斜长、活重与体斜长、龙骨长与胫长均呈显著负相关,对应的相关系数依次为-0.42、-0.45、-0.40、-0.44和-0.42。在TT型瑶山鸡(表7)中:胸肌pH与腿肌pH、胸肌蒸煮损失率、腿肌蒸煮损失率和活重,腿肌pH与胸肌蒸煮损失率和活重,胸肌蒸煮损失率与腿肌蒸煮损失率和龙骨长,腿肌蒸煮损失率与活重和龙骨长,半净膛率与全净膛率,胸肌率与腿肌率、胫长和胸肌失水率,腿肌率与胸肌失水率,体斜长与胸宽和胸深,胸宽与胸深均呈极显著正相关;而胸肌蒸煮损失率与胸肌率和胸肌失水率,活重与屠宰率,胸肌率与龙骨长,腿肌率与龙骨长,龙骨长与胫长和胸肌失水率均呈极显著负相关。综上所述,瑶山鸡MyoG基因T17C位点3种基因型在体尺、屠宰性能及肉质性状间的相关分析结果大部分呈现相同规律。
3 讨论
MyoG基因是动物机体骨骼肌分化的必需因子,不仅对基因自身及其家族基因的表达进行自分泌和旁分泌调节,还能控制肌纤维形成和成肌细胞融合,对肌肉的分化起关键性作用(白俊艳等,2020)。MyoG基因作为MyoD家族中的下游基因,通过自分泌和旁分泌调节基因自身、家族其他成员及肌肉特异性基因的表达,从而影响肌细胞的分化和代谢,即MyoG基因对畜禽产肉性能起至关重要的作用(Jia et al.,1992;李莉鑫等,2019)。Anton等(2006)采用PCR-PFLP对MyoG基因3'端非编码区(3'-UTR)多态性与白猪生产指标及屠体指标的相关性进行分析,结果表明,不同MyoG基因型间的增长率差异显著,以BB基因型个体在育肥期的成长率最高。王琼等(2007)采用PCR-SSCP对MyoG基因5'-UTR多态性与优质肉鸡屠宰和肉质性状的相关性进行研究,结果表明MyoG基因5'-UTR的2个多态位点与屠宰性状显著相关。魏岳等(2014)采用PCR-SSCP对边鸡MyoG基因进行SNP位点检测,并利用实时荧光定量PCR分析MyoG基因多态性与边鸡生长和屠体性状间的关系,结果在MyoG基因上发现2个同义突变,并证实MyoG基因的多态位点对边鸡生长和屠体性状有显著或极显著影响,且MyoG基因在胸肌中的表达量极显著高于在腿肌中的表达量。唐莹等(2015)研究发现在京海黄鸡群体MyoG基因第1外显子上存在突变位点,且该突变位点对京海黄鸡早期生长有显著影响。王彦钦(2016)研究表明,在MyoG基因第3外显子上发现的错义突变位点对12、18、24周龄拜城油鸡及42日龄AA肉鸡各项屠宰指标的影响均不显著。本研究通过分析MyoG基因外显子多态性与瑶山鸡体尺、屠宰性能及肉质性状的关联性,结果在瑶山鸡MyoG基因第3外显子T17C位点处发现同义突变,除母鸡群体的胸宽、腿肌率、胸肌蒸煮损失率和腿肌蒸煮损失率存在基因型差异外,其他大部分性状指标的差异均不显著,与赵忠海等(2013)对贵妃鸡MyoG基因的研究结果基本一致。但由于本研究的样本数量有限,瑶山鸡MyoG基因T17C位点突变的个体相对较少,因此后续研究需扩大样本数进一步探究MyoG基因T17C位点能否作为瑶山鸡分子标记辅助育种的关键位点。
水的相对含量和分布状态直接影响畜禽肉制品的色泽、嫩度及多汁性,对肉制品的加工和贮藏也有明显影响(Labuza and Hyman,1998;朱丹实等,2013;李洁等,2020)。本研究结果表明,在瑶山母鸡群体中,胸肌失水率在不同基因型间无显著差异,胸肌蒸煮损失率表现为CC型显著高于TT型,而腿肌蒸煮損失率表现为CC型显著低于TT型。在瑶山鸡群体中,腿肌蒸煮损失率也表现为CC型显著低于TT型。不同基因型瑶山鸡体尺、屠宰性能及肉质性状间的相关分析结果显示,3种基因型瑶山鸡在体尺、屠宰性能及肉质性状间的相关性大部分呈现相同规律,其中胸宽与胸深在不同基因型瑶山鸡中均呈极显著正相关。此外,本研究通过RNAfold预测瑶山鸡MyoG基因mRNA二级结构,结果发现MyoG基因T17C位点突变致使mRNA二级结构发生改变,进而导致其最小自由能降低,突变后mRNA二级结构稳定性增强,由此推测该位点突变可能是影响瑶山鸡生长及屠宰性能的原因之一。
4 结论
瑶山鸡MyoG基因T17C位点存在3种基因型,属于同义突变,并未引起氨基酸及其蛋白结构和功能的明显变化,但其多态性对瑶山鸡体尺性状、屠宰性能和肉质性状有一定影响,因此可作为瑶山鸡分子选育的候选遗传标记。
参考文献:
白俊艳,时坤鹏,卢小宁,杨帅,陈梦柯,马永康,巩慧荣,董智豪,庞有志,雷莹,曹慧,安肖凯,常世增,侯伟晓,付学言,樊红灯,曹恒. 2020. 鹌鹑MyoG基因多态性与早期生长性能的关联分析[J]. 河南农业科学,49(4):147-152. [Bai J Y,Shi K P,Lu X N,Yang S,Chen M K,Ma Y K,Gong H R,Dong Z H,Pang Y Z,Lei Y,Cao H,An X K,Chang S Z,Hou W X,Fu X Y,Fan H D,Cao H. 2020. Association analysis between MyoG gene polymorphism and early growth performance of quail[J]. Journal of Henan Agricultural Sciences,49(4):147-152.] doi:10.15933/j.cnki.1004-3268.2020.04.021.
郭赛. 2019. 藏鸡MyoG基因的表达及其与经济性状的相关分析[J]. 生物化工,5(4):111-113. [Guo S. 2019. Correlation analysis between expression and economic traits of MyoG gene in Tibetan[J]. Biological Chemical Enginee-ring,5(4):111-113.] doi:10.3969/j.issn.2096-0387.2019. 04.031.
韩顺顺,陆登宇,邹云峰,刘子豪,卫远航,贺民,罗荣华,王彦,赵小玲,朱庆,尹华东. 2016. 彭县黄鸡体尺性状与屠宰性能的典型相关分析[J]. 中国家禽,38(10):7-10. [Han S S,Lu D Y,Zou Y F,Liu Z H,Wei Y H,He M,Luo R H,Wang Y,Zhao X L,Zhu Q,Yin H D. 2016. Canonical correlation analysis on body measurements and slaughter performances of Pengxian yellow chicken[J]. China Poultry,38(10):7-10.] doi:10.16372/j.issn.1004-6364.2016.10.002.
贾汝敏,姚晶宁,杜炳旺. 2005. 两个海大香肉鸡品系屠宰性能与肉质性状的比较[J]. 中国家禽,27(6):10-12. [Jia R M,Yao J N,Du B W. 2005. Comparison of two Haidaxiang meat chicken lines on slaughter performance and meat quality[J]. China Poultry,27(6):10-12.] doi:10.16372/j.issn.1004-6364.2005.06.003.
蒋会梅,张义玲,刘章忠,杨远青,舒畅,李万贵,张依裕,刘若余. 2015. 威宁鸡体尺与屠宰性状间的相关性研究[J]. 中国畜牧兽医,42(12):3300-3307. [Jiang H M,Zhang Y L,Liu Z Z,Yang Y Q,Shu C,Li W G,Zhang Y Y,Liu R Y. 2015. The correlation analysis between body size and slaughter traits of Weining chicken[J]. Chinese Animal Husbandry & Veterinary Medicine,42(12):3300-3307.] doi:10.16431/j.cnki.1671-7236.2015.12.028.
李洁,赵生国,王建福,李金录,史兆国,董瑞生,马晓文,邱国斌,刘珽. 2020. ‘太平鸡’‘海兰褐鸡’及其杂交一代屠宰性能及肉品质比较分析[J]. 甘肃农业大学学报,55(1):196-203. [Li J,Zhao S G,Wang J F,Li J L,Shi Z G,Dong R S,Ma X W,Qiu G B,Liu T. 2020. Comparative analysis of carcass characteristics and meat quality of Taiping chicken,Hy-line Brownchicken and their hybrid[J]. Journal of Gansu Agricultural University,55(1):196-203.] doi:10.13432/j.cnki.jgsau.2020.01.025.
李莉鑫,任华伟,李艺雷,冀云燕,薛霖莉,曹靖,罗小毛,于秀菊,赫晓燕,王海东. 2019. 不同发育时期小鼠心肌MyoG基因的表达分析[J]. 山西农业科学,47(4):677-680. [Li L X,Ren H W,Li Y L,Ji Y Y,Xue L L,Cao J,Luo X M,Yu X J,He X Y,Wang H D. 2019. MyoG expression analysis in the cardiac muscle at different developmental stages in mice[J]. Journal of Shanxi Agricultural Sciences,47(4):677-680.] doi:10.3969/j.issn.1002-2481. 2019.04.43.
李乃宾,杨芬霞,杜炳旺,陶林,陈洁波. 2014. 珍禽贵妃鸡体尺性状与屠宰性能的相关分析[J]. 南方农业学报,45(7):1281-1285. [Li N B,Yang F X,Du B W,Tao L,Chen J B. 2014. Correlation between body size and slaughter performance of Princess chicken[J]. Journal of Southern Agriculture,45(7):1281-1285.] doi:10.3969/j:issn.2095-1191.2014.7.1281.
林家棟,张福平,龚俞,李雪松,张游宇,任丽群,李洪林,祖盘玉,吴立鑫,李维. 2018. 瑶山鸡慢羽系羽型与出壳体重相关性研究[J]. 黑龙江畜牧兽医,(15):114-116. [Lin J D,Zhang F P,Gong Y,Li X S,Zhang Y Y,Ren L Q,Li H L,Zu P Y,Wu L X,Li W. 2018. Study on the correlation between feather type and shell weight of Yaoshan chicken slow feather line[J]. Heilong-jiang Animal Science and Veterinary Medicine,(15):114-116.] doi:10.13881/j.cnki.hljxmsy.2017.11.0329.
刘红丽,徐亚欧,熊斌,胡卫民,梅寒,石浩,左斌,聂晓庆,王海. 2015. 肌细胞生成素基因多态性与泸宁鸡生长性状的关联研究[J]. 中国畜牧兽医,42(3):629-637. [Liu H L,Xu Y O,Xiong B,Hu W M,Mei H,Shi H,Zuo B,Nie X Q,Wang H. 2015. Study on the correlation between polymorphisms of MyoG gene and growth traits of Lu-ning chicken[J]. China Animal Husbandry and Veterinary Medicine,42(3):629-637.] doi:10.16431/j.cnki.1671-7236.2015.03.019.
栾兆进,曲绪仙,贺建宁,柳楠. 2015. 家畜MyoG基因结构和功能研究进展[J]. 家畜生态学报,36(7):1-4. [Luan Z J,Qu X X,He J N,Liu N. 2015. Advances on structure and function of MyoG in livestock animals[J]. Acta Ecologae Animalis Domastici,36(7):1-4.] doi:10.3969/j.issn.1673-1182.2015.07.001.
苏红卫,吴平山,罗明华,毛辉荣,张乐红,余新武,梁桂桃,刘三凤. 2014. 修水黄羽乌鸡体质量、体尺和屠宰性能测定及相关性分析[J]. 江西农业大学学报,36(3):633-638. [Su H W,Wu P S,Luo M H,Mao H R,Zhang L H,Yu X W,Liang G T,Liu S F. 2014. The measurement and correlation analysis of body weight,body size and carcass traits of Xiushui yellow silky chicken[J]. Acta Agriculturae Universitatis Jiangxiensis,36(3):633-638.] doi:10.13836/j.jjau.2014103.
唐莹,张跟喜,樊庆灿,王金玉,张涛,魏岳,薛倩,王文浩,王永娟. 2015. MyoG与Myf5基因与京海黄鸡生长性状的相关分析[J]. 中国兽医学报,35(9):1562-1567. [Tang Y,Zhang G X,Fan Q C,Wang J Y,Zhang T,Wei Y,Xue Q,Wang W H,Wang Y J. 2015. Association of growth traits with the MyoG and Myf5 genes in the Jinghai yellow chicken[J]. Chinese Journal of Veterinary Medicine,35(9):1562-1567.] doi:10.16303/j.cnki.1005-4545.2015. 09.31.
田佳. 2014. MyoG、H-FABP、LPL基因对新疆两个地方绵羊品种产肉量及肉质的影响[D]. 乌鲁木齐:新疆农业大学. [Tian J. 2014. Effects of MyoG,H-FABP,LPL genes on meat production and meat quality in two Xinjiang sheep breeds[D]. Urumqi:Xinjiang Agricultural University.] doi:10.7666/d.Y2697987.
王琼,刘益平,蒋小松,杨朝武,杜华瑞,邱莫寒,朱庆. 2007. MyoG基因多态性与优质肉鸡屠宰性状和肉质性状的相关性分析[J]. 遗传,29(9):1089-1096. [Wang Q,Liu Y P,Jiang X S,Yang C W,Du H R,Qiu M H,Zhu Q. 2007. Correlation analysis of relationships between polymorphisms of high quality chicken myogenin gene and slaughter and meat quality traits[J]. Hereditas(Beijing),29(9):1089-1096.] doi:10.16288/j.yczz.2007.09.017.
王彦钦. 2016. 功能基因多态性对拜城油鸡生产性能影响的研究[D]. 乌鲁木齐:新疆农业大学. [Wang Y Q. 2016. Study on the effect of functional gene polymorphism on production performance of Baicheng Fatty chicken[D]. Urumqi:Xinjiang Agricultural University.] doi:10.7666/d.Y3265754.
魏岳,張跟喜,王金玉,张涛,唐莹,樊庆灿,薛倩,王亚男,丁馥香,张丽. 2014. 边鸡MyoG基因与生长和屠体性状的关联分析[J]. 中国畜牧杂志,50(19):1-5. [Wei Y,Zhang G X,Wang J Y,Zhang T,Tang Y,Fan Q C,Xue Q,Wang Y N,Ding F X,Zhang L. 2014. Correlation analysis between single nucleotide polymorphism of MyoG gene and production traits in Bian chicken[J]. Chinese Journal of Animal Science,50(19):1-5.] doi:10.3969/j.issn. 0258-7033.2014.19.001.
叶恒振. 2018. 温度和饥饿对布氏鲳鲹MSTN与MyoG基因表达的影响[D]. 海口:海南大学. [Ye H Z. 2018. The effect of temperate and starvation stress on the expession of myostatin and myogenin genes in golden pompano Trachinotus blochii[D]. Haikou:Hainan University.]
赵振华,黎寿丰,黄华云,李春苗,张静,薛龙岗. 2012. 2个品系肉鸡体尺性状和屠宰性状的典型相关分析[J]. 福建农林大学学报(自然科学版),41(2):166-169. [Zhao Z H,Li S F,Huang H Y,Li C M,Zhang J,Xue L G. 2012. Canonical correlation analysis between body measurement traits and carcass traits of two natural meat-type line chickens[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition),41(2):166-169.] doi:10.3969/j.issn.1671-5470.2012.02.012.
赵忠海,李辉,吴婵,易恒洁,唐汉超,杨茜,李先富. 2013. 贵妃鸡肌细胞生成素基因SNPs检测及其与屠宰性状的相关性分析[J]. 中国畜牧兽医,40(11):148-152. [Zhao Z H,Li H,Wu C,Yi H J,Tang H C,Yang Q,Li X F. 2013. Study on association of single nucleotide polymorphism of MyoG gene with slaughter traits in Royal chicken[J]. Chinese Animal Husbandry and Veterinary Medicine,40(11):148-152.] doi:10.3969/j.issn.1671-7236.2013.11. 034.
周国利,朱奇,吴玉厚,郭彦. 2005. Myogenin基因的分子生物学综述[J]. 生物技术,15(1):90-91. [Zhou G L,Zhu Q,Wu Y H,Guo Y. 2005. Molecular biology of Myogenin gene:A Riview[J]. Biotechnology,15(1):90-91.] doi:10.16519/j.cnki.1004-311x.2005.01.042.
朱丹实,吴晓菲,刘贺,徐永霞,励建荣. 2013. 水分对生鲜肉品品质的影响[J]. 食品工业科技,34(16):363-366. [Zhu D S,Wu X F,Liu H,Xu Y X,Li J R. 2013. Effect of water on quality of fresh meat[J]. Science and Technology of Food Industry,34(16):363-366.] doi:10.13386/j.issn 1002-0306.2013.16.054.
Anton I,ZsolnaiA,Komlosi I,Király A,Fésüs L. 2006. Effect of MyoG genotypes on growth rate and production traits in Hungarian large white pigs[J]. Acta Veterinaria Hungarica,54(3):393-397. doi:10.1556/AVet.54.2006.3.9.
Berkes C A,Tapscott S J. 2005. MyoD and the transcriptional control of myogenesis[J]. Seminars in Cell & Developmental Biology,16(4-5):585-595. doi:10.1016/j.semcdb.2005. 07.006.
Dasarathy S,Dodig M,Muc S M,Kalhan S C,McCullough A J. 2004. Skeletal muscle atrophy is associated with an increased expression of myostatin and impaired satellite cell function in the portacaval anastamosis rat[J]. American Journal of Physiology. Gastrointestinal and Liver Physiology,287(6):G1124-G1130. doi:10.1152/ajpgi.00 202.2004.
Hughes S M,Schiaffino S. 1999. Control of muscle fibre size:A crucial factor in ageing[J]. Acta Physiologica Scandinavica,167(4):307-312. doi:10.1046/j.1365-201x.1999. 00622.x.
Jia H T,Tsay H J,Schmidt J. 1992. Analysis of binding and activating functions of the chick muscle acetylcholine receptor gamma-subunit upstream sequence[J]. Cellular and Molecular Neurobiology,12(3):241-258. doi:10.1007/BF00712929.
Labuza T P,Hyman C R. 1998. Moisture migration and control in multi-domain foods[J]. Trends in Food Science and Technology,9(2):47-55. doi:10.1016/S0924-2244(98)00005-3.
Pas M F,Visscher A H. 1994. Genetic regulation of meat production by embryonic muscle formation–A review[J]. Journal of Animal Breeding and Genetics,111(1-6):404-412. doi:10.1111/j.1439-0388.1994.tb00477.x.
Sabourin L A,Girgis-Gabardo A,Seale P,Asakura A,Rudnicki M A. 1999. Reduced differentiation potential of primary MyoD-/- myogenic cells derived from adult skeletal muscle[J]. The Journal of Cell Biology,144(4):631-643. doi:10.1083/JCB.144.4.631.
Wright W E,Sassoon D,Lin V K. 1989. Myogenin,a factor regulating Myogenesis,has a domain homologous to MyoD[J]. Cell,56(4):607-617. doi:10.1016/0092-8674(89)90583-7.
(責任编辑 兰宗宝)
