基于线粒体Cyt b基因的南海北部金钱鱼种群遗传结构分析
2021-02-09彭敏肖珊陈晓汉潘传燕冯鹏霏陈秀荔曾地刚朱威霖陈慧芳杨春玲
彭敏 肖珊 陈晓汉 潘传燕 冯鹏霏 陈秀荔 曾地刚 朱威霖 陈慧芳 杨春玲




摘要:【目的】分析南海北部金錢鱼(Scatophagus argus)遗传多样性,明确其群体演化历史和分布动态,为金钱鱼养殖育种及其种质资源的合理开发利用提供科学依据。【方法】以采自福建东山(DS)、广东阳江(YJ)、海南海口(HK)、广西北海涠洲岛(BH)、广西钦州(QZ)、广西防城港(FC)及越南清化(TH)等南海北部的7个金钱鱼地理群体为研究对象,基于线粒体DNA细胞色素b基因(Cyt b)序列分析,利用DnaSP 5.10统计南海北部金钱鱼群体的单倍型、单倍型多样性指数(Hd)和遗传多样性指数(π),通过邻接法(NJ)构建单倍型的系统发育进化树,以Network 4.6中的中介连接网络法构建单倍型网络图,并综合Tajima’s D检验、Fu’s Fs检验及核苷酸错配分布等方法分析金钱鱼群体的历史动态。【结果】7个金钱鱼地理群体的291条Cyt b基因序列定义为33个单倍型(Hap1~Hap33),其中单倍型Hap1、Hap2和Hap7是南海北部金钱鱼在长期进化过程中形成的稳定优势基因型。7个金钱鱼地理群体的Hd为0.54103~0.77436,π为0.00112~0.00171,群体内遗传距离为0.00113~0.00171,遗传分化系数(Fst)为-0.01734~0.00364,基因流(Nm)为137.03888~inf。不同地理群体的单倍型均无规律地散布在单倍型系统发育进化树上,不存在与地理群体明显对应的系统分支,也未表现出明显的地理聚群分布特征。金钱鱼群体内个体间的遗传变异为100.74%,说明遗传变异全部来源于群体内个体间,即南海北部金钱鱼群体既无群体分化,也无以琼州海峡分隔的组群分化。Tajima’s D检验和Fu’s Fs检验结果均为显著负值,且核苷酸错配分布呈单峰分布,推测南海北部金钱鱼群体发生过群体扩张,且扩张事件约发生在3.4万年前,属于更新世晚期。【结论】南海北部7个金钱鱼地理群体的遗传多样性符合高单倍型多样性低核苷酸多样性类型,群体间遗传距离较小,亲缘关系较近,遗传分化不明显,且群体间存在频繁的基因交流,具有高度的遗传同质性,符合南海北部金钱鱼是一个随机交配种群的假设。
关键词:金钱鱼;细胞色素b(Cyt b);遗传结构;单倍型;基因交流
中图分类号:S917.4 文献标志码: A 文章编号:2095-1191(2021)10-2851-10
Abstract: 【Objective】In order to analyze the genetic diversity of the spotted scat (Scatophagus argus) in the northern South China Sea, clarify its population evolution history and distribution dynamics, and provide a scientific basis for the breeding,sustainable use of resources, and genetic diversity protection. 【Method】 The seven geographic S. argus populations collected in Dongshan, Fujian(DS), Yangjiang, Guangdong (YJ), Haikou, Hainan (HK), Weizhou Island, Beihai, Guangxi (BH), Qinzhou, Guangxi (QZ), Fangchenggang, Guangxi (FC), and Qinghua of Vietnam(TH) of the northern South China Sea were used as research objects. Based on the mitochondrial DNA cytochrome b gene (Cyt b) sequence analysis, DnaSP 5.10 was used to calculate the haplotype, haplotype diversity index (Hd), and genetic diversity index (π) of S. argus populations in the northern South China Sea. A phylogenetic tree of haplotypes was constructed by the neighbor joining method (NJ), a haplotype network diagram was constructed by the intermediary connection network method in Network 4.6, and the historical dynamics of S. argus populations was analyzed by the Tajima’s D test, Fu’s Fs test and nucleotide mismatch distribution methods. 【Result】The 291 Cyt b gene sequences of the seven S. argus populations were defined as 33 haplotypes (Hap1-Hap33), among which haplotypes Hap1, Hap2 and Hap7 were stable dominant genotype formed during the long-term evolution of S. argus in the northern South China Sea.The Hd, π, genetic distance, genetic differentiation coefficient (Fst), and gene flow(Nm) of the seven geographic populations were 0.54103-0.77436, 0.00112-0.00171, 0.00113-0.00171,-0.01734-0.00364, 137.03888-inf, respectively. The haplotypes of different geographic populations were scattered irregularly on the haplotype phylogenetic tree, there was no systematic branch that clearly corresponded to a geographic population, and it did not show obvious geographic clustering distribution characteristics. The genetic variation among individuals within S. argus populations was 100.74%, indicating that all genetic variation came from individuals within populations, i.e., S. argus populations in the northern South China Sea had neither population differentiation nor group differentiation separated by Qiongzhou Strait. Both Tajima’s D and Fu’s Fs tests were significantly negative, and the nucleotide mismatch distribution was unimodal, indicating that S. argus populations in the northern South China Sea might have experienced an expansion event in history, which occurred about 34000 years ago, belonging to the late Pleistocene.【Conclusion】The genetic diversity of the seven geographic S. argus populations in the northern South China Sea belong to the diversity type of high haplotype diversity and low nucleotide diversity. The genetic distance between the populations is small, the genetic relationship is close, the genetic differentiation is not obvious, and there are frequent gene exchanges between populations and a high degree of genetic homogeneity, which is consistent with the hypothesis that S. argus in the northern South China Sea is a random mating population.
Key words: Scatophagus argus; cytochrome b(Cyt b); genetic structure; haplotype; gene flow
Foundation item:Guangxi Innovation Driven Development Special Project(Guike AA17204088-2)
0 引言
【研究意義】金钱鱼(Scatophagus argus)又称金鼓鱼,隶属于鲈形目(Perciformes)金钱鱼科(Scatophagidae),为广盐暖水性中小型鱼类,广泛分布于印度洋和太平洋,在我国东海南部和南海分布较多(张邦杰等,1999)。金钱鱼科共有2个属4个种,金钱鱼是我国档案记录金钱鱼科的唯一物种,其体型扁平,近圆形,体色棕绿或银白,具棕红色斑点(孙仁杰等,2018)。金钱鱼食性广、适应性和抗病抗逆性强,可在咸淡水及淡水中生长发育,易养殖且成本低,是我国东南沿海地区重要的捕捞和养殖品种(兰国宝等,2005;蔡泽平等,2010)。近年来,受环境污染、生境破坏及过度捕捞等社会因素的影响,导致金钱鱼资源逐年减少,严重制约其产业的持续健康发展,因此亟待进一步加强对金钱鱼种质资源的保护及开发利用。【前人研究进展】目前,国内外有关金钱鱼的研究主要聚焦在基础生物学(宋郁等,2012;吴波等,2014)、人工养殖和繁殖技术(张敏智等,2013;杨尉等,2018)、渗透压调节(Hu et al.,2014;Mu et al.,2015;Su et al.,2016)及繁殖相关基因调控(张逛等,2017;翟毅等,2018;古皓天等,2019)等方面,而针对金钱鱼遗传多样性、种群遗传结构和种群动态分子系统进化等方面的研究鲜见报道。线粒体DNA(Mitochondrial DNA,mtDNA)具有碱基替代速率较快、结构简单、遵循母系遗传、几乎不发生重组及基因进化速度适中等特点,且易使用相关引物进行扩增和测序(杜景豪等,2020;韩浩园等,2020)。在13个mtDNA蛋白编码基因中,以细胞色素b(Cyt b)的结构和功能研究最透彻,适用于物种系统发育及种群遗传学分析(胡静等,2014)。Huang等(2000)基于Cyt b基因分析了北美田间蟋蟀(Gryllulus)的系统演化关系;Flanley等(2018)应用Cyt b基因对埃及和约旦的白纹伊蚊(Phlebotomus papatasi)进行种群遗传学分析;刘玟妍等(2019)通过Cyt b基因鉴定了肉制品中的鸭源性成分;乔付杰等(2019)利用Cyt b基因研究了阿拉善马鹿(Cervus elaphus alxaicus)的分子系统学;祝愿等(2019)基于Cyt b基因探究了假眼小绿叶蝉[Empoasca vitis(Göthe)]11个地理种群的遗传分化情况;梁雪等(2020)利用Cyt b基因研究了西伯利亚狍(Capreolus pygargus)种群的分子系统地理学。Cyt b基因在鱼类遗传多样性分析方面也得到广泛应用,沈朕等(2017)通过Cyt b基因和 D-Loop序列研究了4个大泷六线鱼(Hexagrammos otakii)群体的遗传多样性,杨天燕等(2017)基于Cyt b基因分析了新疆额尔齐斯河贝加尔雅罗鱼(Leuciscus leuciscus baicalensis)的遗传结构,郭易佳等(2019)利用Cyt b基因分析了龙头鱼(Harpadon nehereus)群体的遗传结构。此外,还有学者基于Cyt b基因先后开展了翘嘴鲌(Culteralburnus)(王伟,2007)、大鳍鳠(Mystusmacropterus Bleeker)(周丽,2008)、川陕哲罗鲑(Hucho bleekeri)(祁得林等,2009)、西伯利亚鲟(Acipenser baerii)(王巍等,2012)、刀鲚(Coilia nasus)和凤鲚(C. mystys)(杨巧莉,2012)、罗非鱼(Oreochromis niloticus)(张浩然,2019)等鱼类的遗传多样性、系统发育及分子系统地理学研究。【本研究切入点】Cyt b基因进化速率适中,包含着从种内到种间的较强进化信号,已广泛应用于物种多样性及系统进化等研究领域,但至今未见应用于南海北部金钱鱼种群遗传结构分析的相关报道。【拟解决的关键问题】通过分析金钱鱼线粒体Cyt b基因全长序列,探究南海北部7个金钱鱼地理群体的遗传多样性,明确其群体演化历史和分布动态,进而评估南海北部金钱鱼种质资源状况,为金钱鱼养殖育种及其种质资源的合理开发利用提供科学依据。
1 材料与方法
1. 1 试验材料
金钱鱼样本于2018—2019年采自南海北部7个采样点,分别为福建东山(DS)、广东阳江(YJ)、海南海口(HK)、广西北海涠洲岛(BH)、广西钦州(QZ)、广西防城港(FC)及越南清化(TH)。各采样点的地理分布及采集样本数量见表1。
1. 2 DNA提取及PCR扩增
取50.0 mg金钱鱼肌肉组织,采用醋酸铵法提取DNA(彭敏等,2011),利用微量核酸蛋白分析仪测定DNA浓度和纯度,并以1.0%琼脂糖凝胶电泳进行DNA质量检测,合格的DNA置于-20 ℃冰箱保存备用。根据金钱鱼线粒体序列全长(MN909969)设计Cyt b基因PCR扩增引物(F:5'-AACCAGAACCTATG GCTTGA-3'和R:5'-CCCTGACATCCGGTTTACAA GAC-3'),并委托生工生物工程(上海)股份有限公司合成。PCR反应体系50.0 mL:2×Ex Taq Master Mix Bufffer 25.0 mL,上、下游引物(10.0 mmol/L)各2.0 mL,DNA模板(100 ng/mL)2.0 mL,ddH2O补足至50.0 mL。扩增程序:94 ℃预变性5 min;94 ℃ 30 s,62 ℃ 30 s,72 ℃ 1 min,进行35个循环;72 ℃延伸10 min。PCR扩增产物经1.5%琼脂糖凝胶电泳检测合格后送至深圳华大基因股份有限公司测序。
1. 3 数据处理分析
1. 3. 1 序列分析 测序获得的序列采用Chromas Pro 2.33(http://www.technelysium.com.au/chromas.html)进行人工编辑、校对电泳峰图与碱基对应关系及剪切非研究区域序列。編辑后的序列使用DNAStar中的SeqMan 7.1.0(https://www.dnastar.com/)进行拼接,获得Cyt b基因全长序列后采用MEGA X(https://www.megasoftware.net/)分析序列碱基组成及其变异位点,并以DnaSP 5.10(http://www.ub.edu/dnasp/)统计单倍型、单倍型多样性指数(Hd)和遗传多样性指数(π)。
1. 3. 2 群体系统进化关系分析 ①以条纹钱蝶鱼(Selenotoca multifasciata, Cyt b基因序列GenBank登录号KP728238.1)为外群,利用MEGA X计算Kimura 2-parameter遗传距离,并以邻接法(Neighbor-joining,NJ)构建单倍型的系统发育进化树。②利用Network 4.6(http://www.fluxus-engineering.com/sharenet.htm1)中的中介连接网络法(Median joining)构建单倍型网络图,探讨单倍型间的谱系结构。
1. 3. 3 群体遗传结构分析 ①采用遗传距离、基因流(Nm)和遗传分化系数(Fst)评价两两群体间的遗传差异,重复抽样10000次以检验Fst的显著性。②根据样品来源,将7个金钱鱼地理群体划分为琼州海峡东部组群EAST(HK、YJ和DS)和琼州海峡西部组群WEST(TH、FC、QZ和BH)进行分子方差分析(AMOVA),估算遗传变异的分布情况,随机重复抽样10000次后进行显著性分析。③通过种群分化测试(Exact test of population differentiation)进行随机交配群假设,检验单倍型在不同群体间的分布情况。
1. 3. 4 群体历史动态检测 ①以Tajimaʼs D检验和Fuʼs Fs检验检测中性假说是否成立,随机重复抽样10000次后进行显著性分析。②基于核苷酸不配对分布检验南海北部金钱鱼群体是否存在扩张现象,通过公式t=τ/2uT计算群体自扩张开始到现在的时间(t)。式中,τ为扩张时间参数,u为序列突变速率(u=2μk,k为序列长度,μ为每个核苷酸位点的突变速率),T为世代时间。
2 结果与分析
2. 1 Cyt b基因序列分析结果
经比对分析获得7个金钱鱼地理群体的291条Cyt b基因序列全长均为1141 bp,碱基A、T、G、C的平均含量依次为24.4%、29.0%、14.8%和31.8%,其中A+T含量较C+G含量高6.8%,属于少G偏倚性。Cyt b基因测序结果显示,金钱鱼Cyt b基因序列存在34个变异位点(22个简约信息位点,12个单一变异位点),无插入或缺失位点,变异位点占比为2.98%;在不同金钱鱼地理群体中发现的变异位点数为11~16个,在34个变异位点中有29个为碱基转换、4个为碱基颠换、1个既为碱基颠换又为碱基转换,转颠换比值(R)为6。
金钱鱼Cyt b基因共编码380个氨基酸残基,平均含量最高的是异亮氨酸(16.84%),平均含量最低的是半胱氨酸(0.79%)。在密码子第1位点上,4种碱基均未出现明显的碱基偏倚性,第2位点存在明显的T偏倚性和反G偏倚性,而第3位点存在明显的A偏倚性和反G偏倚性。在Cyt b氨基酸序列中共检测到6个氨基酸变异位点,是由密码子第1位点和第2位点各引起3个变异位点,据此定义出7个氨基酸单倍型,表明金钱鱼Cyt b氨基酸序列具有较低的多态性。
2. 2 单倍型和遗传多样性分析结果
7个金钱鱼地理群体的291条Cyt b基因序列定义为33个单倍型(Hap1~Hap33),包括16个独享单倍型和17个共享单倍型。在共享单倍型中,3个单倍型(Hap1、Hap2和Hap7)为7个地理群体所共享,1个单倍型(Hap4)为6个地理群体所共享,1个单倍型(Hap10)为4个地理群体所所共享,4个单倍型(Hap3、Hap16、Hap25和Hap29)为3个地理群体共享,8个单倍型(Hap5、Hap6、Hap14、Hap15、Hap18、Hap19、Hap22和Hap26)为2个地理群体所共享。33个单倍型的出现频率存在明显差异,其中单倍型Hap1、Hap2、Hap4和Hap7的出现频率合计为75.60%。以单倍型Hap1的出现频率最高,占57.04%;其次为Hap7和Hap2,分别占9.62%和8.93%,说明这3个单倍型是南海北部金钱鱼在长期进化过程中形成的稳定优势基因型。
从表1可看出,7个金钱鱼地理群体的Hd变异不明显,其范围在0.54103~0.77436,以QZ群体的Hd最高(0.77436),其次是BH群体和DS群体,分别为0.68854和0.66262,TH群体的最低(0.54103)。π的范围在0.00112~0.00171,以QZ群体的最高(0.00171),其次是DS群体和FC群体,分别为0.00160和0.00151,TH群体的最低(0.00112)。7个金钱鱼地理群体的Hd为0.65491,π为0.00138,表现为高单倍型多样性低核苷酸多样性类型。
2. 3 群体单倍型间的系统进化关系
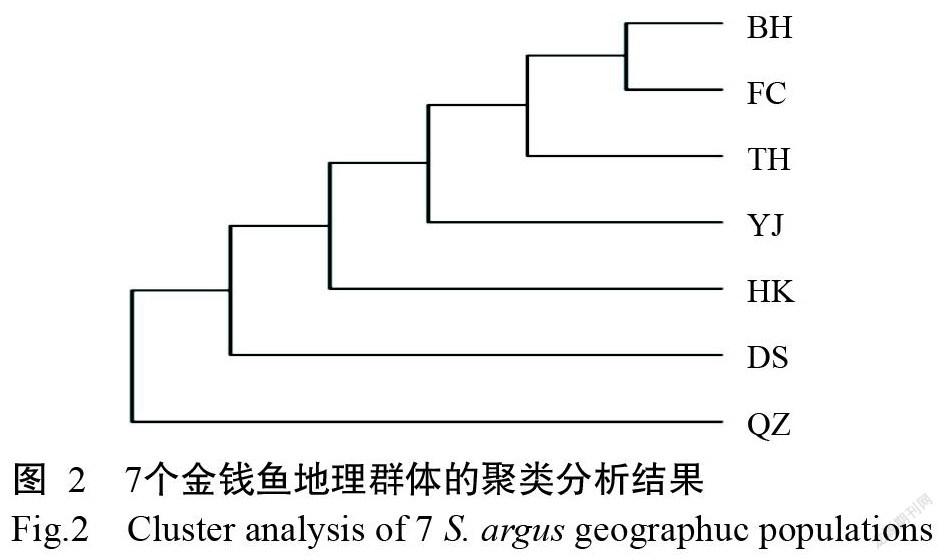
根据金钱鱼Cyt b基因全长序列,以条纹钱蝶鱼为外群,基于Kimura 2-parameter遗传距离构建33个单倍型的系统发育进化树及群体聚类图,结果(图1和图2)显示,不同地理群体的单倍型均无规律地散布在单倍型系统发育进化树上,未能形成明显的类聚分支,不存在与地理群体明显对应的系统分支,也未观察到明显的区域聚群。单倍型系统发育进化树各节点的支持率均较低(<30%),只有极少数两两单倍型分支的支持率超过50%。使用Network 4.0基于中介连接网络法对金钱鱼单倍型进行网络结构分析,结果(图3)发现大多数单倍型通过一个突变链接,且多数与高频单倍型相关联。在金钱鱼单倍型网络图(图3)中,Hap1为高频单倍型,在7个地理群体中均有出现,次高频单倍型Hap7和Hap2在所有地理群体中也均有出现,且出现频率很高,推测这3个单倍型为起源于母系祖先的主体单倍型;其余单倍型无规律,与优势单倍型相连,但未表现出明显的地理聚群分布特征。此外,优势单倍型周围呈辐射状或星状分布有大量单倍型,由此推测金钱鱼群体历史上曾发生过扩张事件。
2. 4 遗传结构分析结果
利用MEGA X分析7个金钱鱼地理群体的291条Cyt b基因序列,得到各地理群体间的遗传距离(表2)。其中,群体内遗传距離为0.00113~0.00171,具体排序为QZ群体>DS群体>FC群体>BH群体>HK群体=YJ群体>TH群体。从群体间遗传距离来看,QZ群体与DS群体间的遗传距离最远(0.00163),TH群体与HK群体及TH群体与YJ群体的遗传距离最近,均为0.00118。由表3可知,7个金钱鱼地理群体间的Fst在-0.01734~0.00364,除了TH群体与DS群体及BH群体与DS群体外,其余群体间的Fst都很小,甚至为负值,且Exact检验均不显著(P>0.05,下同)。7个金钱鱼地理群体间的Nm在137.03888~inf之间,说明基因交流非常频繁,群体间存在高度的遗传同质性。
根据样品来源,将7个金钱鱼地理群体划分为EAST(HK、YJ和DS)和WEST(TH、FC、QZ和BH)2个组群,通过AMOVA分析计算遗传变异分布情况,结果(表4)显示,组群间、组群内群体间及群体内个体间的遗传变异分别为0.27%、-1.01%和100.74%,且Exact检验均不显著,说明遗传变异全部来源于群体内个体间,即南海北部金钱鱼群体既无群体分化,也无以琼州海峡分隔的组群分化。Exact检验结果显示,7个金钱鱼地理群体单倍型在群体间的分布频率并无显著差异,Exact检验得知WEST组群(P=0.62025)、EAST组群(P=0.63755)及整体(P=0.06203)间均不显著,符合南海北部金钱鱼是一个随机交配种群的假设。
2. 5 群体动态分析结果
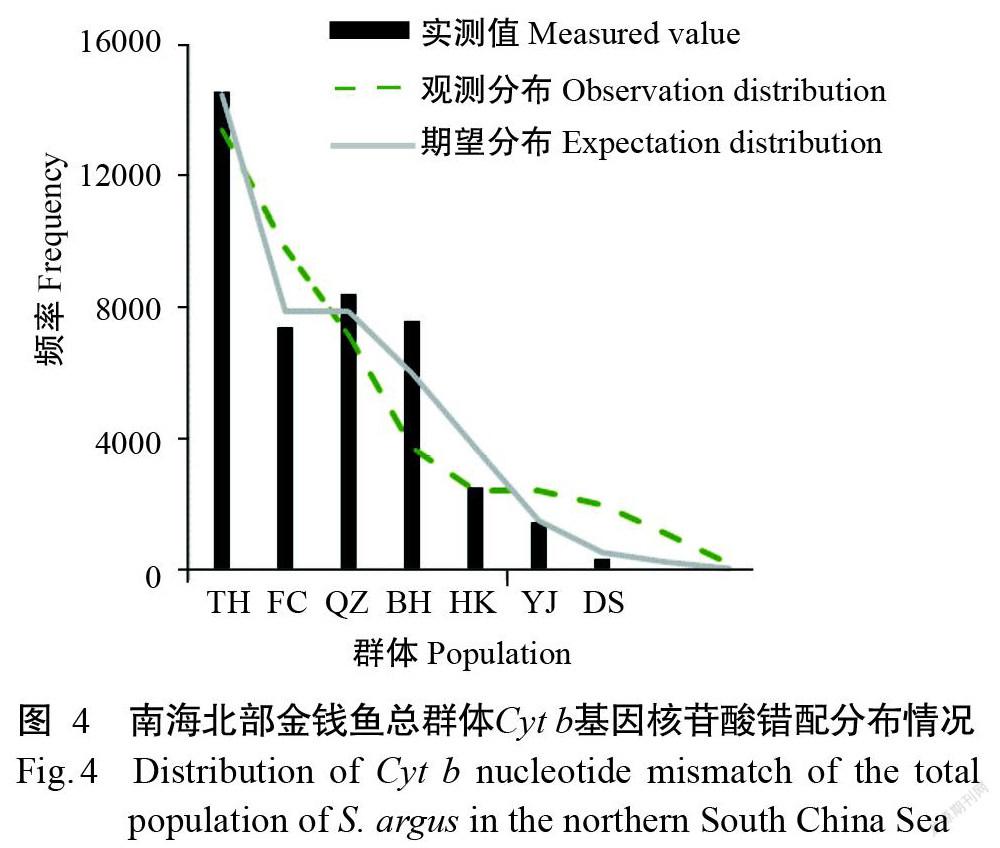
采用Tajimaʼs D检验、Fuʼs Fs检验及核苷酸错配分布等方法同时分析金钱鱼群体的历史动态。由于7个金钱鱼地理群体间的遗传分化不显著,故将其合并为1个大群体进行历史动态分析。中性检验结果显示,Tajimaʼs D=-1.97503(P=0.00100),Fuʼs Fs=-27.35849(P=0.00000),均为负值,显著偏离中性理论下的Wright-Fisher模型。由图4可知,基于数量扩张的核苷酸错配分布呈单峰分布,且观测分布与期望分布基本吻合。中性检验结果和核苷酸错配分布结果均提示,南海北部金钱鱼群体在历史上可能发生过扩张事件。根据Arlequin计算的扩张时间参数(τ)为3.10352,Cyt b基因核苷酸进化速率按2%每百万年计,以1年为1个世代的时间跨度(杨尉等,2018),估算得到南海北部金钱鱼群体的扩张事件约发生在3.4万年前。
3 讨论
3. 1 金钱鱼遗传多样性
遗传多样性是生物多样性的重要组成部分,是物种及其群体通过适应不断变化的生存环境而自我进化的前提。通常情况下,物种遗传多样性与其进化潜力及响应环境改变的能力呈正相关(Laikre et al.,2005)。遗传多样性为物种的适应能力、生存能力和进化潜力提供潜在的遗传基础,其多样性下降可导致物种适应能力下降,物种退化,甚至威胁物种生存(季维智和宿兵,1999;姜艳艳等,2003)。Hd和π等遗传指数是评估群体遗传多样性的重要指标,其值越高,说明群体遗传多样性越高,遗传资源越丰富,育种空间和遗传改良潜力越大(邓朝阳,2015)。本研究中,基于Cyt b基因序列的7个金钱鱼地理群体Hd在0.54103~0.77436,平均为0.65491;π在0.00112~0.00171,平均为0.00138。根据Grant和Bowen(1998)的研究方法,以Hd=0.5和π=0.005为界,可将海水鱼类的遗传多样性划分为4种类型:①低单倍型多样性指数低遗传多样性指数;②高单倍型多样性指数低遗传多样性指数;③低单倍型多样性指数高遗传多样性指数;④高单倍型多样性指数高遗传多样性指数。本研究结果表明,南海北部7个金钱鱼地理群体的遗传多样性符合高单倍型多样性低核苷酸多样性类型,可能是由于该种群发生瓶颈效应后,种群快速增长,单倍型多样性得到提高,但在相同时间内核苷酸多样性未得到提高。与同海域的其他鱼类相比,金钱鱼的多样性低于波纹唇鱼(Cheilinus undulatus)(Hd=0.663~0.800,π=0.00082~0.00155)(胡静等,2014)、黄鳍马面鲀(Thamnaconus hypargyreus)(Hd=0.8842~0.9804,π=0.00262~0.00469)(李玉芳等,2014)、短尾大眼鲷(Priacanthus macracanthus)(Hd=0.8130~0.9012,π=0.0040~0.0053)(熊丹等,2016)及花斑蛇鲻(Saurida undosquamis)(Hd=0.9251~0.9929,π=0.003145~0.003852)(李敏等,2019),但高于龙头鱼(Harpadon nehereus) (Hd=0.1630~0.2391,π=0.000150~0.000225)(郭易佳等,2019)。可见,基于Cyt b基因序列的金钱鱼多样性处于中等偏低水平,可能与过度捕捞等因素有关。金钱鱼广泛分布于我国南海,具有性成熟早(1龄)、个体绝对生殖力强(鱼体重与怀卵量比18~20∶1)、产卵时间长(4—9月)、孵化时间短(28.5 h)、浮性卵、食性广及适应性和抗病抗逆性强等特点(兰国宝等,2005;杨尉等,2018),理论上应积累有较多遗传变异,但自20世纪70年代以来其产量逐年递减,过度捕捞增加了物种遗传信息保存的压力,最终可能导致遗传多样性水平的丢失(牛素芳等,2018)。
基因中性检验通常用于判断群体的稳定和历史动态(张浩然,2019)。本研究通过中性检验和制作核苷酸错配分布图以推断南海北部金钱鱼的群体动态,结果发现Tajimaʼs D检验和Fuʼs Fs检验结果均为显著负值,且核苷酸错配分布呈单峰分布,推测南海北部金钱鱼群体发生过群体扩张,且扩张事件约发生在3.4万年前,属于更新世晚期。在中更新世期间(0.786百万~0.126百万年前),我国华南地区出现过多次冰期,期间气候变冷、海平面下降、食物匮乏,均不利于生物的生存繁衍;直到冰期褪去,气候逐渐回暖,食物丰富,生物得以生存繁衍,才极大促进物种的种群扩张(杨计平等,2018)。南海海域的许多鱼类如三线矶鲈(Parapristipoma trilineatus)(薛丹等,2014)、大斑石鲈(Pomadasys maculatus)(郜星晨等,2016)及黄斑蓝子鱼(Siganus oramin)(黄小林等,2018)等均在此时期发生扩张事件。
3. 2 金钱鱼遗传变异情况
遗传距离是指不同种群或种间的基因差异程度,是衡量群体间遗传变异程度的重要指标,遗传距离越小,说明群体间的亲缘关系越近。Sharlee等(1982)通过整理已有资料,指出鱼类在种群(0.05)、种(0.30)和属(0.90)水平上的遗传距离分类依据。本研究基于Cyt b基因序列,利用MEGA X计算Kimura 2-parameter遗传距离,得知7个金钱鱼地理群体的群体间和群体内遗传距离分别为0.00118~0.00163和0.00113~0.00171,均远低于0.05且无显著差异,遗传距离较小,说明这些金钱鱼群体间的亲缘关系较近。金钱鱼单倍型系统发育进化树、群体聚类分析结果及单倍型网络图均显示,来自各地理群体的单倍型呈交叉散乱分布,未观察到明显以地理群体为单位的家系式分支或聚簇现象,也没观察到明显的区域聚群。一般认为,Nm<1表示群体间遗传分化较大,Nm>1表示群体间遗传分化较小(Petit and Excoffier,2009)。本研究中,7个金钱鱼地理群体间的Nm范围在137.03888~inf,均遠大于1,说明这些金钱鱼群体间存在非常频繁的基因交流。
在群体遗传学中,Fst是衡量群体间遗传分化程度的重要指标,Fst越大表明种群间的遗传分化程度越高。早在1965年,Wright就对遗传分化提出标准:Fst为0~0.05时表示群体间无遗传分化,Fst为0.05~0.15时表示群体间存在较小遗传分化,Fst为0.15~0.25表示群体间存在中度遗传分化,Fst大于0.25时表示群体间存在较大遗传分化。本研究中,7个金钱鱼地理群体间的Fst在-0.01734~0.00364,除了TH群体与DS群体及BH群体与DS群体外,其余群体间的Fst都很小,甚至为负值,且Exact检验均不显著。AMOVA分析结果显示,100.74%的遗传变异来源于群体内个体间,进一步表明南海北部金钱鱼群体既无群体分化,也无以琼州海峡分隔的组群分化。Exact检验结果也显示,7个金钱鱼地理群体单倍型在群体间的分布频率并无显著差异,符合南海北部金钱鱼是一个随机交配种群的假设。究其原因可能是许多海洋鱼类具有较强的扩散能力,其卵、幼体甚至成鱼借助南海沿海季风漂流、南海暖流、琼州海峡余流及北部湾沿岸流等海流进行长距离扩散,导致地理距离很远的群体间产生频繁的基因交流,而在广阔的分布范围内表现出较低的遗传分化(牛素芳等,2018),如同海域的蓝圆鲹(Decapterus maruadsi)、卵形鲳鲹(Trachinotus ovatus)、黄鳍马面鲀、短尾大眼鲷及花斑蛇鲻等鱼类均具有高度的遗传同质性,属于无变异种群。
4 结论
南海北部7个金钱鱼地理群体的遗传多样性符合高单倍型多样性低核苷酸多样性类型,群体间遗传距离较小,亲缘关系较近,遗传分化不明显,且群体间存在频繁的基因交流,具有高度的遗传同质性,符合南海北部金钱鱼是一个随机交配种群的假设。
参考文献:
蔡泽平,王毅,胡家玮,张俊彬,林岳光. 2010. 金钱鱼繁殖生物学及诱导产卵试验[J]. 热带海洋学报,29(5):180-185. [Cai Z P,Wang Y,Hu J W,Zhang J B,Lin Y G. 2010. Reproductive biology of Scatophagus argus and artificial induction of spawning[J]. Journal of Tropical Oceanography,29(5):180-185.] doi:10.3969/j.issn.1009-5470.2010.05.029.
邓朝阳. 2015. 鲫4个群体线粒体Cyt b序列和D-loop区的比较分析[J]. 现代农业科技,(9):277-279. [Deng C Y. 2015. Comparative of mitochondrial Cyt b sequence and D-loop region of Carassius auratus from four populations[J]. Modern Agricultural Science and Technology,(9):277-279.]
杜景豪,王伟峰,陈秀荔,侯春秀,王焕岭。 2020. 基于Cytb和D-Loop的日本囊对虾遗传多样性分析[J]。 水产科学,39(4):524-531. [Du J H,Wang W F,Chen X L,Hou C X,Wang H L. 2020. Analysis of genetic diversity of kuruma prawn Marsupenaeus japonicus based on mitochondrial Cytb and D-Loop sequences[J]. Fisheries Scien-ce,39(4):524-531.] doi:10.16378/j.cnki.1003-1111.2020. 04.008.
郜星晨,章群,薛丹,宫亚运,曹艳,韩博平. 2016. 基于线粒体控制区部分序列的南海大斑石鲈遗传多样性分析[J]. 海洋科学,40(7):41-45. [Gao X C,Zhang Q,Xue D,Gong Y Y,Cao Y,Han B P. 2016. Genetic diversity of Pomadasys maculatus in coastal waters of South China Sea via mtDNA control region partial sequences[J]. Marine Sciences,40(7):41-45.] doi:10.11759//hykx2014 1118001.
古皓天,刘倩晴,司徒家欣,江东能,陈华谱,吴天利,李广丽. 2019. 金钱鱼Dmrt5基因的克隆及表达分析[J]. 海南热带海洋学院学报,26(2):9-15. [Gu H T,Liu Q Q,Situ J X,Jiang D N,Chen H P,Wu T L,Li G L. 2019. Cloning and expression of Dmrt5 gene in Scatophagus argus[J]. Journal of Hainan Tropical Ocean University,26(2):9-15.] doi:10.13307/j.issn.2096-3122.2019.02.02.
郭易佳,杨天燕,孟玮,韩志强,高天翔. 2019. 基于线粒体Cyt b基因的龙头鱼群体遗传结构分析[J]. 水生生物学报,43(5):945-952. [Guo Y J,Yang T Y,Meng W,Han Z Q,Gao T X. 2019. The genetic structure of the bombay duck(Harpadon nehereus) based on mitochondrial Cyt b gene[J]. Acta Hydrobiologica Sinica,43(5):945-952.] doi:10.7541/2019.112.
韓浩园,权凯,闫志浩,高慧军,刘德奇,王先宁,尹慧茹,赵金艳,贾万里,李红霞,余世锋,王拥庆,李君. 2020. 河南奶山羊线粒体D-loop区遗传多态性和遗传分化研究[J]. 河南农业大学学报,54(4):643-649. [Han H Y,Quan K,Yan Z H,Gao H J,Liu D Q,Wang X N,Yin H R,Zhao J Y,Jia W L,Li H X,Yu S F,Wang Y Q,Li J. 2020. Genetic diversity and genetic differentiation analysis of mitochondrion D-loop region in Henan dairy goats[J]. Journal of Henan Agricultural University,54(4):643-649.] doi:10.16445/j.cnki.1000-2340.2020.04.012.
胡静,侯新远,尹绍武,祝斐,贾一何,王小军. 2014. 基于mtDNA COI和Cyt b基因序列对南中国海不同海域波纹唇鱼群体遗传多样性的研究[J]. 水生生物学报,38(6):1008-1016. [Hu J,Hou X Y,Yin S W,Zhu F,Jia Y H,Wang X J. 2014. Genetic diversity and divergence of Cheilinus undulatus of different geographic populations of the South China Sea revealed by COIand Cyt b gene analyses[J]. Acta Hydrobiologica Sinica,38(6):1008-1016.] doi:10. 7541/2014.149.
黄小林,李文俊,林黑着,杨育凯,李涛,虞为,黄忠. 2018. 基于线粒体DNA D-loop序列的黄斑篮子鱼群体遗传多样性分析[J]. 热带海洋学报,37(4):45-51. [Huang X L,Li W J,Lin H Z,Yang Y K,Li T,Yu W,Huang Z. 2018. Genetic variations among Siganus oramin populations in coastal waters of southeast China based on mtDNA control region sequences[J]. Journal of Tropical Oceanography,37(4):45-51.] doi:10.11978/2017109.
季维智,宿兵. 1999. 遗传多样性研究的原理和方法[M]. 杭州:浙江科学技术出版社. [Ji W Z,Su B. 1999. Principles and methodologies of genetic diversity studies[M]. Hangzhou:Zhejiang Science and Technology Press.]
姜艳艳,孔晓瑜,喻子牛,庄志猛,金显仕. 2003. 黄海蓝点马鲛mtDNA D-1oop序列变异分析[J]. 中国水产科学,10(3):177-183. [Jiang Y Y,Kong X Y,Yu Z N,Zhuang Z M,Jin X S. 2003. Genetic diversity of Scomberomorus niphonius in the Yellow Sea revealed by mtDNA D-loop sequence[J]. Journal of Fishery Sciences of China,10(3):177-183.] doi:10.3321/j.issn:1005-8737.2003.03.001.
兰国宝,阎冰,廖思明,罗砚,谢若痴. 2005. 金钱鱼生物学研究及回顾[J]. 水产科学,24(7):39-41. [Lan G B,Yan B,Liao S M,Luo Y,Xie R C. 2005. Biology of spotted scat Scatophagus argus:A review[J]. Fisheries Science,24(7):39-41.] doi:10.3969/j.issn.1003-1111.2005.07.013.
李敏,黄梓荣,许友伟,陈作志. 2019. 基于线粒体cytb序列的花斑蛇鲻种群遗传结构研究[J]. 南方水产科学,15(6):41-48. [Li M,Huang Z R,Xu Y W,Chen Z Z. 2019. Population genetic structure of brushtooth lizardfish (Saurida undosquamis)based on mitochondrial cytochrome b gene sequences[J]. South China Fisheries Science,15(6):41-48.] doi:10.12131/20190123.
李玉芳,李永振,陈国宝,孙典荣,于杰,崔科. 2014. 基于线粒体Cyt b基因的黄鳍马面鲀种群分析[J]. 水产学报,38(1):23-32. [Li Y F,Li Y Z,Chen G B,Sun D R,Yu J,Cui K. 2014. Population analysis of Thamnaconus hypargyreus based on the mitochondrial Cyt b sequence[J]. Journal of Fisheries of China,38(1):23-32.] doi:10.3724/SP.J.1231.2014.48864.
梁雪,周绍春,刘艳华. 2020. 基于线粒体DNA Cyt b西伯利亚狍种群分子系统地理学研究[J]. 野生动物学报,41(3):560-565. [Liang X,Zhou S C,Liu Y H. 2020. Molecular phylogeography of Capreolus pygargus population based on mitochondrial DNA Cyt b[J]. Chinese Journal of Wildlife,41(3):560-565.] doi:10.19711/j.cnki.issn2310-1490.2020.03.002.
刘玟妍,陈思秀,王天添,段思琪,艾金霞,王艳双,孙丽媛. 2019. 基于Cyt-B基因鉴定肉制品中鸭源性成分的研究[J]. 食品研究与开发,40(24):173-179. [Liu W Y,Chen S X,Wang T T,Duan S Q,Ai J X,Wang Y S,Sun L Y. 2019. Identification of duck derived components in meat products based on Cyt-B gene[J]. Food Research and Development,40(24):173-179.] doi:10.12161/j.issn.1005-6521.2019.24.027.
牛素芳,吴仁协,张丽艳,张浩冉,梁锐,李忠炉. 2018. 基于Cyt b基因序列的南海北部蓝圆鲹群体遗传多样性研究[J]. 应用海洋学学报,37(2):263-273. [Niu S F,Wu R X,Zhang L Y,Zhang H R,Liang R,Li Z L. 2018. Genetic diversity analysis of Decapterus maruadsi from South China Sea based on mitochondrial DNA Cyt b sequence[J]. Journal of Applied Oceanography,37(2):263-273.] doi:10.3969/J.ISSN.2095-4972.2018.02.014.
彭敏,陈秀荔,蒋伟明,杨春玲,李咏梅. 2011. 醋酸铵法提取卵形鲳鲹基因组DNA[J]. 天津农业科学,17(1):114-117. [Peng M,Chen X L,Jiang W M,Yang C L,Li Y M. 2011. Ammonium acetate method to isolate high quality genomic DNA of Trachinotus ovatus[J]. Tianjin Agricultural Science,17(1):114-117.] doi:10.3969/j.issn.1006-6500.2011.01.029.
祁得林,晁燕,杨成,申志新,唐文家. 2009. 川陕哲罗鲑Cyt b基因克隆及其在鲑亚科中的系统发育关系[J]. 四川动物,28(6):805-809. [Qi D L, Chao Y, Yang C,Shen Z X, Tang W J. 2009. Cloning of mitochondrial Cyt b gene of Hucho bleekeri and its phylogenetic relationship in subfamily salmoninae[J]. Sichuan Journal of Zoology,28(6):805-809.]
喬付杰,李俊乐,高惠,滕丽微,王继飞,刘振生. 2019. 基于线粒体Cyt b DNA阿拉善马鹿分子系统学研究[J]. 野生动物学报,40(2):307-311. [Qiao F J,Li J L,Gao H,Teng L W,Wang J F,Liu Z S. 2019. Molecular phylogenetics of the Alashan red deer (Cervus elaphus alxaicus) based on Cyt b DNA[J]. Chinese Journal of Wildlife,40(2):307-311.] doi:10.3969/j.issn.1000-0127.2019.02.009.
沈朕,关洪斌,郑风荣,胡发文,郭文,王波. 2017. 基于cytb和D-loop的4个大泷六线鱼群体遗传多样性分析[J]. 海洋科学进展,35(4):524-534. [Shen Z,Guan H B,Zheng F R,Hu F W,Guo W,Wang B. 2017. Analysis of genetic diversity between four populations of Hexagrammos otakii based on partial mtDNA cytb and D-loop[J]. Advances in Marine Science,35(4):524-534.] doi:10.3969/j.issn. 1671-6647.2017.04.009.
宋郁,苏冒亮,刘南希,张俊彬. 2012. 金钱鱼幼鱼低温耐受能力和饵料营养需求的研究[J]. 上海海洋大学学报,21(5):715-719. [Song Y,Su M L,Liu N X,Zhang J B. 2012. Studied on low temperature resistance and nutritional needs of Scatophagus argus juveniles[J]. Journal of Shanghai Ocean University,21(5):715-719.]
孙仁杰,范航清,吴斌,周浩郎,刘文爱,阎冰,邱广龙,杨明柳. 2018. 广西红树林生态系统的常见物种[J]. 广西科学,25(4):372-387. [Sun R J,Fan H Q,Wu B,Zhou H L,Liu W A,Yan B,Qiu G L,Yang M L. 2018. Common species of mangrove ecosystems in Guangxi[J]. Guangxi Sciences,25(4):372-387.] doi:10.13656/j.cnki.gxkx. 20180813.001.
王巍,朱华,胡红霞. 2012. 4种鲟鱼养殖亲鱼群体遗传多样性分析[J]. 动物学杂志,47(1):105-111. [Wang W,Zhu H,Hu H X. 2012. Genetic diversity of the reserved brood stocks in four species of sturgeon[J]. Chinese Journal of Zoology,47(1):105-111.] doi:10.13859/j.cjz.2012.01.013.
王伟. 2007. 翘嘴鲌(Culter alburnus)群体遗传多样性及鲌亚科鱼类系统发生的研究[D]. 上海:华东师范大学. [Wang W. 2007. Study on population genetic diversity of Culter alburnus and phylogeny of cultrinae[D]. Shanghai:East China Normal University.] doi:10.7666/d.y1073549.
吴波,张敏智,邓思平,师尚丽,李广丽,朱春华. 2014. 金钱鱼雌雄个体的形态差异分析[J]. 上海海洋大学学报,23(1):64-69. [Wu B,Zhang M Z,Deng S P,Shi S L,Li G L,Zhu C H. 2014. Analysis of morphological index and discrimination of male and female Scatophagus argus[J]. Journal of Shanghai Ocean University,23(1):64-69.]
熊丹,李敏,李永振,李玉芳,张魁,陈作志. 2016. 南海短尾大眼鲷线粒体Cyt b基因序列及种群判别分析[J]. 中国水产科学,23(1):188-197. [Xiong D,Li M,Li Y Z,Li Y F,Zhang K,Chen Z Z. 2016. Sequence analysis of the mitochondrial cytochrome b gene and identification of the Priacanthus macracanthus population in the South China Sea[J]. Journal of Fishery Sciences of China,23(1):188-197.] doi:10.3724/SP.J.1118.2016.15114.
薛丹,章群,郜星晨,宫亚运,曹艳. 2014. 基于线粒体控制区的粤闽三线矶鲈地理群体的遗传变异分析[J]. 海洋渔业,36(6):496-502. [Xue D,Zhang Q,Gao X C,Gong Y Y,Cao Y. 2014. Genetic variations among Parapristipoma trilineatus in coastal waters of Southeast China based on mtDNA control region sequences[J]. Marine Fisheries,36(6):496-502.] doi:10.3969/j.issn.1004-2490. 2014.06.003.
楊计平,李策,陈蔚涛,李跃飞,李新辉. 2018. 西江中下游鳤的遗传多样性与种群动态历史[J]. 生物多样性,26(12):1289-1295. [Yang J P,Li C,Chen W T,Li Y F,Li X H. 2018. Genetic diversity and population demographic history of Ochetobius elongatus in the middle and lower reaches of the Xijiang River[J]. Biodiversity Science,26(12):1289-1295.] doi:10.17520/biods.2018121.
杨巧莉. 2012. 中国鲚属鱼类进化关系及刀鲚、凤鲚的分子系统地理学研究[D]. 青岛:中国海洋大学. [Yang Q L. 2012. Phylogenetic analysis of genus Coilia in China and molecular phylogeography of C. nasus and C. mystys[J]. Qingdao:Ocean University of China.] doi:10.7666/d.y215 8221.
杨天燕,孟玮,海萨,牛建功,周琼. 2017. 基于线粒体Cyt b序列对新疆额尔齐斯河贝加尔雅罗鱼遗传结构的分析[J]. 动物学杂志,52(2):304-313. [Yang T Y,Meng W,Hai S,Niu J G,Zhou Q. 2017. Population genetic structure of siberian dace (Leuciscus leuciscus baicalensis) in Irtysh River China based on the Cyt b gene sequences[J]. Chinese Journal of Zoology,52(2):304-313.] doi:10.13859/j.cjz.201702014.
杨尉,陈华谱,江东能,邓思平,吴天利,朱春华,李广丽. 2018. 金钱鱼生物学及繁养殖技术研究进展[J]. 生物学杂志,35(5):104-108. [Yang W,Chen H P,Jiang D N,Deng S P,Wu T L,Zhu C H,Li G L. 2018. An overview on biology and artificial propagation and culture in the spotted scat Scatphagus argus[J]. Journal of Biology,35(5):104-108.] doi:10.3969/j.issn.2095-1736.2018.05.104.
翟毅,刘建业,贾丽英,江东能,陈华谱,李广丽,邓思平. 2018. 金钱鱼cyp17a1基因克隆、组织分布及在卵巢发育中的表达[J]. 广东海洋大学学报,38(5):1-7. [Zhai Y,Liu J Y,Jia L Y,Jiang D N,Chen H P,Li G L,Deng S P. 2018. Cloning,tissue distribution and expression of cyp17a1 at different ovarian development stages in spotted scat (Scatophagus argus )[J]. Journal of Guangdong Ocean University,38(5):1-7.] doi:10.3969/j.issn.1673-9159.2018.05.001.
張邦杰,梁仁杰,毛大宁,张邦豪. 1999. 金钱鱼的生长特性与咸水池塘驯养[J]. 现代渔业信息,14(10):8-12. [Zhang B J,Liang R J,Mao D N,Zhang B H. 1999. Growth cha-racteristic and its salt-water pond rearing of Scatophagus argus[J]. Modern Fisheries Information,14(10):8-12.]
张逛,王武,段征宇,桂朗,苏冒亮,牟幸江,张俊彬. 2017. 金钱鱼促性腺激素受体基因克隆及其在性腺发育不同时期mRNA表达水平的分析[J]. 水产学报,41(7):993-1005. [Zhang G,Wang W,Duan Z Y,Gui L,Su M L,Mu X J,Zhang J B. 2017. Gene cloning of gonadotropic hormone receptors and their mRNA expressions at diffe-rent development stages of the gonad in Scatophagus argus[J]. Journal of Fisheries of China,41(7):993-1005.] doi:10.11964/jfc.20160310332.
张浩然. 2019. 珠江水系西江上游尼罗罗非鱼群体变异及遗传多样性[D]. 贵阳:贵州大学. [Zhang H R. 2019. Genetic variation and diversity of Oreochromis niloticus population in the upper reaches of Xijiang River in Pearl River System[D]. Guiyang:Guizhou University.]
张敏智,邓思平,朱春华,李广丽. 2013. 温度对金钱鱼卵巢发育的影响[J]. 中国水产科学,20(3):599-606. [Zhang M Z,Deng S P,Zhu C H,Li G L. 2013. Effects of temperature on ovarian development in Scatophagus argus[J]. Journal of Fishery Sciences of China,20(3):599-606.] doi:10.3724/SP.J.1118.2013.00599.
周丽. 2008. 大鳍鳠(Mystus macropterus Bleeker)遗传多样性及其线粒体控制区结构的研究[D]. 重庆:西南大学. [Zhou L. 2008. Studies on genetic diversity and structure of mtDNA control region of Mystus macropterus Bleeker[D]. Chongqing:Southwest University.]
祝愿,李俊,庞宏宇,王震,杜楠,熊胜利,蔡滔. 2019. 基于Cyt b基因的假眼小绿叶蝉11个地理种群遗传分化研究[J]. 生物资源,41(3):228-235. [Zhu Y,Li J,Pang H Y,Wang Z,Du N,Xiong S L,Cai T. 2019. Genetic differentiation of 11 geographical populations of Empoasca vitis (Göthe)(Hemiptera:Cicadellidae)based on mtDNA Cyt b gene[J]. Biotic Resources,41(3):228-235.] doi:10.14188/ j.ajsh.2019.03.006.
Flanley C M,Ramalho-Ortigao M,Coutinho-Abreu I V,Mukbel R,Hanafi H A,El-Hossary S S,Fawaz E E Y,Hoel D F,Bray A W,Stayback G,Shoue D A,Kamhawi S,Karakuş M,Jaouadi K,Yaghoobie-Ershadi M R,Krüger A,Amro A,Kenawy M A,Dokhan M R,Warburg A,Hamarsheh O,McDowell M A. 2018. Population genetics analysis of Phlebotomus papatasi sand flies from Egypt and Jordan based on mitochondrial cytochrome b haplotypes[J]. Parasit Vectors,11(1):214. doi:10.1186/s13071-018-2785-9.
Grant W S,Bowen B W. 1998. Shallow population histories in deep evolutionary lineages of marine fishes:Insights from sardines and anchovies and lessons for conservation[J]. The Journal of Heredity,89(5):415-426. doi:10. 1093/jhered/89.5.415.
Hu P,Li S Q,Zhong Y,Mu X J,Gui L,Zhang J B. 2014. Identification of fxyd genes from the spotted scat (Scatophagus argus):Molecular cloning,tissue-specific expression,and response to acute hyposaline stress[J]. Comparative Biochemistry and Physiology. Part B:Biochemistry and Molecular Biology,174:15-22. doi:10.1016/j.cbpb.2014. 05.002.
Huang Y,Ortí G,Sutherlin M,Duhachek A,Zera A. 2000. Phylogenetic relationships of north American field cric-kets inferred from mitochondrial DNA data[J]. Molecular Phylogenetics and Evolution,1(17):48-57. doi:10. 1006/mpev.2000.0815.
Laikre L,Palm S,Ryman N. 2005. Genetic population structure of fishes:Implications for coastal zone management[J]. Ambio,34(2):111-119.
Mu X J,Su M L,Gui L,Liang X M,Zhang P P,Hu P,Liu Z H,Zhang J B. 2015. Comparative renal gene expression in response to abrupt hypoosmotic shock in spotted scat (Scatophagus argus)[J]. General and Comparative Endocrinology,215:25-35. doi:10.1016/j.ygcen.2014.09.017.
Petit R J,Excoffier L. 2009. Gene flow and species delimitation[J]. Trends in Ecolgoy and Evolution,24(7):386-93. doi:10.1016/j.tree.2009.02.011.
Sharlee J B,Tamaru C,Waples R S. 1982. Speciation and evolution of marine fishes studied by the electrophoretic analysis of proteins[J]. Pacific Science,36(2):141-157.
Su M L,Mu X J,Gui L,Zhang P P,Zhou J N,Ma J,Zhang J B. 2016. Dopamine regulates renal osmoregulation during hyposaline stress via DRD1 in the spotted scat (Scatophagus argus)[J]. Scientific Reports,6:37535. doi:10. 1038/srep37535.
Wright S. 1965. The interpretation of population structure by F-statistics with special regard to systems of mating[J]. Evolution,19(3):395-420.
(責任编辑 兰宗宝)
