模拟空运过程中克氏原螯虾生理生化指标的变化规律
2021-02-09郝晨光李军涛张泽龙张秀霞冼健安王冬梅
郝晨光 李军涛 张泽龙 张秀霞 冼健安 王冬梅


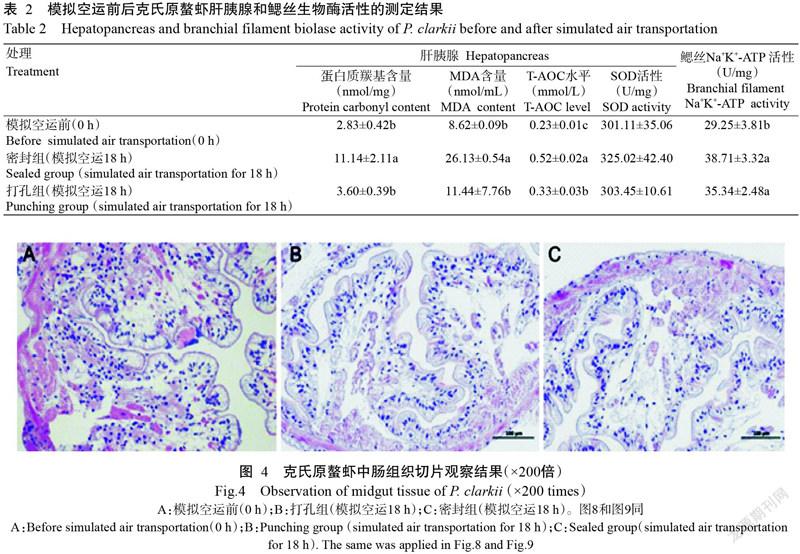
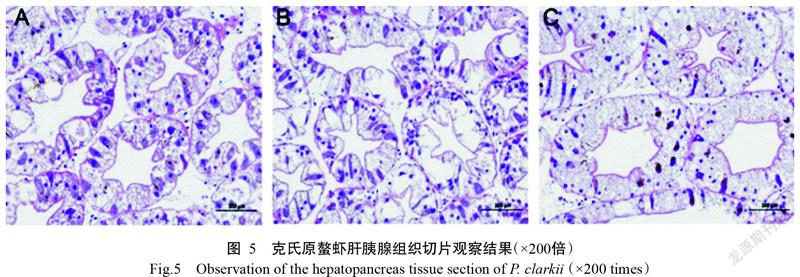
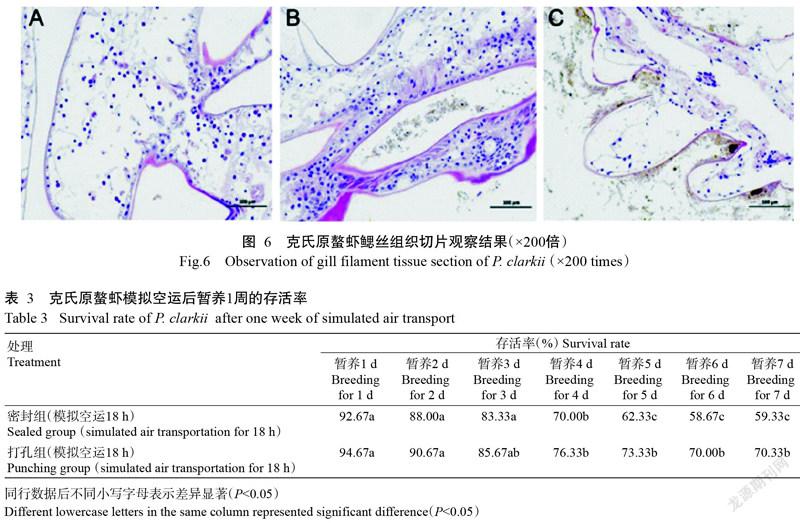
摘要:【目的】明确空运过程中影响克氏原螯虾存活率的关键环境因子,为有针对性地进行空运前预处理提供科学依据。【方法】模拟克氏原螯虾空运条件,将克氏原螯虾放入泡沫箱中,加入冰瓶后进行完全密封(密封组)或打孔通气(打孔组)。模拟空运过程实时监测泡沫箱内的含氧量、温度和相对湿度;模拟空运18 h后采集克氏原螯虾的血清、肝胰腺、鳃丝及中肠等组织样品,分别测定血清溶菌酶(LZM)活性、多酚氧化酶(PPO)活性、超氧化物歧化酶(SOD)活性及丙二醛(MDA)含量,肝胰腺SOD活性、总抗氧化能力(T-AOC)、MDA含量及蛋白质羰基含量,以及鳃丝Na+K+-ATP活性;并制作克氏原螯虾肝胰腺、鳃丝及中肠组织石蜡切片,统计模拟空运结束后克氏原螯虾的存活率。【结果】在模拟空运过程中,相对湿度变化不明显,温度和含氧量的变化引起克氏原螯虾应激反应,是影响空运的主要环境因子。经模拟空运后,密封组克氏原螯虾血清LZM活性、PPO活性及MDA含量显著升高(P<0.05,下同),SOD活性显著降低;肝胰腺蛋白质羰基含量、MDA含量和T-AOC水平均显著高于打孔组及模拟空运前,而SOD活性变化不显著;密封组和打孔组克氏原螯虾经模拟空运18 h后,其鳃丝Na+K+-ATP活性均显著高于模拟空运前。克氏原螯虾经模拟空运18 h后其存活率较高,但模拟空运后暂养1周发现密封组和打孔组的克氏原螯虾存活率均从第4 d开始显著下降,至暂养第7 d密封组克氏原螯虾的存活率仅为59.33%;且其鳃丝有大量附着物,微血管腔结构已完全消失,大部分呼吸上皮细胞脱落、坏死,鳃膜结构遭到破坏。【结论】温度和含氧量是影响克氏原螯虾空运存活率的主要环境因子。模拟空运对克氏原螯虾造成严重损伤且不可逆,在模拟空运结束后克氏原螯虾因自身缺乏修复能力而大量死亡。因此,实际生产中可通过在运输前投喂免疫增强剂,或在运输后优化其暂养环境等方式以提高克氏原螯虾空运存活率,进而确得其引种成功。
关键词:克氏原螯虾;模拟空运;环境因子;生理生化指标;存活率
中圖分类号:S981.21 文献标志码: A 文章编号:2095-1191(2021)10-2896-08
Abstract: 【Objective】 To identify the key environmental factors affecting Procambarus clarkii survival during air transportation and to provide the scientific basis for targeted pre- and post-transport treatments to improve survival rates. 【Method】 The conditions of air transportation were simulated by placing the crayfish in foam boxes under ice-cold conditions with (perforated group) or without (sealed group) ventilation. Real-time monitoring of oxygen content, temperature and relative humidity in the foam box was performed during simulated air transportation. After 18 h of simulation, the serum, hepatopancreas, gill filament and midgut samples were collected and the serum activities of lysozyme, polyphenol oxidase (PPO), superoxide dismutase (SOD) and malondialdehyde (MDA) were determined. Hepatopancreas SOD activity, total antioxidant capacity (T-AOC), MDA content, protein carbonyl content and gill filament Na+K+ -ATPASE activity were used, together with paraffin sections of the hepatopancreas, gill filaments and midgut, to calculate the survival rate of P. clarkii after simulated air transport. 【Result】 During simulated air transport, the relative humidity was not obviously altered, while the changes in temperature and oxygen content were significantly affected and observed to cause stress reactions in P. clarkii. After the simulation, the activities of lysozyme, PPO and MDA in the serum of the sealed group were significantly increased (P<0.05, the same below), while the activities of SOD were significantly decreased. Hepatopancreas protein carbonyl content, MDA content and T-AOC level were significantly higher than those in the perforated and control groups, while SOD activity showed no significant change. The activity of Na+K+-ATP in gill filaments of both the sealed and perforated groups was significantly higher than that of the control group. After simulated air transport for 18 h, the cray-fish survival rate was higher. However, the survival rate of both the sealing and perforated group decreased significantly from the 4th day, and only 59.33% of the sealed group was alive on the 7th day. Most of the respiratory epithelial cells were exfoliated and necrotic, and the branchial membrane structure was destroyed. 【Conclusion】 The changes of temperature and oxygen content are the main environmental factors affecting the survival rate of P. clarkii during air transportation. The simulated air transport caused serious and irreversible damage to P. clarkii and a large number of P. clarkii died after their return to control conditions. Therefore, the survival rate of air-transported P. clarkii can be improved by feeding immune enhancers before transportation or optimizing the environmental conditions following transport to improve recovery rates.
Key words: Procambarus clarkii; simulated air transportation; environmental factors; biochemical indicators; survival rate
Foundation item:Hainan Key Research and Development Project(ZDEF2018027);Central Public-interest Scientific Institution Basal Research Fund for Chinese Academy of Tropical Agricultural Sciences(1630052019013)
0 引言
【研究意义】克氏原螯虾(Procambarus clarkii)又名小龙虾,原产于北美洲,现已发展成为我国淡水虾类中的重要资源(姜爱兰等,2020)。长江中下游地区是目前我国克氏原螯虾养殖的主要集中区,属于亚热带季风性气候,每年10月天气转凉后,克氏原螯虾开始冬眠,直至翌年3月均无新鲜的活虾上市。海南省地处热带地区,其气候条件非常适合克氏原螯虾生长,若能引种成功可有效填补冬春季节克氏原螯虾市场的空白。长途运输是生物活体引种的必经环节,其中以空运所需时间最短、运输应激最小,对引种对象损伤低,是一种理想的引种运输方法。因此,掌握空运过程中克氏原螯虾各项生理生化指标的变化规律,对有效提高克氏原螯虾引种成功率具有重要意义。【前人研究进展】至今,针对甲壳类动物空气暴露及低氧胁迫的研究已有较多报道,且对离水条件下甲壳类动物体内生理生化指标的变化规律有所了解。Rabin等(1996)发现无水干运会引起斑节对虾(Penaeus monodon)肝胰腺的氧化应激及损伤,且影响HSP70蛋白和铁蛋白的表达。Paterson等(1997)研究发现,在将捕捞龙虾干运至母舰的过程中由于水流量下降会迅速降低溶解氧含量,致使龙虾血淋巴当中的乳酸浓度也随之下降。Oliveira等(2001)对三疣梭子蟹(Portunus trituberculatus)进行干露胁迫,结果发现缺氧导致密封组三疣梭子蟹的葡萄糖摄取和糖原合成明显减少,而肝胰腺糖原动员和血淋巴葡萄糖浓度呈上升趋势。de Oliveira等(2005)对中华绒螯蟹(Eriocheir sinensis)进行低氧胁迫时发现,缺氧状态下其体内的过氧化氢酶(CAT)和谷胱甘肽转移酶(GST)活性增强,而超氧化物歧化酶(SOD)活性降低。Zenteno-Savín等(2006)在凡纳滨对虾(P. vannamei)的低氧胁迫研究中发现,缺氧后凡纳滨对虾肝胰腺的脂质过氧化(TBARS)水平高于鳃丝和肌肉,且缺氧恢复会造成其抗氧化能力降低。姜娜等(2014)在三疣梭子蟹的干露胁迫研究中发现,干露胁迫时间对其SOD活性和丙二醛(MDA)含量均无显著影响,但显著影响肝胰脏总抗氧化能力(T-AOC)。段亚飞等(2015)研究表明,经干露胁迫后日本囊对虾(P. japonicus)的谷胱甘肽过氧化物酶(GPx)活性、CAT活性、SOD活性及MDA含量变化显著,可作为日本囊对虾干露胁迫的监测指标。Lu等(2016)在中华绒螯蟹模拟干运过程中发现,干露的中华绒螯蟹在受热应激刺激后,其血淋巴葡萄糖和脂质水平均发生显著变化。连春盈等(2017)通过对脊尾白虾(Exopalaemon carinicauda Holthuis)进行干露胁迫,结果发现密封组脊尾白虾肝胰腺、鳃丝、肌肉的琥珀酸脱氢酶(SDH)和细胞色素氧化酶(CCO)活性均随胁迫时间的延长而降低,而延胡索酸还原酶(FRD)和乳酸脱氢酶(LDH)活性随胁迫时间的延长呈先升高后降低的变化趋势。王海锋等(2019)在对克氏原螯虾进行干露胁迫后发现,密封组克氏原螯虾的T-AOC无显著变化,但CAT活性随胁迫时间的延长逐渐升高,SOD活性显著降低,MDA含量在干露胁迫第24 h达峰值。【本研究切入点】目前,关于水产动物长途运输的研究以鱼类较多,虾蟹类的研究相对较少,要确保存活率必须综合考虑各项生理生化指标参数,包括应激程度及健康状况等因素(Pan et al.,2007;吴佳静等,2016)。克氏原螯虾巨大的市场需求促使其养殖面积不断扩大,而克氏原螯虾引种需通过无水空运来实现,因此探究克氏原螯虾在空运过程中各项生理生化指标的变化规律及运输后的存活率,对有效优化运输环境参数具有重要意义。【拟解决的关键问题】通过监测模拟空运过程中的各项环境因子,以及运输前后克氏原螯虾各项生理生化指标的变化,明确空运过程中影响克氏原螯虾存活率的关键环境因子,为有针对性进行空运前预处理提供科学依据。
1 材料与方法
1. 1 模拟空运
在海南省文昌市苑头镇克氏原螯虾养殖基地,选取规格相近、活力较好的克氏原螯虾(平均体重24.0±0.5 g)。将克氏原螯虾分别装入6个泡沫箱中,每箱100只,泡沫箱内提前放好冰瓶。其中,试验组3个泡沫箱完全密封,打孔组3个泡沫箱打孔透气。泡沫箱中插入氧气测定仪和相对湿度测定仪,进行环境因子实时监测。将泡沫箱置于室內(提前打开空调使室内温度保持在24 ℃,模拟空运货仓环境)进行18 h模拟空运。
1. 2 样品采集
模拟空运前进行0 h取样,以无菌注射器吸入抗凝剂后抽取克氏原螯虾血淋巴液,注入1.5 mL无菌离心管中,2500 r/min离心10 min,收集血清置于新的无菌离心管中并迅速放入液氮,-80 ℃保存备用。同时用无菌手术剪摘取肝胰腺、鳃丝及中肠等组织,装入1.5 mL无菌离心管中放入液氮,-80 ℃保存;取部分肝胰腺、鳃丝和中肠组织放入甲醛固定液中固定,用于制作石蜡切片。模拟空运结束后,打开泡沫箱,统计克氏原螯虾存活率并进行取样(同0 h取样),将剩余克氏原螯虾放入玻璃缸暂养,统计暂养1周后的存活率。
1. 3 测定指标及方法
通过手机实时传送温度、相对湿度及含氧量随时间的变化情况,试验结束后导出数据并绘制折线图。采用南京建成生物工程研究所生产的溶菌酶(LZM)测试盒(A050-1-1)、多酚氧化酶(PPO)测试盒(A136-1-1)、总超氧化物歧化酶(SOD)试剂盒(A001-3-2)、总抗氧化能力(T-AOC)检测试剂盒(比色法,A015-1-2)、微量丙二醛(MDA)测定试剂盒(TBA法,A003-2-2)、蛋白质羰基含量测定试剂盒(紫外比色法,A087-1-2)、超微量Na+K+-ATP酶试剂盒(A070-2-2)分别测定克氏原螯虾血清LZM活性、PPO活性、SOD活性及MDA含量,肝胰腺SOD活性、T-AOC水平、MDA含量及蛋白质羰基含量,以及鳃丝Na+K+-ATP活性。同时,参照温久福等(2019)的方法制作克氏原螯虾肝胰腺、鳃丝及中肠组织石蜡切片,在显微镜下进行观察和拍照。所有试验数据以SPSS 18.0进行整理及单因素方差分析(One-way ANVOA)。
2 结果与分析
2. 1 模拟空运过程中泡沫箱内含氧量的变化趋势
由图1可知,密封组和打孔组泡沫箱内的含氧量均随模拟空运时间的延长而下降。密封组由于完全密封,含氧量下降速率明显高于打孔组;至模拟空运结束后,密封组泡沫箱内的含氧量为5.00%,远低于打孔组的18.30%。由此可见,密封环境很容易造成运输过程中克氏原螯虾缺氧。
2. 2 模拟空运过程中泡沫箱内相对湿度的变化趋势
由图2可知,密封组和打孔组泡沫箱内的相对湿度均随模拟空运时间的延长而上升,且最终的相对湿度达到100.00%左右,二者差异不明显。相对湿度上升可能是由于冰瓶的蒸发及克氏原螯虾的呼吸作用所致。
2. 3 模拟空运过程中泡沫箱内温度的变化趋势
由图3可知,密封组和打孔组泡沫箱内的温度均随模拟空运时间的延长呈先下降后上升的变化趋势,可能与泡沫箱内放置冰瓶有关。前期冰瓶起到降温的作用,但随着模拟空运时间的推移,冰瓶的降温作用逐渐不明显,而导致泡沫箱内温度升高。密封组泡沫箱属于密封环境,其温度变化较剧烈,运输期间温差达7.6 ℃;而打孔组由于打孔透气,受外界环境影响,其总体温差相对不明显,仅为3.4 ℃。
2. 4 模拟空运对克氏原螯虾各项生物酶活性的影响
模拟空运结束后,密封组克氏原螯虾血清LZM活性显著高于打孔组及模拟空运前(P<0.05,下同),而打孔组克氏原螯虾血清LZM活性与模拟空运前相比差异不显著(P>0.05,下同);在血清MDA含量方面,模拟空运前后及密封组与打孔组间的差异均不显著,但以密封组克氏原螯虾的含量最高;密封组克氏原螯虾血清PPO活性显著高于打孔组及模拟空运前,但其SOD活性显著低于打孔组及模拟空运前;打孔组克氏原螯虾血清PPO活性和SOD活性与模拟空运前相比,其差异均不显著(表1)。
模拟空运结束后,密封组克氏原螯虾肝胰腺蛋白质羰基含量和MDA含量均显著高于打孔组及模拟空运前,而打孔组与模拟空运前相比,差异均不显著(表2);密封组克氏原螯虾肝胰腺T-AOC水平显著高于打孔组,且二者又显著高于模拟空运前;克氏原螯虾肝胰腺SOD活性在模拟空运前后的差异不显著,且密封组与打孔组间的差异也不显著。密封组和打孔组克氏原螯虾经模拟空运后,其鳃丝Na+K+-ATP活性均显著高于模拟空运前,但二者差异不显著。
2. 5 模拟空运对克氏原螯虾器官组织结构的影响
2. 5. 1 中肠组织切片观察结果 模拟空运前克氏原螯虾中肠组织上皮层、基膜、结缔组织层、肌肉层和外膜结构完整,上皮被覆单层矮柱状上皮,排列整齐,部分细胞染色较浅;疏松结缔组织层未见明显的细胞坏死和血细胞渗出;基膜、肌层和外膜未见明显病理变化(图4-A)。打孔组克氏原螯虾中肠组织上皮层、基膜、结缔组织层、肌肉层和外膜结构较完整,上皮被覆单层矮柱状上皮,排列较整齐,部分细胞空泡变性,细胞肿大,排列不整齐,总体受损程度低于密封组克氏原螯虾;结缔组织层、基膜、肌层和外膜未见明显病理变化(图4-B)。密封组克氏原螯虾中肠组织上皮层、基膜、结缔组织层、肌肉层和外膜结构较完整,上皮被覆单层矮柱状上皮,部分细胞脱落,略显肿胀,排列紊乱;结缔组织层、基膜、肌层和外膜也未见明显坏死及血细胞渗出等病理变化(图4-C)。
2. 5. 2 肝胰腺组织切片观察结果 模拟空运前克氏原螯虾肝胰腺小管结构正常,基膜完整,管腔清晰,呈星形,B细胞和R细胞分布较均匀,肝细胞内有较多空泡;肝胰腺小管周围间质内主要为疏松结缔组织及丰富的血窦,血窦内主要为颗粒细胞及半颗粒细胞,可见少量血细胞,未见明显血细胞渗出及其他病理变化(图5-A)。打孔组克氏原螯虾肝胰腺小管结构较完整,部分肝细胞肿胀,致使管腔不规则,部分细胞轮廓模糊不清,变性细胞肿大变形,胞质内空泡体积增大,且空泡内出现颗粒样内容物;肝胰腺小管周围间质内可见少量均质红染的蛋白样物质沉积,未见明显血细胞渗出及其他病理變化(图5-B)。密封组克氏原螯虾肝胰腺小管结构较完整,大量肝细胞明显肿大变形,空泡体积显著增大;肝胰腺小管周围间质结构较正常,未见明显血细胞渗出及其他病理变化(图5-C)。
2. 5. 3 鳃丝组织切片观察结果 模拟空运前克氏原螯虾鳃膜结构完整,呼吸细胞排列整齐,能观察到微血管,未见任何病理变化(图6-A)。打孔组克氏原螯虾鳃膜结构较完整,鳃丝出现部分附着物,微血管腔不明显,呼吸上皮细胞排列较整齐,未出现明显的变性坏死现象(图6-B)。密封组克氏原螯虾鳃丝有大量附着物,微血管腔结构已完全消失,大部分呼吸上皮细胞脱落、坏死,鳃膜结构遭到破坏(图6-B)。
2. 6 模拟空运对克氏原螯虾存活率的影响
经模拟空运18 h后,密封组克氏原螯虾的存活率为82.00%,打孔组的存活率为89.00%,二者间的存活率差异不显著。模拟空运后暂养1周发现,无论是密封组还是打孔组,克氏原螯蝦存活率均从第4 d开始显著下降,至暂养第7 d密封组克氏原螯虾的存活率显著低于打孔组(表3)。
3 讨论
水产品鲜活运输包括有水保活运输和无水保活运输2种方式(Skudlarek et al.,2011;吴佳静等,2016)。其中,有水保活运输方式包括净水法、充氧保活法、麻醉保活法和低温保活法;无水保活运输方式包括化学麻醉法及无水生态冰温保活法。目前,关于水产动物长途运输的研究以鱼类较多,而虾蟹类相对较少。宫春光等(2006)研究发现,无水充氧运输过程中将日本对虾密度控制在33.3 kg/m2,其13 h以内的运输存活率均在90.0%以上。边会喜(2010)研究发现,温度在25.0 ℃以下时丁香油麻醉剂对克氏原螯虾的保活效果较好,能有效提高长途运输的存活率。谢慧明等(2010)通过对比几种麻醉剂对克氏原螯虾无水干运的影响,结果发现在25.0~30.0 ℃下存放时经60 mg/L丁香—乙醇水溶液麻醉的克氏原螯虾保活效果最佳,与非麻醉组相比,20 h后的存活率提高9%。任红梅等(2015)在对青虾的模拟无水运输研究中发现,6.0 ℃下运输青虾6 h以内其存活率显著高于相同运输时间其他温度的存活率,均在80.0%以上。梁敏(2018)对凡纳滨对虾进行无水保活研究,结果发现保活时间在8 h内的最佳无水保活处理条件为温度18.2 ℃和pH 6.08,该条件下凡纳滨对虾的存活率高达86.4%。徐子涵(2018)研究表明,将凡纳滨对虾事先在常温充氧海水中暂养6 h,13.0 ℃水浴中冷击3 min,充纯氧包装后15.0 ℃模拟空运12 h,结果发现水低温胁迫会引起凡纳滨对虾的氧化应激反应,进而影响其抗氧化状态,但并未引起难以逆转的损伤。因此,在确保运输存活率的同时应综合考虑各项生理生化指标的变化(Pan et al.,2007;吴佳静等,2016)。
本研究结果表明,经模拟空运后密封组克氏原螯虾血清LZM活性、PPO活性及MDA含量显著升高,而SOD活性显著降低。MDA是反映细胞受损伤程度的重要指标,MDA积累越多,表明细胞受损伤程度越严重(姜冬梅和康波,2020);PPO是氧化酶源激活系统的重要组成部分,在机体应对抗氧化的过程中发挥重要作用;LZM具有抗菌消炎、抗病毒及增强机体免疫力等生理功能,还可激活血小板,改善组织局部血液循环障碍,增强局部防卫功能,具有止血消肿等作用;SOD是生物体内重要的抗氧化酶,能将有害的超氧自由基转化为H2O2,再通过过氧化氢酶(CAT)将H2O2转化为H2O(刘雨等,2019)。本研究的模拟空运也对克氏原螯虾产生一定应激反应,克氏原螯虾通过调节LZM活性和SOD活性以缓解应激带来的影响,其体内MDA含量未出现明显变化可能与这一调节有关。PPO在模拟空运中并未发挥明显的作用,可能是因为应激时间不够长,血清免疫指标尚未发生变化。此外,模拟空运结束后,密封组克氏原螯虾肝胰腺蛋白质羰基含量、MDA含量和T-AOC水平均显著高于打孔组及模拟空运前,而SOD活性变化不显著。蛋白质羰基化是指氨基酸残基侧链中的氨基或亚氨基受到氧自由基攻击,最后转变成醛基并释放NH3+的过程,羰基含量增加是蛋白丧失正常功能甚至被降解的重要原因(周家华等,2020)。说明模拟空运对克氏原螯虾肝胰腺已造成损伤,与组织切片观察到的肝胰腺细胞空泡化相互印证。T-AOC主要包括机体内的抗氧化酶体系和抗氧化物质体系,是衡量机体抗氧化系统功能状况的综合性指标(徐文杰等,2020)。模拟空运结束后,克氏原螯虾肝胰腺T-AOC水平显著提升,而SOD活性变化不显著,说明克氏原螯虾在模拟空运过程中受到胁迫后,其机体通过自身的免疫系统来抵抗应激反应,但SOD并不是主要的调节方式,而是通过别的途径进行调节,因此后续研究宜选择其他抗氧化指标进行检测,如酸性磷酸酶或碱性磷酸酶等。Na+K+-ATP广泛存在于生物体内,可催化腺嘌呤核苷三磷酸(ATP)水解生成二磷酸腺苷(ADP)和无机磷,在离子调节中发挥核心作用,对细胞渗透调节、物质吸收(葡萄糖和氨基酸等)及跨细胞离子运动等至关重要。鳃是克氏原螯虾重要的呼吸器官,直接与外界环境接触,因此其Na+K+-ATP活性能反映细胞主动运输的能力,对判断鳃丝的活力具有重要意义。密封组和打孔组克氏原螯虾经模拟空运18 h后,其鳃丝Na+K+-ATP活性均显著高于模拟空运前,说明克氏原螯虾通过提升Na+K+-ATP活性以应对缺氧胁迫,从而增强鳃组织的工作效率,获取更多氧气。
经18 h模拟空运后,无论是打孔组还是密封组的克氏原螯虾存活率均较高,与王海锋等(2019)对克氏原螯虾空气暴露18 h的存活率相近。说明克氏原螯虾具有较强的抗逆性,能通过自身免疫系统调节应对模拟空运应激,与Demers等(2006)对欧洲原产克氏原螯虾进行低氧胁迫的研究结果相似。但模拟空运后暂养1周发现,密封组和打孔组的克氏原螯虾存活率均从第4 d开始显著下降,至暂养第7 d密封组克氏原螯虾的存活率仅为59.33%,显著低于打孔组克氏原螯虾,未能满足引种对存活率的要求,也说明模拟空运已对克氏原螯虾造成严重损伤且不可逆转。
4 结论
温度和含氧量是影响克氏原螯虾空运存活率的主要环境因子。模拟空运对克氏原螯虾造成严重损伤且不可逆转,在模拟空运结束后克氏原螯虾因自身缺乏修复能力而大量死亡。因此,实际生产中可通过在运输前投喂免疫增强剂,或在运输后优化其暂养环境等方式以提高克氏原螯虾空运存活率,进而确保其引种成功。
参考文献:
边会喜. 2010. 克氏原螯虾远程运输保活技术研究[D]. 合肥:合肥工业大学. [Bian H X. 2010. Study on keep-alive technology of long-tange transportation of crayfish[D]. Hefei:Hefei University of Technology.] doi:10.7666/d.y1700626.
段亚飞,董宏标,王芸,张真真,李卓佳,张家松. 2015. 干露胁迫对日本囊对虾抗氧化酶活性的影响[J]. 南方水产科学,11(4):102-108. [Duan Y F,Dong H B,Wang Y,Zhang Z Z,Li Z J,Zhang J S. 2015. Effect of desiccation on antioxidant enzyme activities of kuruma shrimp(Marsupenaeus japonicus)[J]. South China Fisheries Science,11(4):102-108.] doi:10.3969/j.issn.2095-0780.2015. 04.015.
宮春光,李凤臣,苏利. 2006. 日本对虾活虾冬季运输技术研究[J]. 水产科学,25(6):310-311. [Gong C G,Li F C,Su L. 2006. Transportation of live tiger shrimp(Marsupe-naeus japonicus) in winter[J]. Fisheries Science,25(6):310-311.] doi:10.3969/j.issn.1003-1111.2006.06.011.
姜爱兰,王信海,金倩,王飞飞,王夏雯,张智慧,吴学军,蔺玉华. 2020. 不同底栖饵料对克氏原螯虾生长、消化酶活性、血清生化指标及肌肉营养成分的影响[J]. 江西农业学报,32(1):97-101. [Jiang A L,Wang X H,Jin Q,Wang F F,Wang X W,Zhang Z H,Wu X J,Lin Y H. 2020. Effects of different benthos baits on growth,activities of digestive enzyme,serum biochemical indicators and muscle compositions of Procambarus clarkii[J]. Acta Agriculturae Jiangxi,32(1):97-101.] doi:10.19386/j.cnki.jxnyxb. 2020.01.16.
姜冬梅,康波. 2020. 亚精胺诱导小鼠卵巢组织氧化损伤的作用[J]. 甘肃农业大学学报,55(1):1-6. [Jiang D M,Kang B. 2020. Spermidine induced oxidative damage in ovary of female mouse[J]. Journal of Gansu Agricultural University,55(1):1-6.] doi:10.13432/j.cnki.jgsau.2020.01.001.
姜娜,王芳,路允良,董双林. 2014. 干露对三疣梭子蟹抗氧化和应激能力的影响[J]. 水产学报,38(12):1996-2004. [Jiang N,Wang F,Lu Y L,Dong S L. 2014. Effects of air-exposure stress on antioxidant capacity and stress response of swimming crab (Portunus trituberculatus)[J]. Journal of Fisheries of China,38(12):1996-2004.] doi:10.3724/SP.J.1231.2014.49441.
连春盎,李健,李吉涛,冯艳艳. 2017. 干露胁迫对脊尾白虾(Exopalaemon carinicauda)呼吸代谢相关酶的影响[J]. 渔业科学进展,38(4):53-60. [Lian C A,Li J,Li J T,Feng Y Y. 2017. Effects of dry exposure on the respira-tory metabolism-related enzymes of Exopalaemon carinicauda[J]. Progress in Fishery Sciences,38(4):53-60.] doi:10.11758/yykxjz.20160325001.
梁敏. 2018. 低温与二氧化碳联合胁迫凡纳滨对虾无水保活技术研究[D]. 湛江:广东海洋大学. [Liang M. 2018. Study on the waterless transportation of Litopenaeus vannamei by combined stress of low temperature and carbon dioxide[D]. Zhanjiang:Guangdong Ocean University.]
刘雨,丁炜东,曹哲明,邴旭文,徐畅,杨帆,张晨光,谷心池,孙阿君. 2019. 急性氨氮胁迫对翘嘴鳜幼鱼抗氧化酶活性及炎症反应相关基因表达的影响[J]. 南方农业学报,50(8):1860-1868. [Liu Y,Ding W D,Cao Z M,Bing X W,Xu C,Yang F,Zhang C G,Gu X C,Sun A J. 2019. Effects of acute ammonia nitrogen stress on antioxidant enzymes activity and gene expression involved in inflammation of juvenile Siniperca chuatsi[J]. Journal of Sou-thern Agriculture,50(8):1860-1868.] doi:10.3969/j.issn. 2095-1191.2019.08.29.
任红梅,万玉芳,李雪梅. 2015. 青虾无水低温保活运输初探[J]. 科学养鱼,(5):50-51. [Ren H M,Wan Y F,Li X M. 2015. Preliminary study on anhydrous low temperature transportation of prawns[J]. Scientific Fish Farming,(5):50-51.]
王海锋,成永旭,李京昊,奚业文,李嘉尧. 2019. 干露和再入水对克氏原螯虾抗氧化应激能力的影响[J]. 南方水产科学,15(5):69-76. [Wang H F,Cheng Y X,Li J H,Xi Y W,Li J Y. 2019. Effects of desiccation and resubmersion on oxidative stress response of crayfish(Procambarus clarkii)[J]. South China Fisheries Science,15(5):69-76.] doi:10.12131/20190059.
温久福,蓝军南,周慧,王鹏飞,区又君,李加儿. 2019. 不同盐度对花鲈幼鱼消化器官组织结构的影响[J]. 南方农业学报,50(12):2826-2832. [Wen J F,Lan J N,Zhou H,Wang P F,Ou Y J,Li J E. 2019. Effects of different salinities on histological structure of digestive organs of juvenile Lateolabrax maculatus[J]. Journal of Southern Agriculture,50(12):2826-2832.] doi:10.3969/j.issn.2095- 1191.2019.12.27.
吴佳静,杨悦,许启军,黄宝生,聂小宝. 2016. 水产品保活运输技术研究进展[J]. 农产品加工,(8):55-56. [Wu J J,Yang Y,Xu Q J,Huang B S,Nie X B. 2016. Research progress of aquatic products keep alive transportation technolog[J]. Farm Products Processing,(8):55-56.] doi: 10.16693/j.cnki.1671-9646(X).2016.08.045.
谢慧明,边会喜,杨毅,张文成,林春铭,高香兰. 2010. 克氏原螯虾麻醉保活技术研究[J]. 食品科学,31(12):247-250. [Xie H M,Bian H X,Yang Y,Zhang W C,Lin C M,Gao X L. 2010. Clove oil anesthesia for the improvement of survival rate of crayfish[J]. Food Science,31(12):247-250.]
徐文杰,韩士群,周庆,巫佳杰,陈婷. 2020. 饲料中添加抗氧化剂对鲫鱼抵抗藻毒素作用的影响[J]. 江苏农业学报,36(2):417-422. [Xu W J,Han S Q,Zhou Q,Wu J J,Chen T. 2020. Effect of dietary antioxidant on microcystin-induced toxicosis in crucian[J]. Jiangsu Journal of Agricultural Sciences,36(2):417-422.] doi:10.3969/j.issn. 1000-4440.2020.02.023.
徐子涵. 2018. 南美白对虾的无水低溫胁迫响应和无水保活运输装置[D]. 杭州:浙江大学. [Xu Z H. 2018. The response of Penaeus vannamei to waterless and low temperature stress and equipment for waterless transportation[D]. Hangzhou:Zhejiang University.]
周家华,秦洪强,叶明亮. 2020. 羰基化蛋白质组学分析进展[J]. 分析测试学报,39(1):82-88. [Zhou J H,Qin H Q,Ye M L. 2020. Progress in proteomic analysis of protein carbonylation[J]. Journal of Instrumental Analysis,39(1):82-88.] doi:10.3969/j.issn.1004-4957.2020.01.011.
de Oliveira U O,da Rosa Araújo A S,Belló-Klein A,da Silva R S M,Kucharski L C. 2005. Effects of environmental anoxia and different periods of reoxygenation on oxidative balance in gills of the estuarine crab Chasmagnathus granulata[J]. Comparative Biochemistry & Physiology. Part B:Biochemistry & Molecular Biology,140(1):51-57. doi:10.1016/j.cbpc.2004.09.026.
Demers A,Souty-Grosset C,Trouilhé M C,Füreder L,Renai B,Gherardi F. 2006. Tolerance of three European native species of crayfish to hypoxia[J]. Hydrobiologia,560:425-432. doi:10.1007/s10750-005-1466-9.
Lu Y L,Wang F,Li L,Dong S L. 2016. Responses of metabolism and haemolymph ions of swimming crab Portunus trituberculatus to thermal stresses:A comparative study between air and water[J]. Aquaculture Research,47(9):2989-3000. doi:10.1111/are.12752.
Oliveira G,Rossi I,da Silva R. 2001. Carbohydrate metabolism during anoxia and post-anoxia recovery in Chasmagnathus granulata crabs maintained on high-protein or carbohydrate-rich diets[J]. Marine Biology,139:335-342. doi:10.1007/s002270100569.
Pan L Q,Zhang L J,Liu H Y. 2007. Effects of salinity and pH on ion-transport enzyme activities,survival and growth of Litopenaeus vannamei postlarvae[J]. Aquaculture,273(4):711-720. doi:10.1016/j.aquaculture.2007.07.218.
Paterson B D,Grauf S G,Smith R A. 1997. Haemolymph chemistry of tropical rock lobsters (Panulirus ornatus) brought onto a mother ship from a catching dinghy in Torres Strait[J]. Marine and Freshwater Research,48(8):835-838. doi:10.1071/MF97069.
Rabin O,Piciotti M,Drieu K,Bourre J M,Roux F. 1996. Effect of anoxia and reoxygenation on antioxidant enzyme activities in immortalized brain endothelial cells[J]. In Vitro Cellular & Developmental Biology,32(4):221-224. doi:10.1007/BF02722949.
Skudlarek J G,Coyle S D,Bright L A,Tidwell J H. 2011. Effect of holding and packing conditions on hemolymph parameters of freshwater prawns,Macrobrachium rosenbergii,during simulated waterless transport[J]. Journal of the World Aquaculture Society,42(5):603-617. doi:10. 1111/j.1749-7345.2011.00508.x.
Zenteno-Savín T,Saldierna R,Ahuejote-Sandoval M. 2006. Superoxide radical production in response to environmental hypoxia in cultured shrimp[J]. Comparative Bioche-mistry and Physiology. Part C:Toxicology & Pharmaco-logy,142(3-4):301-308. doi:10.1016/j.cbpc.2005.11.001.
(責任编辑 兰宗宝)
