努比亚山羊KISS1基因多态性与繁殖性状的关联分析
2021-02-09胡艳张叁保张瑜高小童江雨航申玉建韦英明蒋钦杨
胡艳 张叁保 张瑜 高小童 江雨航 申玉建 韦英明 蒋钦杨



摘要:【目的】明确转移抑制素基因(KISS1)多态性与努比亚山羊繁殖性状(产羔数、初生重和断奶重)的关联,为进一步展开山羊分子标记辅助选择育种提供参考依据。【方法】利用DNA混合池结合Sanger测序筛选出努比亚山羊KISS1基因SNP位点,再通过MTA-Seq测序对355只努比亚山羊群体进行SNP位点的基因分型,并采用SAS 9.2的一般线性模型(GLM)对KISS1基因SNP位点与努比亚山羊的产羔表型性状进行关联分析。【结果】在努比亚山羊KISS1基因内含子1发现2个SNP位点(g.1341600A>G和g.1341674C>G)。其中,g.1341600A>G位点处于中度多态(0.25<PIC<0.50),且处于Hardy-Weinberg平衡状态(PHWE>0.05);而g.1341674C>G位点处于低度多态(PIC<0.25),已偏离Hardy-Weinberg平衡状态(PHWE<0.05)。g.1341600A>G位点GG和AG基因型个体的第一胎、第二胎及三胎联合产羔数均高于AA基因型个体, 且在第一胎达显著水平(P<0.05,下同);g.1341674C>G位点CC基因型个体则表现为第一胎、第三胎及三胎联合产羔数均高于GG基因型个体,同样在第一胎达显著水平。g.1341674C>G位点GG基因型个体的第一胎、第三胎及三胎联合羔羊初生重均高于CC基因型个体,且在第三胎达显著水平;g.1341600A>G位点不同基因型与努比亚山羊各胎次羔羊初生重无显著关联(P>0.05,下同)。在羔羊断奶重方面,2个SNP位点不同基因型与努比亚山羊各胎次断奶重也無显著关联。g.1341600A>G位点和g.1341674C>G位点可形成连锁不平衡单倍型模块,其中GC、AC、AG单倍型的频率分别为0.645、0.265和0.090;单倍型模块与第一胎产羔数显著关联,AACC组合型产羔数显著低于其他组合型。【结论】努比亚山羊KISS1基因内含子1存在2个SNP位点(g.1341600A>G和g.1341674C>G)与其繁殖性状相关,其中g.1341600A>G位点的A等位基因和g.1341674C>G位点的C等位基因可作为努比亚山羊选育的潜在分子标记,且在今后的育种过程中应淘汰KISS1基因AACC组合型母羊。
关键词:努比亚山羊;KISS1基因;SNP位点;产羔数;初生重;断奶重
中图分类号:S827.89 文献标志码: A 文章编号:2095-1191(2021)10-2880-07
Abstract:【Objective】Clarifying the relationship between transfer inhibin gene (KISS1) polymorphism and reproductive traits (litter size, birth weight and weaning weight) in Nubian goats, so as to provide reference basis for further molecular marker assisted selection breeding of goats. 【Method】 In this study, the SNP sites of KISS1 gene in Nubian goats were screened by DNA mixing pool and Sanger sequencing. Then 355 Nubian goats were genotyped by MTA-Seq sequencing. The association between SNP sites of KISS1 gene and lambing phenotypic traits of Nubian goats was analyzed by SAS 9.2 general linear model (GLM).【Result】The results showed that two SNP of g.1341600A>G and g.1341674C>G were found in KISS1 gene intron. Population genetic analysis showed that the g.1341600A>G locus was moderately polymorphic (0.25<P<0.50), and the test showed that the g.1341600A>G locus was in Hardy-Weinberg equilibrium (PHWE>0.05), while the g.1341674C>G site was low polymorphism (PIC<0.25), and test showed that the g.1341600A>G locus was not in Hardy-Weinberg equilibrium (PHWE<0.05).Association analysis showed that at g.1341600A>G locus, the first, second and total parity litter size of GG and AG genotypes were higher than those of AA genotypes and reached significant level at the first parity litter size(P<0.05, the same below). At g.1341674C>G locus, the first , third and total parity litter size of CC genotypes were higher than those of GG genotypes and reached significant level at the first parity litter size.At g.1341674C>G locus, the first, third parity and total parity birth weight of GG genotypes were higher than those of CC genotypes, and reached significant level at the third parity birth weight.There was no significant difference among different genotypes of Nubian goats in diverse parities birth weight at g.1341600A>G(P>0.05, the same below). There was no significant difference among different genotypes of Nubian goats in diverse parities weaning weight at g.1341600A>G and g.1341674C>G.The results of linkage disequilibrium and haplotype analysis showed that g.1341600 C>G locus and g.1341674C>G locus could form linkage disequilibrium module, and the frequencies of GC, AC and AG were 0.645, 0.265 and 0.090, respectively. The correlation analysis between haplotype combination and reproductive traitsshowed that there was a significant correlation between haplotype combination and the first parity litter size, and the litter size of AACC was significantly lower than those of other genotypes.【Conclusion】There are two SNP loci in KISS1 gene intron (g.1341600A>G and g.1341674C>G), which are related to their reproductive traits in Nubian goats. The A allele of g.1341600A>G and the C allele of g.1341674C>G can be used as potential molecular markers for Nubian goat breeding, and the AACC combination ewes of KISS1 gene should be eliminated in the breeding process in the future.
Key words:Nubian goat; KISS1gene; SNP locus; litter size; birth weight; weaning weight
Foundation item:Guangxi Key Research and Development Plan (Guike AB18221067,Guike AB19245010);Guangxi Cattle and Sheep Industry Innovation Team Construction Project (nycytxgxcxtd-2021-09)
0 引言
【研究意义】山羊繁殖性状遗传力较低,采用常规育种方法很难在短时间内实现高效率的品种改良。转移抑制素(Kisspeptins,KISS1)被认为是哺乳动物生殖分子机制的关键调控因子,KISS1基因编码产物Kisspeptin是G蛋白偶联受体54(GPR54)内源性受体,能与GPR54特异性结合组成KISS1/GPR54系统(Ohtaki et al.,2001;彭晓利,2018),参与下丘脑—垂体—性腺(HPG)轴的调控,通过促性腺激素释放激素(GnRH)调节促卵泡生成素(FSH)和促黄体生成素(LH)的分泌水平,进而调控哺乳动物的繁殖性状(秦津等,2011;刘海斌等,2019;徐唯嘉和王家宏,2019)。因此,分析KISS1基因在哺乳动物季节性繁殖中的作用及其多态性,对有效筛选出繁殖性状相关分子标记应用于辅助育种具有重要意义。【前人研究进展】目前,针对KISS1基因的研究主要集中在动物机体初情期启动(金慧慧等,2015)及其季节性繁殖(安雪姣等,2019)等方面。KISS1基因在机体内广泛表达,以在胎盘和睾丸等性腺组织中的表达量较高(Tena-Sempere,2006)。有研究表明,KISS1基因突变或缺失后人类或小鼠的性腺功能退化,而导致其繁殖性能丧失(de Roux et al.,2003;de Tassigny,2007)。Cao等(2010)研究發现,济宁青山羊KISS1基因内含子1存在3处突变(G269、G454和T505A),内含子2则存在18 bp的插入缺失片段,均对产羔数有显著影响。Hou等(2011)以西农萨能、关中山羊和波尔山羊为研究对象,发现KISS1基因内含子2存在T2643C突变及8 bp的缺失片段(AGTTCCCC),且均与产羔数相关。An等(2013)在分析西农萨能、关中山羊和波尔山羊的KISS1基因多态性时发现,有4个多态性位点(SNP)与其产仔数相关。李隐侠等(2014)在130只苏淮山羊群体发现2个KISS1基因SNP位点,其中g.2270C>;T位点与产羔数相关。Maritra等(2014)对印度山羊KISS1基因多态性进行检测分析,结果发现有3个SNP位点与产羔数相关。金慧慧(2015)将猪源KISS1基因转移至小鼠体内后,可在小鼠下丘脑内表达,且转基因小鼠窝产仔数高于野生型小鼠,故推测KISS1基因与小鼠产仔数有关。陈祥等(2018)研究黔北麻羊KISS1基因多态性时发现,在其内含子1检测到3个SNP位点,其中G277C位点和T486A位点与产羔数存在关联性。【本研究切入点】努比亚山羊具有性情温驯、羊膻味低、肉质口感好及繁殖力强等优点,可作为杂交父本用于改良本地山羊品种。广西是山羊传统养殖区,年出栏肉羊超过200万只,努比亚山羊作为引进品种已在全区广泛养殖并用于本地山羊的品种改良(蒋小刚等,2011;颜灿健等,2018),但至今鲜见有关努比亚山羊繁殖性状的研究报道。【拟解决的关键问题】以努比亚山羊为研究对象,利用DNA混合池法筛选KISS1基因SNP位点,并通过多重PCR测序进行SNP分型检测,旨在明确KISS1基因多态性与努比亚山羊繁殖性状(产羔数、初生重和断奶重)的关联,为进一步展开山羊分子标记辅助选择育种提供参考依据。
1 材料与方法
1. 1 试验材料
选择有产羔记录(包括产羔数、初生重和断奶重)的努比亚山羊355只,其中,227只来自广西扶绥广羊农牧有限公司,128只来自广西武鸣种羊场,饲养管理条件一致。从颈静脉采集5 mL血液样品,放入含抗凝剂的真空采血管中,低温运回实验室,-20 ℃保存备用。全血基因组DNA提取试剂盒及其Marker购自天根生化科技(北京)有限公司;PCR扩增试剂盒购自南京诺唯赞生物科技股份有限公司。主要仪器设备有核酸凝胶成像仪(美国Bio-Rad公司)、PCR仪(Applide Biosystems,美国Bio-Rad公司)及核酸浓缩仪(美国Scientist公司)等。
1. 2 DNA提取
采用全血基因组DNA提取试剂盒从努比亚山羊血液提取基因组DNA,紫外分光光度计测定260和280 nm处的OD以检测DNA质量,并利用0.8%琼脂糖凝胶电泳检测其完整性。然后将部分DNA浓度调至50 ng/μL,用于构建DNA混合池,剩余DNA置于-20 ℃冰箱保存备用。
1. 3 引物设计与合成
参照An等(2013)、李鹏程(2017)的方法设计PCR扩增引物,预期产物长度为377 bp,委托生工生物工程(上海)股份有限公司合成。其中,P1引物对(F:5'-CCCGCTGTAACTAGAGAAAG-3';R:5'-CA TCCAGGGTGAGTGATACT-3')用于DNA混合池SNP检测;P2引物对(F:5'-GTCTCATCCAGGGTGAGT GATA-3';R:5'-GCTCTTTCTGGGTAAGGGAGGAT-3')P2用于MTA-Seq基因分型。
1. 4 PCR扩增
PCR反应体系及其扩增程序参照邹辉等(2019)的方法。
1. 5 Sanger测序及基因分型
从355管的DNA中随机选取150个样组成3个混合池,50个样/池,分别从每组50管DNA样品中取出0.5 μL,使每组样品分别在3个离心管中混合均匀,获得3个混合池用于扩增特异性片段,经1.5%琼脂糖凝胶电泳检测达到预期要求后,送至生工生物工程(上海)股份有限公司进行Sanger测序。经序列比对分析和文献查阅总结,将DNA混合池检测到的SNP位点与已报道的产羔性状相关基因SNP位点进行汇总,根据多态性位点上、下游100 bp碱基序列设计多重PCR组合引物,检测所有SNP位点,然后送至生工生物工程(上海)股份有限公司进行MTA-Seq基因分型。
1. 6 统计分析
使用Excel 2013统计努比亚山羊KISS1基因SNP位点的基因型频率、等位基因频率、多态信息含量(PIC)、群体纯合度(Ho)、群体杂合度(He)及有效等位基因数(Ne),并进行Hardy-Weinberg平衡检测。利用SAS 9.2的一般线性模型(GLM)对KISS1基因SNP位点与产羔表型性状进行关联分析,GLM模型如下:
Yijl = μ+Gi+Lj+Pl+eijl
式中,Yijl为产羔数,[μ]为总体均值,Gi为基因型效应,Lj为场次效应,Pl为胎次效应,eijl为随机残差效应。由于山羊繁殖性状(产羔数、初生重和断奶重)是由微效多基因决定,故选用Haploview 4.2对2个SNP位点与繁殖性状间进行连锁不平衡和单倍型分析。
2 结果与分析
2. 1 努比亚山羊KISS1基因SNP位点筛选结果
提取的努比亚山羊血液基因组DNA经检测,其浓度和纯度均符合要求,条带清晰单一,无任何杂带(图1),可供后续试验使用。以提取的努比亚山羊血液基因组DNA为模板,PCR扩增获得的KISS1基因片段经1.5%琼脂糖凝胶电泳检测,其目的片段大小(377 bp)与预期结果相符(图2)。
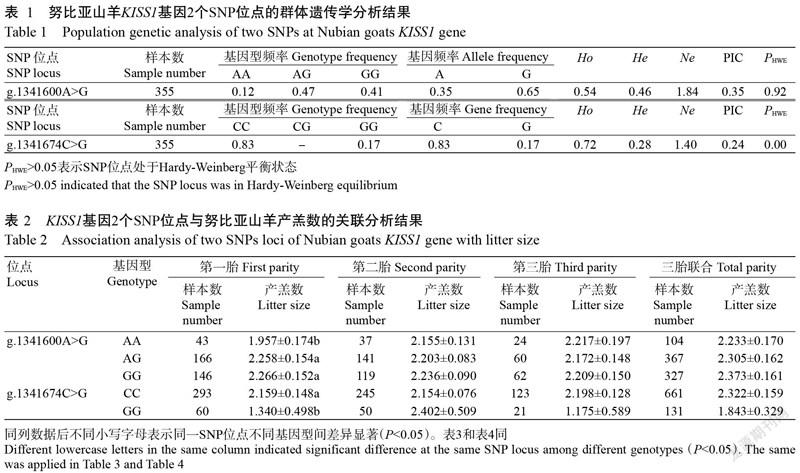
将DNA混合池PCR扩增产物送至生工生物工程(上海)股份有限公司进行测序,经BLAST比对分析,结果发现在努比亚山羊KISS1基因内含子1存在1處突变位点g.1341674C>G(图3)。此外,通过多重PCR测序在KISS 1基因内含子1找出另一个SNP位点g.1341600A>G。
2. 2 努比亚山羊KISS1基因SNP位点的群体遗传学分析结果
群体遗传学分析结果(表1)表明,努比亚山羊KISS1基因在g.1341600A>G位点的A、G等位基因频率分别为0.35和0.65,其中G为优势等位基因;AA、AG、GG基因型频率分别为0.12、0.47和0.41,其中AG基因型为优势基因型。努比亚山羊KISS1基因在g.1341674C>G位点的C、G等位基因频率分别为0.83和0.17,其中C为优势等位基因;CC、GG基因型频率分别为0.83和0.17,以CC基因型为优势基因型;该位点未见CG基因型,可能是由于CG基因型卵泡发育受阻或卵巢内无初级卵泡卵母细胞发育,且其卵泡周围颗粒细胞发育异常或突变杂合子导致子宫和卵巢发育不全,从而导致机体不育。此外,g.1341600 A>G位点处于中度多态(0.25<PIC<0.50),χ2适应性检验结果表明该位点处于Hardy-Weinberg平衡状态(PHWE>0.05);而g.1341674C>G位点处于低度多态(PIC<0.25),χ2适应性检验结果表明该位点已偏离Hardy-Weinberg平衡状态(PHWE<0.05)。
2. 3 KISS1基因多态性与努比亚山羊繁殖性状间的关联性
在产羔数(表2)方面,g.1341600A>G位点GG和AG基因型努比亚山羊个体的第一胎、第二胎及三胎联合产羔数均高于AA基因型个体,且在第一胎达显著水平(P<0.05,下同);g.1341674C>G位点CC基因型个体则表现为第一胎、第三胎及三胎联合产羔数均高于GG基因型个体,同样在第一胎达显著水平。在羔羊初生重(表3)方面,g.1341674C>G位点GG基因型个体的第一胎、第三胎及三胎联合羔羊初生重均高于CC基因个体型,其中第三胎达显著水平;g.1341600A>G位点不同基因型与努比亚山羊各胎次羔羊初生重无显著关联(P>0.05,下同)。在羔羊断奶重(表4)方面,2个SNP位点不同基因型与努比亚山羊各胎次断奶重也无显著关联。
2. 4 努比亚山羊KISS1基因SNP位点连锁不平衡及单倍型分析结果
SNP位点连锁不平衡及单倍型分析结果表明,g.1341600A>G位点和g.1341674C>G位点可形成1个连锁不平衡单倍型模块(图4),其中GC、AC、AG单倍型的频率分别为0.645、0.265和0.090。将单倍型模块与努比亚山羊繁殖性状(产羔数、初生重和断奶重)进行关联分析,结果发现与第一胎产羔数显著关联,AACC组合型产羔数显著低于其他组合型(表5);而与初生重和断奶重的关联均未达显著水平。
3 讨论
内含子虽然不编码蛋白,无法对蛋白的结构产生影响,但其变异对转录和剪切过程均产生影响,通过控制基因表达来调控动物表型(田志龙等,2019)。至今,有关内含子变异影响动物繁殖性状的研究已有较多报道。E1-Tarabany等(2017)研究发现,在KISS1基因内含子1的第121位碱基处存在T→A现象,并证实该突变位点与大马士革羊产羔数相关。陈祥等(2018)研究表明,黔北麻羊KISS1基因内含子1的2个SNP位点致使其mRNA表达存在差异,进而导致产羔数显著增加。Hui等(2020)在陕北绒山羊DNMT3B基因内含子22上发现1个11 bp的插入突变,并证实该突变位点与第一胎产羔数显著相关。本研究在努比亚山羊KISS1基因内含子1发现2个SNP位点(g.1341600A>G和g.1341674C>G),χ[2]适应性检验结果表明,g.1341600A>G位点处于Hardy-Weinberg平衡状态,即该位点在适应性方面具有一定优势;而g.1341674C>G位点已偏离Hardy-Weinberg平衡状态,推测该位点是日常饲养过程中人为干预力度较大的结果,也有可能是试验样本数量太少所致。
本研究的關联分析结果表明,g.1341600A>G位点GG和AG基因型个体的第一胎、第二胎及三胎联合产羔数均高于AA基因型个体,且在第一胎达显著水平。值得注意的是,g.1341600A>G位点突变纯合型产羔数大多高于野生纯合型,从而推测优势等位基因(G)在一定程度上提高了努比亚山羊的产羔能力,与陈祥等(2018)的研究结论一致,也进一步证实g.1341600A>G位点与努比亚山羊繁殖性状显著相关。g.1341674C>G位点CC基因型个体的产羔数在第一胎、第三胎及三胎联合均高于GG基因型个体,同样在第一胎达显著水平,但g.1341674C>G位点野生纯合型产羔数大多高于突变纯合型,故推测优势等位基因(C)在一定程度上提高了努比亚山羊的产羔能力,与An等(2013)的研究结果一致,说明g.1341674A>G位点与努比亚山羊繁殖性状显著相关。
初生重能放映羊羔胚胎时期的营养水平,代表羊羔的先天素质;断奶重则体现出羊羔在哺乳期的营养水平、生长发育情况及今后的成长潜力。可见,除产羔数外,初生重和断奶重也是影响山羊养殖业收益的重要繁殖性状。杜建文等(2020)研究表明,母羊每胎产羔数越多,其羔羊的初生重越轻。本研究中,g.1341674C>G位点GG基因型个体的羔羊初生重在第一胎、第三胎及三胎联合均高于CC基因型个体,且在第三胎达显著水平,可能是由于GG基因型产羔数少,胎儿对母体营养物质的竞争小,平均每只羔羊从母体内吸收的营养较多,与张磊等(2020)的研究结论一致;而g.1341600A>G位点不同基因型与努比亚山羊各胎次羔羊初生重无显著关联。g.1341600A>G位点和g.1341674C>G位点的不同基因型与努比亚山羊各胎次断奶重也无显著关联,即这2个SNP位点不适合作为努比亚山羊断奶重改良的分子标记。此外,单倍型模块与努比亚山羊繁殖性状(产羔数、初生重和断奶重)的关联分析发现,单倍型模块与第一胎产羔数显著关联,AACC组合型产羔数显著低于其他组合型,因此在今后的育种过程中应淘汰AACC组合型母羊。
4 结论
努比亚山羊KISS1基因肉含子1存在2个SNP位点(g.1341600A>G和g.1341674C>G)与其繁殖性状相关,其中g.1341600A>G位点的A等位基因和g.1341674C>G位点的C等位基因可作为努比亚山羊选育的潜在分子标记,且在今后的育种过程中应淘汰KISS1基因AACC组合型母羊。
参考文献:
安雪姣,赵生国,潘章源,文禹粱,田志龙,蔡原,储明星. 2019. 绵羊KISS1基因组织表达及其多态性与产羔数关联分析[J]. 中国畜牧杂志,55(6):45-50. [An X J,Zhao S G,Pan Z Y,Wen Y L,Tian Z L,Cai Y,Chu M X. 2019. Tissue expression and polymorphism of sheep KISS1 gene and their association with litter size[J]. Chinese Journal of Animal Science,55(6):45-50.] doi:10.19556/j. 0258-7033.2019-06-045.
陈祥,李鹏程,孙振梅,许厚强,陈伟. 2018. 黔北麻羊KISS1基因多态性及组织差异表达研究[J]. 农业生物技术学报,26(7):1213-1218. [Chen X,Li P C,Sun Z M,Xu H Q,Chen W. 2018. Study on polymorphism and tissue diffe-rential expression of KISS1 gene in Qianbei Ma goats (Capra hircus)[J]. Journal of Agricultural Biotechnology,26(7):1213-1218.] doi:10.3969/j.issn.1674-7968.2018. 07.013.
杜建文,谭世新,田月珍,付雪峰,徐新明,李红燕,许建标,胥磊,杨雪梅,黄锡霞,田可川. 2020. 影响不同品种羔羊初生重的因素分析[J]. 家畜生态学报,41(8):33-36. [Du J W,Tan S X,Tian Y Z,Fu X F,Xu X M,Li H Y,Xu J B,Xu L,Yang X M,Huang X X,Tian K C. 2020. Factors influencing the birth weight of different breeds of lambs[J]. Acta Ecologae Animalis Domastici,41(8):33-36.] doi:10.3969/j.issn.1673-1182.2020.08.006.
蒋小刚,韦锦益,磨勤,周恒,蒋玉秀. 2011. 努比亚山羊引种饲养观察报告[J]. 广西畜牧兽医,27(5):300-301. [Jiang X G,Wei J Y,Mo Q,Zhou H,Jiang Y X. 2011. Observation report on introduction and breeding of Nubian goat in 2011[J]. Guangxi Journal of Animal Husbandry & Veterinary Medicine,27(5):300-301.] doi:10.3969/j.issn.1002-5235.2011.05.023.
金慧慧,刘秋月,狄冉,胡文萍,王翔宇,储明星. 2015. Kiss1基因调控哺乳动物繁殖性能的研究进展[J]. 家畜生态学报,36(8):1-6. [Jin H H,Liu Q Y,Di R,Hu W P,Wang X Y,Chu M X. 2015. Research progress on reproduction regulation of Kiss1 gene in mammals[J]. Acta Ecologae Animalis Domastici,36(8):1-6.] doi:10.3969/j.issn.1673-1182.2015.08.001.
金慧慧. 2015. 轉猪FSHR和KISS1基因小鼠繁殖性能分析[D]. 重庆:西南大学. [Jin H H. 2015. Evaluation the reproductive performance of porcine KISS1 and FSHR transgenic mice[D]. Chongqing:Southwest University.]
李鹏程. 2017. ESR、KISS-1、PGR基因mRNA表达及多态性与黔北麻羊产羔性状相关性分析[D]. 贵阳:贵州大学. [Li P C. 2017. Correlation analysis between polymorphism of ESR,KISS-1,PGR and litter size of Qianbei Ma goat and their mRNA expressio level testing[D]. Guiyang:Guizhou University.]
李隐侠,张俊,钱勇,李静心,孟春花,王慧利,钟声,曹少先. 2014. Kiss-1基因多态性与苏淮山羊产羔数的关联分析[J]. 畜牧兽医学报,45(12):1917-1923. [Li Y X,Zhang J,Qian Y,Li J X,Meng C H,Wang H L,Zhong S,Cao S X. 2014. Kiss-1 gene polymorphisms and its association with litter sizes in Suhuai goats[J]. Acta Veterinaria et Zootechnica Sinica,45(12):1917-1923.] doi:10.11843/j.issn.0366-6964.2014.12.002.
刘海斌,吴占福,张立永,官丽辉,陈宝江,胡满. 2019. 光照强度对Kisspeptin及其受体GPR54在鸡脑表达的影响[J]. 中国兽医学报,39(3):497-506. [Liu H B,Wu Z F,Zhang L Y,Guan L H,Chen B J,Hu M. 2019. Effect of light intensity on expression of Kisspeptin and GPR54 in brain of hens[J]. Chinese Journal of Veterinary Science,39(3):497-506.] doi:10.16303/j.cnki.1005-4545.2019. 03.21.
彭晓利. 2018. KISS1/GPR54系统在山羊睾丸间质细胞自分泌的功能研究[D]. 重庆:西南大学. [Peng X L. 2018. The self-secretory function of KISS1/GPR54 in goat leying cells[D]. Chongqing:Southwest University.]
秦津,李瑞明,凌泽继,谢莹雪,宋小白,杨柄壮,许典新. 2011. 促性腺激素释放激素在不同品种水牛卵巢中的免疫组化定位[J]. 南方农业学报,42(1):90-93. [Qin J,Li R M,Ling Z J,Xie Y X,Song X B,Yang B Z,Xu D X. 2011. Immuno-histochemical localization of gonadotropin-releasing hormone in ovaries of different buffalo varieties[J]. Journal of Southern Agriculture,42(1):90-93.] doi:10.3969/j.issn.2095-1191.2011.01.021.
田志龙,汤继顺,孙庆,王玉琴,张效生,张金龙,储明星. 2019. 绵羊SMAD1基因组织表达及其多态性与产羔数关联分析[J]. 中国农业科学,52(4):755-766. [Tian Z L,Tang J S,Sun Q,Wang Y Q,Zhang X S,Zhang J L,Chu M X. 2019. Tissue expression and polymorphism of sheep SMAD1 gene and their association with litter size[J]. Scientia Agricultura Sinica,52(4):755-766.] doi:10.3864/j.issn.0578-1752.2019.04.015.
徐唯嘉,王家宏. 2019. KISS-1基因相关研究进展[J]. 系统医学,4(1):192-195. [Xu W J,Wang J H. 2019. Research progress of KISS-1 gene related study[J]. Systems Medicine,4(1):192-195.] doi:10.3969/j.issn.2096-1782. 2019.01.072.
颜灿健,张伟,黄兰珍,朱志旅,陈子良,杨膺白. 2018. 广西山羊养殖模式及效果探讨[J]. 广西畜牧兽医,34(2):96-98. [Yan C J,Zhang W,Huang L Z,Zhu Z L,Chen Z L,Yang Y B. 2018. Discussion on goat breeding mode and effect in Guangxi[J]. Guangxi Journal of Animal Husbandry & Veterinary Medicine,34(2):96-98.] doi:10. 3969/j.issn.1002-5235.2018.02.015.
张磊,乔为盛,白前前,宋宇轩,周占琴. 2020. 湖羊胎产羔数对羔羊生长发育的影响[J]. 家畜生态学报,41(4):43-46. [Zhang L,Qiao W S,Bai Q Q,Song Y X,Zhou Z Q. 2020. Effects of lambing number on the growth and development of lambs in Hu sheep[J]. Acta Ecologae Animalis Domastici,41(4):43-46.] doi:10.3969/j.issn.1673-1182.2020.04.008.
邹辉,瞿秋红,夏琴,崔悦悦,江雨航,韦玲静,严雪瑜,蒋钦杨,韦英明. 2019. 努比亚山羊BMPR-IB基因多态性与其产羔性状的关联分析[J]. 南方农业学报,50(4):860-866. [Zou H,Qu Q H,Xia Q,Cui Y Y,Jiang Y H,Wei L J,Yan X Y,Jiang Q Y,Wei Y M. 2019. Correlation ana-lysis between Nubian goats BMPR-IB gene polymorphism and its lambing traits[J]. Journal of Southern Agriculture,50(4):860-866.] doi:10.3969/j.issn.2095-1191. 2019.04.25
An X P,Han P,Hou J X,Zhao H B,Yan Y,Ma T,Fang F,Meng F X,Song Y X,Wang J G,Cao B Y. 2013. Mole-cular cloning and characterization of KISS1 promoter and effect of KISS1 gene mutations on litter size in the goat[J]. Genetics and Molecular Research,12(4):4308-4316. doi:10.4238/2013.February.28.13.
Cao G L,Chu M X,Fang L,Di R,Feng T,Li N. 2010. Analysis on DNA sequence of KiSS-1 gene and its association with litter size in goats[J]. Molecular Biology Reports,37(8):3921-3929. doi:10.1007/s11033-010-0049-7.
de Roux N,Genin E,Carel J C,Matsuda F,Chaussain J L,Milgrom E. 2003. Hypogonadotropic hypogonadism due to loss of function of the KiSS1-derived peptide receptor GPR54[J]. Proceedings of the National Academy of Scien-ces of the United States of America,100(19):10972-10976. doi:10.1073/pnas.1834399100.
de Tassigny X A,Fagg L A,Dixon J P C,Day K,Leitch H G,Hendrick A G,Zahn D,Franceschini I,Caraty A,Carlton M B L,Aparicio S A J R,Colledge W H. 2007. Hypogonadotropic hypogonadism in mice lacking a functional Kiss1 gene[J]. Proceedings of the National Academy of Sciences of the United States of America,104(25):10714-10719. doi:10.1073/pnas.0704114104.
El-Tarabany M S,Zaglool A W,El-Tarabany A A,Awad A. 2017. Association analysis of polymorphism in KiSS1 gene with reproductive traits in goats[J]. Animal Reproduction Science,180:92-99. doi:10.1016/j.anireprosci. 2017.03.006.
Hou J X,An X P,Wang J G,Song Y X,Cui Y H,Wang Y F,Chen Q J,Cao B Y. 2011. New genetic polymorphisms of KiSS-1 gene and their association with litter size in goats[J]. Small Ruminant Research,96(2-3):106-110. doi:10.1016/j.smallrumres.2010.11.013.
Hui Y Q,Zhang Y H,Wang K,Pan C Y,Chen H,Qu L,Song X Y,Lan X Y. 2020. Goat DNMT3B:An indel mutation detection,association analysis with litter size and mRNA expression in gonads[J]. Theriogenology,147:108-115. doi:10.1016/j.theriogenology.2020.02.025.
Maitra A,Sharma R,Ahlawat S,Tantia M S,Roy M,Prakash V. 2014. Association analysis of polymorphisms in caprine KiSS1 gene with reproductive traits[J]. Animal Reproduction Science,151(1-2):71-77. doi:10.1016/j.anireprosci.2014.09.013.
Ohtaki T,Shintani Y,Honda S,Matsumoto H,Hori A,Kanehashi K,Terao Y,Kumano S,Takatsu Y,Masuda Y,Ishibashi Y,Watanabe T,Asada M,Yamada T,Suenaga M,Kitada C,Usuki S,Kurokawa T,Onda H,Nishimura O,Fujino M. 2001. Metastasis suppressor gene KiSS-1 encodes peptide ligand of a G-protein-coupled receptor[J]. Nature,411(6837):613-617. doi:10.1038/35079135.
Tena-Sempere M. 2006. The roles of kisspeptins and G protein-coupled receptor-54 in pubertal development[J]. Current Opinion in Pediatrics,18(4):442-447. doi:10. 1097/01.mop.0000236396.79580.cc.
(責任编辑 兰宗宝)
