AAV介导的听力损失基因治疗进展
2021-02-07柯君子谈方志钟桂生
柯君子,谈方志†,钟桂生††
①上海科技大学 iHuman研究所,上海 201210;② 上海科技大学 生命科学与技术学院,上海 201210
听力损失是最常见的神经感觉障碍疾病之一,影响着全球4.6亿人口的正常生活[1]。每1 000个新生儿中就有3个患有先天性听力障碍,而且听力受损人数不断增长,预计到2050年将有10亿人受听力损失影响[2]。环境和遗传因素均可导致感觉细胞和神经元的死亡,继而导致听力损失。由于这些细胞的不可再生性,损伤累积将最终导致严重的耳聋。佩戴人工耳蜗是目前解决听力损失的有效方法,但是这种方法没有从根本上治愈听力损伤,使用中还存在灵敏性差、背景噪声强等缺点[3-4]。近年来,由于基因组生物学的发展,多种听力相关基因的发现及部分听力损失机制被阐明,为听力疾病的基因治疗提供了基础理论。耳蜗和听神经损伤导致的感音神经性听力损失(sensorineural hearing loss, SNHL)占所有听力损失的90%,而SNHL中50%左右是基因突变导致的,可以通过基因治疗弥补人工耳蜗的缺陷,从根本上治愈听力损失[5-6]。
1 天然AAV的结构与分型
基因治疗(gene therapy)是指将外源正常基因、小RNA或基因编辑等工具导入靶细胞,纠正或补偿表达异常和基因缺陷,从而达到治疗的目的。大约有1 800例基因治疗使用病毒介导的方法,占总基因治疗临床试验的70%。鉴于腺病毒可能引起致命的免疫反应以及逆转录病毒可能诱发癌症等原因,腺相关病毒(adenoassociated virus, AAV)的非致病性使其有望成为主要的病毒载体。
AAV拥有60个衣壳亚基组成的蛋白衣壳,以及一个约4.7 kb的单链线性DNA基因组,需要依赖于其他病毒(主要是腺病毒)共同感染才能复制[7-9]。AAV的单链基因组包含:Rep基因和Cap基因。其基因产物的两侧是基因组复制和包装所需的反向末端重复序列(ITR)[10]。Rep基因编码病毒基因组,复制和包装所必需的蛋白质;Cap表达病毒衣壳蛋白VP1、VP2、VP3,形成保护病毒基因组的外衣壳,并参与细胞结合[11]。此外,aap基因在一个与Cap基因重叠的阅读框中编码组装激活蛋白(AAP),该核蛋白为衣壳装配提供支架[12-13]。
迄今为止,研究人员已从人类和非人类灵长类动物组织样品中分离出12种血清型AAV(AAV1~AAV12)和100多种变体[14]。在12种血清型中, AAV1~9具有较广泛的组织嗜性,被作为主要基因治疗载体。2012年欧盟批准了第一个基因治疗产品Glybera,该产品通过利用AAV1病毒载体将正常的LPL基因导入患者肌肉细胞中使其产生脂蛋白脂肪酶,以此治疗脂蛋白酯酶缺乏症[15]。FDA也于2017批准了首个使用AAV2治疗遗传性视网膜疾病的基因治疗产品Luxturna[16]。
2 新型AAV载体在听力领域的进展
Landegger等人[17]于2017年报道一种人工设计的AAV病毒载体Anc80L65。与传统的血清型AAV相比,Anc80L65显著提高了幼年小鼠内、外毛细胞的感染效率。同年,Scientific Report报道了Anc80L65对成年小鼠的内毛细胞有几乎100%的感染率,但对外毛细胞表现出极低的感染率[18]。这说明几乎所有听力领域AAV载体的一个现况和难点,即对幼年和成年鼠的感染往往显示出不同的效率。2019年,美国国立卫生研究院发现另一种新型AAV——AAV2.7m8[19]。相比于Anc80L65,高滴度的AAV2.7m8表现出对毛细胞更强的感染效率。同时,AAV2.7m8也可感染IPhC和IBC这两类支持细胞。但是,AAV2.7m8与Anc80L65都对其他支持细胞感染率低,这也是两者在靶向支持细胞的基因治疗和毛细胞再生上的劣势。
通过改造AAV衣壳蛋白,谈方志等人获得一款对耳蜗内各细胞具有高感染效率的AAV载体AAV-ie。AAV-ie对于耳蜗支持细胞的感染率显著高于其他天然AAV型(包括AAV2.7m8和Anc80L65),能达到80%左右显示其在听力疾病治疗领域的潜力(图1)。同时,他们利用AAV-ie将Atoh1基因导入到幼鼠的耳蜗中,首次实现利用AAV载体再生内毛细胞(图2)[19]。值得注意的是,虽然AAV-ie几乎能感染所有的支持细胞,但并没有观察到外毛细胞的再生,可能是由于Atoh1单基因不足以再生外毛细胞。多种因子组合诱导再生或成为后续再生内外毛细胞的重要探索方向之一。

图1 AAV-ie高效感染整个耳蜗组织中的支持细胞,利用AAV-ie导入绿色荧光蛋白
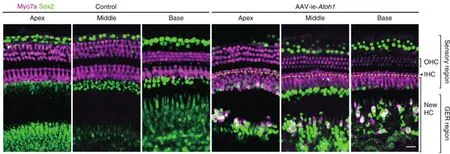
图2 AAV-ie-Atoh1在Sensory区域和GER区域均能再生大量Myo7a阳性的新生毛细胞
3 AAV载体的持续研发
3.1 AAV衣壳的优化
因为AAV感染特性由衣壳的多个方面决定,每一个氨基酸的改变都可能影响AAV感染的偏好性和强度,所以对AAV衣壳的优化成为改造AAV载体的重点。其中,通过突变、肽段插入和家族改组等方法进行的定向进化,创建出的独特衣壳组合可能具有独特的载体特性。一方面,定向进化具有极强的目的性,更易获得所需的载体;另一方面,下一代测序技术能够筛选几千个条形码的转基因基因,进行丰富迭代,使得定向进化成为发现新衣壳的强大技术。另一种构建新AAV衣壳的方法是通过计算机算法来实现的[20]。计算机利用已有的衣壳生物学知识和宿主细胞靶标,合理设计出特异性靶向细胞能逃避免疫监视或具有其他特性的衣壳(图 3)[21]。用上述的技术构建一个新AAV衣壳的改造平台,对于基因治疗平台的建立至关重要。
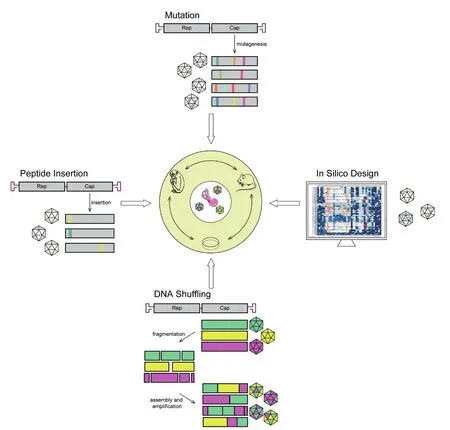
图3 AAV衣壳的改造方法
3.2 AAV介导的蛋白特异性表达
研究表明,Anc80L65被注射入小鼠耳蜗后,除了耳蜗组织的感染外,Anc80L65也能扩散入小鼠的脑部区域,提示出极大的安全风险[18]。AAV-ie的研究中也出现过类似的现象。因此,AAV感染的特异性研究对临床应用具有重要意义。载体特异性问题可以从两个方面来解决:一是定向进化,筛选组织特异性或细胞特异性的AAV载体;二是利用特异性的启动子驱动基因的特异性表达[22]。特异性启动子的设计方法(图4)[22-23]:①通过选取细胞类型特异性基因起始密码子上游序列合成;②通过至少两个细胞特异性基因转录起始位点之前的遗传保守的DNA元素有序组装而成;③由细胞特异性的重复转录因子结合位点与随机序列交叉组成;④由低甲基化的顺调节元件组成。上述4种设计方式针对不同耳蜗细胞类型的特异性启动子,提高治疗基因的表达特异性,继而提高AAV介导的基因治疗的安全性。
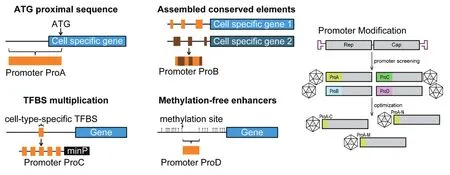
图4 细胞特异性表达启动子的设计方法
4 AAV介导的听力损失小鼠基因治疗
近年来,已有大量研究将AAV用于听力损伤治疗的动物实验(表1)。虽然这些AAV介导的基因治疗显示出一定的疗效,但是都没能完全恢复听力。有效的耳蜗基因治疗的关键是对不同基因和内部各种类型突变引起的缺陷的细胞机制的理解。其中,影响毛细胞、支持细胞或血管纹(SV)功能的单源突变,是导致严重听力损失的3种主要突变类型。天然传统的AAV由于其对各类细胞的感染率都不高,已经逐渐被淘汰。3种新型的AAV载体具有一定的偏好性:AAV2.7m8和Anc80L65偏好感染毛细胞,适用于毛细胞的基因治疗;而AAV-ie能广泛地感染耳蜗内各种组织,对支持细胞感染率高,适用于支持细胞治疗和再生治疗。

表1 部分具有代表性的动物模型的研究
一部分的耳聋基因参与毛细胞负责的声音传导(如Tmc1)、毛束的发育和维持(如Myosin系列的蛋白Myo6、Myo7a等)、神经传导(如OTOF),针对这部分基因异常所导致的耳聋,选用的AAV必须能精准地靶向毛细胞,因此Anc80L65成为这类基因治疗的首选载体。另外一些耳聋基因则主要影响支持细胞,如Gjb2、Slc26a4等[32],AAV-ie则更适合这类耳聋基因的治疗。此外,支持细胞转分化毛细胞等毛细胞再生治疗手段仍需进一步的探索。
5 展望:AAV载体的改造与纯化
近几年,AAV在听力领域的基因治疗研究中取得跨越式的发展,3种新型AAV一定程度上满足了治疗需求,但仍存在特异性差、感染效率低等缺点。目前其他领域中使用AAV载体的临床试验呈指数级增长,而听力领域的相关试验却严重滞后。一个很重要的原因就是缺少能高效感染内耳各种组织的AAV载体。3种新型AAV虽然能解决部分的问题,但特异性和成体感染依然有待进一步研究以寻求方案。要使AAV成为适用听力损失基因治疗的载体,需要多学科融合来筛选出真正实用的AAV载体。因此,对新型AAV的发现与改造仍需要继续探索深研。
另一个AAV基因治疗应用的主要障碍是药物产品的可负担性。目前批准的3款AAV药物都以其惊人的巨额费用限制了药品受众。临床级AAV产品的需求量大和纯化工艺复杂是价格高昂的一个因素。利用悬浮的HEK293细胞进行三质粒转染以进行AAV包装仍是现阶段普遍采取的方法,但无法保证所有细胞都能获得高效包装所需的质粒的最佳比率,从而,使得生产效率低下,无法满足临床大量的使用量。因此,改进生产工艺或寻找更有效的方法仍是我们继续努力的方向。
