茶叶有效成分对黑色素形成的抑制作用
2021-02-06王蔚陈琳王伟伟张建勇江和源
王蔚,陈琳,王伟伟,张建勇,江和源*
茶叶有效成分对黑色素形成的抑制作用
王蔚1,2,陈琳1,2,王伟伟1,张建勇1,江和源1*
1. 中国农业科学院茶叶研究所 农业部茶树生物学与资源利用重点实验室 浙江省茶叶加工工程重点实验室,浙江 杭州 310008;2. 中国农业科学院研究生院,北京 100081
黑色素是一种高分子生物色素,皮肤的颜色由黑色素的合成类型、累积量、黑素小体的再分布及降解决定。太阳紫外线辐射是导致黑色素形成过多的最常见因素。黑色素虽能保护皮肤细胞免受紫外线损伤,但异常积累将会导致黑色素紊乱疾病的发生。因此开发绿色、安全、高效的植物来源的黑色素抑制剂成为近年来研究的热点。不少研究表明茶叶提取复合物或茶叶单体成分可明显降低酪氨酸酶活性,减缓黑色素细胞的生长增殖、浸润、转移,抑制皮肤癌发生等。通过对茶叶有效成分在非细胞酪氨酸酶测试系统、细胞测试系统、动物模型以及人体皮肤中抑制黑色素形成的研究进展进行综述,以期充分挖掘茶叶中主要有效成分抑制黑色素的形成及其相应的作用机制,开发一种安全高效的黑色素合成抑制剂,并为实现茶产品的综合利用、提高茶产业附加值提供思路。
茶叶有效成分;黑色素;非细胞酪氨酸酶测试系统;细胞测试系统;动物模型;人体皮肤
黑色素是一种高分子生物色素,不溶于水,但可溶于碱性溶液,是一种类似于多酚的蛋白质衍生物。在黑色素细胞内部,黑色素合成并储存于组织特异、与溶酶体相关的、被称为黑素小体的专门细胞器中[1]。黑色素合成后,随黑素小体逐步转移到黑色素细胞的树突末端,随后进入周围的角质形成细胞并在其中重新排列分布[2-3]。黑色素通常以聚合形式存在于动物皮肤或毛发中,甚至植物与原生生物都有这种色素,其种类、含量、物理和化学性质、分布等会直接影响皮肤、头发和眼睛的颜色[4-6]。黑色素的形成受多种因素的影响,如紫外线、自由基、情绪压力等,受任一因素影响而引起的黑色素合成的紊乱,都将导致一系列色素代谢障碍性疾病的发生[7],其中紫外线是影响皮肤生物学效应的重要外界物理因素,作为一种强烈的外源性促细胞分裂剂,能引起黑色素细胞的增殖或凋亡,以及黑色素合成的增加[8-9]。黑色素的存在有利有弊。当紫外线照射到皮肤上,肌肤就会处于“自我防护”的状态,通过物理吸收光波,并经一系列信号转导通路激活酪氨酸酶的活性,通过产生黑色素来保护皮肤免受紫外辐射的侵害[10-11];黑色素还能保护皮肤和眼睛免受有害物质的侵害,保护包括皮肤、眼睛、大脑在内的多个器官系统功能的正常运行[12],且已被证明能够通过其羧基和酚羟基有效地结合金属离子,从而有助于隔离潜在的有毒金属离子和保护剩余细胞[13]。此外,黑色素在有机体适应环境的过程中也发挥着至关重要的作用[14]。但是黑色素在表皮基底层的异常蓄积会造成晒斑、雀斑、老年斑等皮肤斑,影响审美及人们的生活质量,也极大地增加了患恶性黑色素瘤这一转移性强、恶性度高的皮肤癌症的风险[15]。
对黑色素细胞早期的研究始于1837年捷克生理学家Purkyne在对脑缘皮质细胞研究中发现的黑色素颗粒[16]。1840年瑞典著名生理学家Berzelius首次将黑色素正式命名为melanin[17]。1954年Richter开始从化学分析的角度对不同形态的黑色素进行研究。1972年Duchon对黑色素颗粒的物质组成、结构以及性质进行了研究,并提出黑色素是由多种蛋白质的色素颗粒构成。近年来,一些色素性疾病的研究以及市场上关于美白添加剂的开发使得黑色素的形态结构、生理功能、合成调控、以及迁移沉积成为研究热点[18-19]。
抑制黑色素合成的研究可以从抑制酪氨酸酶活性、通过细胞信号干预黑色素生成、阻碍黑色素从黑色素细胞向角质形成细胞的转移等方面开展。目前,在抑制黑色素过度合成方面,医药与化妆品行业研究最多的是酪氨酸酶抑制剂,如:苯二酚、氢醌、曲酸等,但是这些物质普遍具有刺激性和细胞毒性,以其制成的药物或美白添加剂往往稳定和皮肤渗透能力差、活性不足,易造成皮炎和永久性脱色,甚至具有致癌风险。随着社会经济和科技水平的发展,人们对于医药以及化妆品的要求也不断提高,对人体健康无负面影响,具有抗炎、免疫调节和抗氧化等特性的植物来源美白添加剂逐渐受到青睐。其中,茶叶提取物中的多种成分具有清除自由基、调节免疫力、抗氧化、抗肿瘤、抗炎症和抗心脑血管疾病等诸多的生物活性[20-22],近年来对茶叶提取物的美白作用研究也越来越多。前期研究证明,茶叶提取复合物或茶叶单体成分具有较强的抑制酪氨酸酶活性、抑制黑色素细胞的生长增殖浸润转移、抑制紫外线(UVB)诱导皮肤致癌并为皮肤提供光保护等作用。因此,以茶叶为原料开发预防、治疗黑色素瘤的药物或淡化色斑改善皮肤颜色的护肤品、化妆品具有广阔的应用前景。本文通过对茶叶有效成分在非细胞酪氨酸酶测试系统、细胞测试系统、动物模型以及人体皮肤中抑制黑色素形成的研究进展进行综述,以期充分挖掘茶叶中抑制黑色素形成的主要有效成分及其作用机制,找到一种安全高效的黑色素合成抑制剂,并为实现茶产品的综合利用、提高茶产业附加值提供思路。
1 对体外酪氨酸酶活性的抑制作用
茶及茶叶提取复合物可以抑制体外酪氨酸酶活性。刘锦梅等[23]比较了绿茶、铁观音、花茶和普洱茶4种茶类4.0 mg·mL-1(以生药计)的醇提物对马铃薯酪氨酸酶活性的抑制率,结果表明铁观音(62.28%)对酪氨酸酶活性的抑制率最强,其次依次为花茶(34.76%)、普洱茶(29.00%)和绿茶(9.50%)。沈晓佳等[24]研究发现紫娟茶的3种提取物对蘑菇酪氨酸酶单酚酶和二酚酶活性均有较好的抑制作用,特别是含有花青素和茶多酚混合物的提取物Ⅰ的抑制作用最强。刘婧等[25]通过建立的酪氨酸酶抑制效果评价体系来研究不同添加量的超绿活性茶粉对酪氨酸酶活性的影响。结果表明,超绿活性茶粉添加量为4%时,对酪氨酸酶的抑制效果最好,抑制率达到20.85%,表明其可作为美白化妆品的添加剂。傅佳愈等[26]研究了茶花粉提取物对酪氨酸酶的抑制作用。结果表明,茶花粉提取物抑制酪氨酸酶活性的能力和多酚、黄酮类化合物的含量呈中度正相关,相关系数分别为0.404和0.400,但均不显著(>0.05)。刘林刚等[27]研究表明,茶多酚在浓度为2 mmol·L-1时对蘑菇酪氨酸酶的活性表现出较强的抑制作用,显著强于0.5 mmol·L-1的氢醌。Hong等[28]评估了单宁酶转化绿茶提取物对皮肤物理稳定性和相关酶活性的影响。结果表明,当用单宁酶处理时,绿茶提取物中表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)和表儿茶素没食子酸酯(Epicatechin gallate,ECG)的浓度大幅度下降到可以忽略不计的水平。相较于5%常规绿茶提取物,5%单宁酶转化绿茶提取物显著抑制了胰肽酶E、蘑菇酪氨酸酶的活性(<0.05),且后者在16周内表现出相对稳定的pH、沉淀、颜色特性。
此外,茶叶单体成分,如儿茶素类、茶黄素类、茶皂素等都被证明可以抑制体外酪氨酸酶活性。官兴丽[29]研究发现,儿茶素能抑制马铃薯和蘑菇酪氨酸酶的活性中心,导致酶活性下降,与底物左旋多巴竞争酶,降低酶促反应的效率。No等[30]评价了10种韩国传统茶(Oolong、boxthorn、green tea等)和绿茶中的主要组分(ECG、GCG、EGCG等)对蘑菇酪氨酸酶的抑制作用。结果表明,绿茶中抑制酪氨酸酶活性的主要活性成分为ECG、没食子儿茶素没食子酸酯(Gallocatechin gallate,GCG)和EGCG,且以GCG的抑制效果最好。ECG、GCG和EGCG都是以没食子酸为活性部位的儿茶素类。对酪氨酸酶抑制的动力学分析揭示了GCG取代-酪氨酸而结合在酪氨酸酶活性部位,GCG与-酪氨酸存在竞争性关系。梁慧玲等[31]研究中使用了3种茶叶提取物,其中茶提物1中儿茶素类总量为97.33%,EGCG、表儿茶素(Epicatechin,EC)、ECG、表没食子儿茶素(Epigallocatechin,EGC)、儿茶素(Catechin,C)含量分别为54.51%、16.38%、13.46%、11.46%、1.52%;茶提物2只含有90.10%的EGCG;茶提物3中儿茶素类总量为21.73%,各单体含量均小于茶提物1中对应组分的含量,茶黄素类总量为36.80%。试验结果发现茶提物3对蘑菇酪氨酸酶的抑制率最大,其次是茶提物1,茶提物2最小,因此推断茶黄素类对酪氨酸酶的抑制率远大于儿茶素类。周盈利等[32]研究茶黄素(Theaflavin,TF1)、茶黄素-3-没食子酸酯(Theaflavins-3-gallate,TF2A)、茶黄素-3′-没食子酸酯(Theaflavins-3′-gallate,TF2B)、茶黄素双没食子酸酯(Theaflavins-3,3′-gallate,TF3)和茶黄酸(Theaflavic acid,TF4)5种单体化合物对蘑菇酪氨酸酶的抑制作用,并与阳性对照EGCG进行比较。结果显示,5种茶黄素单体对酪氨酸酶活性有不同程度的抑制作用,且存在量效关系。除茶黄酸外,其他4种茶黄素单体对酪氨酸酶活性的抑制作用均高于EGCG。孙劲毅等[33]研究了茶皂素对马铃薯酪氨酸酶活性的抑制作用,质量浓度为100 g·L-1时,市售茶皂素、经大孔树脂纯化的茶皂素TS及2种层析分离得到的茶皂素TS1和TS2对酪氨酸酶的抑制率分别为51.29%、90.06%、94.13%和82.47%;TS和TS1对酪氨酸酶IC50分别为48 g·L-1和40 g·L-1,抑制作用表现为可逆竞争性抑制,对酪氨酸酶的抑制常数分别为137 g·L-1和101 g·L-1。
综上可见,在非细胞酪氨酸酶测试系统中,茶及茶叶提取复合物、茶叶单体成分均能抑制体外酪氨酸酶的活性,主要通过抑制酪氨酸酶的活性中心[29]及与底物竞争酪氨酸酶[29-30]发挥作用。
2 对细胞模型中黑色素合成的抑制作用
在细胞测试系统中,目前常用的细胞类型包括永生化黑色素细胞、黑色素瘤细胞、人表皮黑色素细胞、人表皮角质形成细胞。
2.1 对永生化黑色素细胞或黑色素瘤细胞模型中黑色素合成的抑制作用
在以永生化黑色素细胞或者黑色素瘤细胞为研究对象的试验中,Kim等[34]研究发现红茶、绿茶和白茶水提物能够抑制永生化黑色素细胞中黑色素沉积和树突形成。当质量浓度为12.5 µg·mL-1时,红茶水提物和白茶水提物抑制黑色素生成的效果优于同等浓度的EGCG(对照),且红茶效果最佳,但3种茶水提物对黑色素生成的抑制作用均优于曲酸(Kojic acid,KA)和熊果苷(Arbutin,AT)。此外,红茶、绿茶和白茶水提物以浓度依赖的方式抑制细胞内酪氨酸酶活性。许兰等[35]研究表明,茶树花提取物可以通过改变细胞形态、抑制细胞增殖、抑制酪氨酸酶活性、减少黑色素生成等途径达到美白效果,并呈一定的剂量依赖性。陈贞纯等[36]研究表明,茶黄素单体(TF1)、EGCG、纯度为40%的茶黄素(TF40)对B16黑色素瘤细胞形态有不同程度的影响,对细胞活性、酪氨酸酶浓度和黑色素合成量有浓度依赖性抑制作用。张向娜[3]研究表明茶叶提取物EGCG、GCG、ECG能改变B16F10小鼠黑色素瘤细胞的形态,抑制细胞增殖率、细胞内酪氨酸酶活性以及黑色素的生成量,下调黑色素生成相关基因(MITF、TYR、TRP-1、TRP-2)的表达,并通过降低细胞内cAMP的水平来下调黑色素生成相关蛋白(CREB1、p-CREB1、MITF、TYR、TRP-1、TRP-2蛋白)的表达,以此发挥美白功效。相同浓度条件下,EGCG、GCG、ECG的美白效果优于熊果苷,且ECG效果最优,其次为EGCG,再次是GCG。Kim等[37]研究表明,在不产生细胞毒性的情况下,100 µmol·L-1的EGCG显著降低B16F10细胞分泌和合成的黑色素含量。50 µmol·L-1的EGCG虽然不影响细胞的黑色素分泌量,但是显著降低了细胞内黑色素合成量。张欣等[38]研究结果表明,茶氨酸衍生物茶溴香酰胺脂质体(TBrC-L)以剂量依赖的方式对黑色素瘤B16细胞的生长和迁移产生显著性抑制作用,并且诱导其凋亡。TBrC-L可下调c-Met、HGF、Bcl-2、NF-B和VEGFR2的表达,上调Caspase-3、E-cadherin、Bax、p53和Cytochrome c的表达,因此抑制HGF/Met/VEGFR2-NF-κB通路可能是TBrC-L抑制B16细胞生长和迁移的重要分子机制。
2.2 对人表皮黑色素细胞中黑色素合成的抑制作用
在以人表皮黑色素细胞为研究对象的试验中,岳学状[39]研究发现5.0~20.0 µg·mL-1的EGCG对体外培养的人黑色素细胞的黑色素含量和酪氨酸酶活性具有显著的抑制作用,并呈剂量依赖性。
2.3 对人表皮角质形成细胞中黑色素合成的抑制作用
虽然黑素小体形成是黑化过程中的关键步骤,但黑素小体必须从黑色素细胞转移到角质形成细胞才能发挥相应的作用,呈现对应的颜色,并促进黑色素的进一步生成。成熟的黑素小体沿着微管、微丝运动到黑色素细胞的树突上,再通过树突状结构转移到周围的角质形成细胞中,并在其中重新排列分布。因此黑色素颗粒会随角质形成细胞的分化向上迁移,最终在角质层中积累,黑色素在角质层中的积累构成了可见的色素沉积[3]。因此,已有不少研究者对人表皮角质形成细胞进行了相关研究。
转录因子中的激活蛋白1(Activator protein 1,AP1)家族在细胞增殖和存活中起着重要作用[40]。Chen等[41]证明,用EGCG处理人角质形成细胞株(HaCaT)后,UVB诱导的c-(AP-1的一种异二聚体)表达降低。
核转录因子NF-B是一种广泛表达的转录因子,属于Rel家族。它可以被紫外线辐射所刺激,并参与炎症、免疫、细胞周期进展、凋亡和肿瘤发生等多个过程[42-43]。经EGCG处理后,紫外线诱导的人类表皮角质形成细胞中IKBa降解和磷酸化受到抑制,IKKa以特定剂量和时间的方式被激活,表明EGCG可以抑制NF-B激活所导致的一些有害生物后果[44]。
外皮蛋白(Human involucrin,hINV)是一种角质形成细胞分化标志物,由AP1转录因子所调控[45]。Balasubramanian等[45]指出,EGCG通过增加hINV、谷氨酰胺转氨酶1型(Transglutaminase type 1,TG1)和caspase-14基因的表达而促进正常人角质形成细胞的分化,这可能是使突变细胞从表皮中去除的一种机制。EGCG促进hINV表达的作用是通过激活nPKC、Ras、MEKK1、MEK3、p38δ-ERK1/2信号级联反应而介导的,进而增加AP1转录因子的表达,并增强该因子与hINV启动子AP1-1位点的结合以激活hINV基因的表达。EGCG处理后,角质形成细胞的形态也会发生改变。EGCG可抑制角质形成细胞的增殖,但不会诱导其凋亡。EGCG在正常和永生化(或形态性质发生改变的细胞)角质形成细胞中会引起不同的反应。在正常角质形成细胞中,EGCG增加AP1因子表达水平,而在永生化细胞中EGCG则降低AP1因子表达水平。这表明EGCG的活性和作用机制在疾病发展过程中可能发生变化。
2.4 对细胞混合培养模型中黑色素合成的抑制作用
兰海龙等[46]以包皮组织作为细胞来源,体外构建黑色素细胞与角质形成细胞直接接触的混合培养模型,检测芦荟苦素、熊果苷及茶多酚作用于此模型后对黑色素细胞酪氨酸酶活性及黑色素合成的影响,发现3种褪色剂均对黑色素细胞酪氨酸酶活性及黑色素合成产生浓度依赖性抑制,茶多酚作用最强,芦荟苦素次之。
总的来说,在细胞测试系统中,茶叶提取复合物及单体成分对黑色素合成的抑制作用主要通过改变黑色素瘤细胞形态[3,35]、抑制黑色素瘤细胞增殖[3,35]、抑制黑色素瘤细胞内酪氨酸酶活性[3,34-35]、减少黑色素生成和积累[3,34]、减少树突传递黑色素量[34]、抑制永生化角质形成细胞的增殖[45]、促进正常人角质形成细胞的分化[45]等来实现。
3 对动物模型中UVB诱导的皮肤致癌及黑色素合成的抑制作用
皮肤癌主要分为黑色素瘤和非黑色素瘤两大类[47]。太阳紫外线辐射是导致色素异常积累和皮肤癌等皮肤问题的最常见因素[48-49]。虽然皮肤被赋予内源性防御系统,以限制太阳紫外线辐射对皮肤造成的有害影响,如角质层的光散射、黑色素对光的吸收、抗氧化防御方法的存在以及修复酶修复紫外线损伤的DNA等,然而这些内生的光保护手段不能完全抵消过度曝露于紫外线辐射下产生的所有不利影响[50]。因此开发可以抑制紫外线诱导的皮肤致癌或为皮肤提供光保护的天然成分显得尤为重要。
3.1 茶叶有效成分可以抑制UVB诱导的皮肤致癌
研究表明,口服常规茶(未脱咖啡碱的绿茶和红茶)可以抑制UVB诱导的SKH-1小鼠皮肤癌变。常规茶对UVB诱导皮肤癌变的抑制活性强于脱咖啡碱茶(脱咖啡碱绿茶、脱咖啡碱红茶),在脱咖啡碱的茶中添加咖啡碱可恢复这些茶对癌变的抑制作用[51]。在以DMBA(7,12-二甲基苯并蒽)激活的SKH-1小鼠为动物模型的试验中,口服高剂量(1.25%的水提液)的脱咖啡碱茶可以抑制小鼠皮肤癌变,虽然其效果低于常规茶[52]。而在UVB诱导完全癌变的小鼠模型中,口服低剂量的脱咖啡碱茶只能轻微抑制甚至不能抑制UVB诱导的完全癌变,口服高剂量(1.25%的水提取液)的脱咖啡碱茶反而促进UVB的皮肤致癌作用[51],造成两者差异的原因尚不清楚。但是两个试验都证明咖啡碱是茶叶中对UVB诱导的皮肤癌变起抑制作用的重要组分。
Lu等[53]用UVB(30 mJ·cm-2)照射SKH-1无毛小鼠,每周两次,持续22周后,不再进行UVB照射,这些无瘤小鼠在未来几个月内具有很高的发生恶性和非恶性皮肤肿瘤的风险,称为高风险小鼠。在停止UVB照射后,高风险小鼠口服绿茶、红茶或咖啡碱23周,可以减少患肿瘤的小鼠数量,减小子宫旁脂肪垫的大小,并降低非肿瘤和肿瘤下的真皮脂肪层的厚度。服用不含咖啡碱的茶对以上参数几乎没有影响,在脱咖啡碱的茶中添加咖啡碱(相当于常规茶中的咖啡碱的含量)可以恢复其抑制作用。在所有试验组中,肿瘤下的真皮脂肪层比非肿瘤区的薄,大肿瘤下的真皮脂肪比小肿瘤下的少,显示肿瘤下的真皮脂肪可能是肿瘤的能量来源。饮用含咖啡碱饮料可以降低肿瘤下,特别是大肿瘤下的真皮脂肪层厚度。这是第一次证明化学预防剂通过降低组织脂肪水平来抑制癌变,从而指出咖啡碱是常规含咖啡碱茶发挥降低组织脂肪水平和减少癌症发生作用的关键成分。值得注意的是,常规的含咖啡碱茶和咖啡碱对体脂形成(通过参考脂肪垫大小和皮肤脂肪厚度的变化来衡量)和肿瘤发生的抑制作用是在不影响体重或食物消耗的情况下发生的。
Conney等[54]研究发现口服绿茶、咖啡或咖啡碱溶液2周可增强UVB诱导SKH-1小鼠表皮细胞的凋亡,但该处理对没有被UVB照射的正常表皮细胞无明显影响,因此口服绿茶、咖啡和咖啡碱可至少部分地通过增强UVB诱导的细胞凋亡来抑制UVB诱导的癌变。在UVB照射前(0.5 h)将咖啡碱外涂于皮肤上具有防晒效果,可以抑制UVB诱导的胸腺嘧啶二聚体形成,并抑制UVB诱导的皮肤晒伤。单次UVB照射后立即外涂咖啡碱可增强UVB诱导的表皮细胞凋亡,但这种处理对正常表皮、表皮弥漫性增生区和荷瘤小鼠表皮中远离肿瘤的区域没有影响[55]。此外,外涂咖啡碱可抑制UVB预处理20周的小鼠(无肿瘤的高风险小鼠)体内肿瘤的形成,促进肿瘤细胞的凋亡,但同样地对远离肿瘤的表皮细胞无抑制作用[54]。这些结果表明,咖啡碱对DNA损伤组织和肿瘤有选择性促凋亡作用,不会影响正常组织。
每周两次用UVB照射小鼠,在这个过程中,口服咖啡碱可以:(1)抑制表皮细胞中早期斑块的形成;(2)改变p53阳性斑块中UVB诱导的p53基因突变的表达谱;(3)抑制UVB诱导的癌变。将咖啡碱外涂于UVB预处理的高风险小鼠(造模后不再进行UVB照射):(1)促进了表皮中突变型p53阳性细胞斑的清除;(2)选择性地降低了在p53基因中有一个纯合突变的斑块的比例;(3)抑制了UVB诱导的癌变[55]。生物学上将p53分为野生型和突变型两类。野生型p53基因是一种常规的抑癌基因,其编码的蛋白可对细胞周期进行调控,使得DNA受损的细胞难以由G1期进人S期或者由G2期进入M期,从而抑制肿瘤细胞的增殖[56]。相关研究表明,咖啡碱提高了野生型p53基因的表达[57],并通过一个p53、bax非依赖性机制[58]来增强UVB诱导的小鼠表皮细胞凋亡。
3.2 茶叶有效成分可以为皮肤提供光保护
Choi等[59]为评价红茶水提取物(Black tea water extract,BT)的美白效果,将BT涂于棕色豚鼠(450~500 g)背部皮肤上,并经UVB(1 500 mJ·cm-2)照射诱导产生的人工色素沉着斑点。试验通过检测总多酚含量和总黄酮含量,比较了EGCG、BT、氢醌(Hydroquinone,HQ)、KA及AT的抗氧化能力。动物试验分组如下:正常组(无处理组,N)、对照(UVB+生理盐水,C)、空白对照[UVB+丙二醇:乙醇:水(5︰3︰2),VC]、阳性对照(UVB+2%氢醌,PC)、试验组1(UVB+1% BT,BT1)、试验组2(UVB+2% BT,BT2)。试验化合物为30 μL,每天2次,每周5天,连续4周。用药4周后,在麻醉条件下用活检穿孔器摘除斑点,作为组织学检查的样品。结果显示,5种样品的抗氧化能力为:EGCG>BT>HQ>KA>AT(BT显著高于KA和AT,略高于氢醌),说明BT具有较高的抗氧化活性。通过肉眼观察和组织学检查,BT脱色能力低于PC。在用药的第4周,与N组相比,C组和VC组中的黑色素沉着显著增加,并且覆盖整个表皮。与C组相比,PC、BT1和BT2组中的黑色素分散明显减少,并且主要局限于基底层。与C组和VC组相比,PC、BT1与BT2组的黑色素指数显著下降(<0.001),且显著抑制了黑色素沉着、黑色素细胞增殖和黑素小体合成。综上,BT通过减少黑色素沉着来消除棕色豚鼠中由UVB刺激产生的延迟晒斑,而黑色素沉着减少又是通过抑制黑色素细胞的增殖和黑素小体的合成来实现。
汪建等[60]研究了茶多酚经皮给药对小鼠皮肤中酪氨酸酶活性的影响。试验中,小鼠根据用药时间不同分为3组(用药1 h、7 d和14 d),小鼠脱毛皮肤处每次涂抹0.3 g 3%的茶多酚膏剂,用药7 d和14 d组每日早晚各涂1次。其后,取皮测定其中酪氨酸酶、丙二醛(Malondialdehyde,MDA)、超氧化物歧化酶(Superoxide dismutase,SOD)活性的变化。结果表明,3组小鼠皮肤中酪氨酸酶活性均被显著抑制,但是MDA和SOD活性没有显著变化。说明茶多酚能够透皮吸收,强烈抑制酪氨酸酶的活性,但不会过多干扰正常皮肤的其他氧化还原代谢,这有利于维持皮肤的组织更新。
4 茶叶有效成分对人体皮肤中黑色素合成的抑制作用
茶叶提取复合物及茶叶单体成分主要通过抑制紫外线照射诱导的皮肤红斑形成、黑色素指数(Melanin index,MI)增加、晒伤细胞形成、表皮Langerhans细胞损耗和皮肤表皮增厚来为皮肤提供光保护。
Elmets等[61]以人类皮肤为试验对象,未晒黑的背部先外涂EGCG处理30 min,然后进行急性紫外线照射。结果表明,EGCG显著抑制紫外线照射诱导的皮肤红斑形成、晒伤细胞形成和表皮Langerhans细胞损耗。
Li等[62]以20名志愿者为试验对象研究了绿茶提取物对经紫外线照射的人体皮肤的保护作用。在进行紫外线照射前,志愿者背部的5处皮肤分别被涂抹2%~5%绿茶提取物,然后反复照射人工模拟的太阳UVR。结果显示,紫外线照射使皮肤产生红斑、MI增加并且皮肤表皮增厚,而绿茶提取物可以抑制紫外线对皮肤产生的不良影响,但并不呈浓度依赖性(相较于更高浓度,2%和3%的绿茶提取物具有更佳的光保护效果)。
5 总结与展望
大量体内外试验证明,茶叶提取复合物或单体成分可以有效减少黑色素的合成、沉积以及黑色素瘤的发生。至今,关于茶叶对黑色素紊乱疾病调控的研究,涉及了体外酪氨酸酶、黑色素瘤细胞、正常黑色素细胞、角质形成细胞、UVB诱导小鼠致癌模型、鼠或人类皮肤等多个研究对象,受试因素也不再仅限于茶多酚、儿茶素或EGCG,咖啡碱、茶皂素、茶氨酸衍生物TBrC-L的功效也获得了肯定。已经取得的相关进展说明以茶叶为原料开发应用于医药和化妆品领域的黑色素抑制剂是安全、有效、可行的。茶抑制黑色素形成的作用机制见图1。
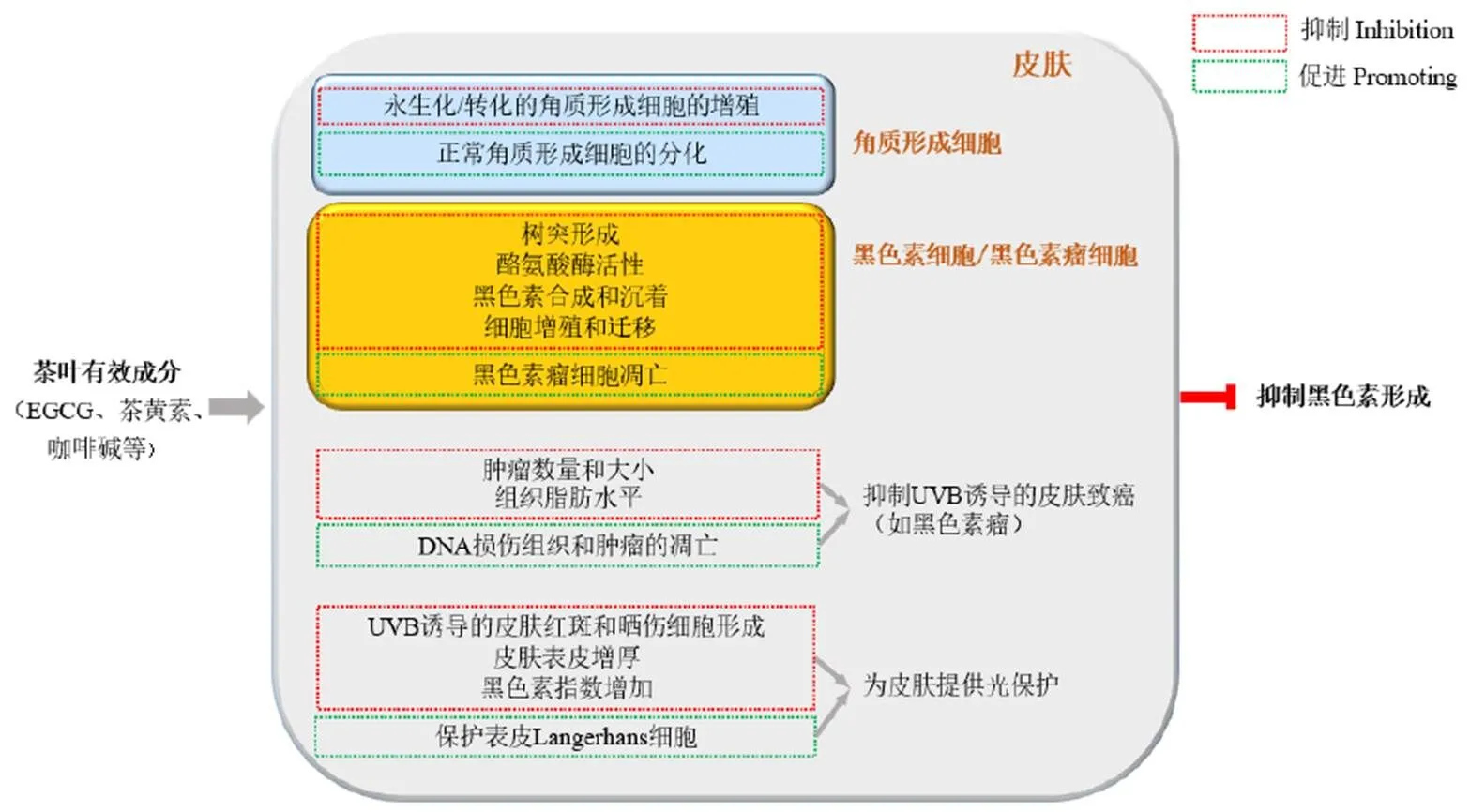
注:皮肤(灰色)中包含角质形成细胞(蓝色)与黑色素细胞/黑色素瘤细胞(黄色),黑色素瘤源自黑色素细胞。茶叶有效成分通过影响细胞的形态和生命活动、抑制UVB诱导的黑色素瘤产生、为皮肤提供光保护等方式抑制黑色素的形成
前期研究表明,儿茶素类、茶黄素类、茶皂素等多种茶叶单体成分都能抑制黑色素的形成。儿茶素中还有一些成分对酪氨酸酶活性的抑制效果优于EGCG,如ECG[3,30-31]。GCG对酪氨酸酶活性的抑制效果也很强[30],但在不同的试验中,或强于EGCG[30],或弱于EGCG[3],因此有待进一步验证。此外,茶黄素类(TF1、TF2A、TF2B、TF3)对酪氨酸酶的抑制作用强于EGCG[32]。咖啡碱是常规茶发挥减少癌症发生和降低组织脂肪水平作用的关键成分[53]。试验证明,常规茶对皮肤癌变的抑制效果优于脱咖啡碱茶,单独口服或外涂咖啡碱对UVB诱导的晒伤和癌变也有很强的抑制作用。在脱咖啡碱的茶中添加咖啡碱可恢复这些茶对UVB诱导的癌变的抑制作用;这些结果表明,咖啡碱是茶叶中对UVB诱导的完全癌变起抑制作用的重要组分[51]。
另一方面,比较不同茶类对蘑菇酪氨酸酶活性的抑制率的试验结果表明,铁观音(62.28%)>花茶(34.76%)>普洱茶(29.00%)>绿茶(9.50%)[23]。还有一些试验显示红茶提取物和白茶提取物抑制黑色素生成的效果优于EGCG[34]。在减少黑色素积累量和抑制树突传递黑素小体方面,红茶提取物的效果优于绿茶和白茶,但三者均优于曲酸和熊果苷[34]。在口服绿茶或红茶抑制UVB光诱导的SKH-1小鼠皮肤完全癌变试验中,绿茶抑制癌变的效果更强[51]。这些试验结果的矛盾处有可能是试验材料、试剂浓度等的差异造成的,需要后期更多的试验加以验证。
综上可见,虽然茶叶在抑制酪氨酸酶活性、黑色素细胞的生长增殖浸润转移、皮肤癌发生等方面的研究取得了一定的进展,但是仍有许多方面需进一步研究。其一,咖啡碱或茶叶其他成分选择性地促进DNA损伤组织中细胞凋亡的机理需要进一步探索;其二,茶红素、茶褐素等儿茶素氧化聚合物及茶氨酸等其他茶叶成分在抑制黑色素形成方面的研究需要开展并进一步深入;其三,茶叶抑制黑色素细胞或黑色素瘤细胞中黑色素合成的生物学特征及分子机制需要深入,如研究哪些信号通路参与或调控了某一成分对黑色素合成的抑制作用;其四,需进一步明确黑色素其他调控机制,如促进黑色素分解及代谢,调控酪氨酸酶翻译后的修饰,抑制角质形成细胞对黑素小体的摄取和吞噬等。根据总结以上研究成果,可为开发安全、高效的新型天然美白添加剂及预防或治疗黑色素紊乱疾病的药物提供理论依据。
[1] Raposo G, Marks M S. Melanosomes: dark organelles enlighten endosomal membrane transport [J]. Nature Reviews Molecular Cell Biology, 2007, 8(10): 786-797.
[2] Lin J W, Chiang H M, Lin Y C, et al. Natural products with skin-whitening effects [J]. Journal of Food & Drug Analysis, 2008, 16(2): 1-10.
[3] 张向娜. 茶叶中EGCG、ECG和GCG对B16F10细胞内黑色素生成的影响及机理研究[D]. 长沙: 湖南农业大学, 2017. Zhang X N.Effects of EGCG, ECG and GCG from tea on melanogenesis in B16F10 cells and its mechanism [D]. Changsha: Hunan Agricultural University, 2017.
[4] Jimbow K, Quevedo W C, Fitzpatrick T B, et al. Some aspects of melanin biology: 1950—1975 [J]. Journal of Investigative Dermatology, 1976, 67(1): 72-89.
[5] Maroñas O, Söchtig J, Ruiz Y, et al. The genetics of skin, hair, and eye color variation and its relevance to forensic pigmentation predictive tests [J]. Forensic Science Review, 2015, 27(1): 13-40.
[6] Pavan W J, Sturm R A. The genetics of human skin and hair pigmentation [J]. Annual Review of Genomics and Human Genetics, 2019, 20: 41-72.
[7] Lee T H, Seo J O, Do M H, et al. Resveratrol-enriched rice down-regulates melanin synthesis in UVB-induced guinea pigs epidermal skin tissue [J]. Biomolecules and Therapeutics, 2014, 22(5): 431-437.
[8] Choi W, Miyamura Y, Wolber R, et al. Regulation of human skin pigmentation in situ by repetitive UV exposure: molecular characterization of responses to UVA and/or UVB [J]. Journal of Investigative Dermatology, 2010, 130(6): 1685-1696.
[9] Nishizaka T, Nomura T, Sano T, et al. Hyperbaric oxygen improves ultraviolet B irradiation-induced melanin pigmentation and diminishes senile spot size [J]. Skin Research & Technology, 2011, 17(3): 332-338.
[10] Gilchrest B A, Eller M S. DNA Photodamage stimulates melanogenesis and other photoprotective responses [J]. Journal of Investigative Dermatology Symposium Proceedings, 1999, 4(1): 35-40.
[11] Chang T S. Natural melanogenesis inhibitors acting through the down-regulation of tyrosinase activity [J]. Materials, 2012, 5(9): 1661-1685.
[12] Ho H, Ganesan A K. The pleiotropic roles of autophagy regulators in melanogenesis [J]. Pigment Cell & Melanoma Research, 2011, 24(4): 595-604.
[13] Liu Y, Hong L, Kempf V R, et al. Ion-exchange and adsorption of Fe(III) bymelanin [J]. Pigment Cell Research, 2004, 17(3): 262-269.
[14] Hoekstra H E. Genetics, development and evolution of adaptive pigmentation in vertebrates [J]. Heredity, 2006, 97(3): 222-234.
[15] Kim Y J, Uyama H. Tyrosinase inhibitors from natural and synthetic sources: structure, inhibition mechanism and perspective for the future [J]. Cellular & Molecular Life Sciences, 2005, 62(15): 1707-1723.
[16] 徐伟, 封竣淇, 黄兰, 等. TYR基因研究进展[J]. 中国畜牧杂志, 2017, 53(4): 23-27. Xu W, Feng J Q, Huang L, et al. Research progress ongene [J]. Chinese Journal of Animal Science, 2017, 53(4): 23-27.
[17] Liu Y, Simon J D. Isolation and biophysical studies of natural eumelanins: applications of imaging technologies and ultrafast spectroscopy [J]. Pigment Cell Research, 2003, 16(6): 606-618.
[18] Elleder M, Borovanský J. Autofluorescence of melanins induced by ultraviolet radiation and near ultraviolet light. A histochemical and biochemical study [J]. Histochemical Journal, 2001, 33(5): 273-281.
[19] Slominski A, Tobin D J, Shibahara S, et al. Melanin pigmentation in mammalian skin and its hormonal regulation [J]. Physiological Reviews, 2004, 84(4): 1155-1228.
[20] 林智, 吕海鹏, 张盛. 茶叶活性成分的化学和药理作用[J]. 中国茶叶, 2018, 40(11): 1-6. Lin Z, LYU H P, Zhang S. Chemical and pharmacological effects of active ingredients in tea [J]. China Tea, 2018, 40(11): 1-6.
[21] 蔡淑娴, 万娟, 刘仲华. 茶叶的调节免疫作用[J]. 中国茶叶, 2020, 42(4): 1-12. Cai S X, Wan J, Liu Z H. Regulative effects and mechanisms of tea on immune function [J]. China Tea, 2020, 42(4): 1-12.
[22] 施江, 张盛, 陈爱陶, 等. 茶叶预防心血管疾病的功效及机理[J]. 中国茶叶, 2019, 41(6): 6-11. Shi J, Zhang S, Chen A T, et al. Efficacy and mechanism of tea in preventing cardiovascular diseases [J]. China Tea, 2019, 41(6): 6-11.
[23] 刘锦梅, 王艳丽, 潘维. 4种茶叶醇提物对酪氨酸酶的抑制作用[J]. 现代食品科技, 2009, 25(6): 610-611. Liu J M, Wang Y L, Pan W.Inhibition effects of 4 kinds of ethanol extracts from teas on activity of tyrosinase in potato [J].Modern Food Science and Technology, 2009, 25(6): 610-611.
[24] 沈晓佳, 赵黎明, 周家春, 等. 紫娟茶提取物对酪氨酸酶活性的抑制作用[J]. 食品工业科技, 2012, 33(24): 75-80. Shen X J, Zhao L M, Zhou J C, et al.Inhibitory effect of extract from Zijuan tea on tyrosinase activity [J].Science and Technology of Food Industry, 2012, 33(24): 75-80.
[25] 刘婧, 王彬, 蒋玉兰, 等. 超绿活性茶粉对酪氨酸酶活性影响的研究[J]. 农产品加工(学刊), 2013(12): 12-15. Liu J, Wang B, Jiang Y L, et al.The influence of ultra-green active tea powder on tyrosinase activity [J].Academic Periodical of Farm Products Processing, 2013(12): 12-15.
[26] 傅佳愈, 杨远帆, 倪辉, 等. 茶花粉提取物对酪氨酸酶的抑制作用[J]. 中国食品学报, 2015, 15(7): 66-72. Fu J Y, Yang Y F, Ni H, et al.The anti-tyrosinase effect of extract from camellia pollen [J]. Journal of Chinese Institute of Food Science and Technology, 2015, 15(7): 66-72.
[27] 刘林刚, 阎永建, 吴学忠. 茶多酚、葛根黄酮对酪氨酸酶的抑制作用研究[J]. 中国麻风皮肤病杂志, 2005(2): 103-104. Liu L G, Yan Y J, Wu X Z. The inhibitory effect of green tea polyphenols on tyrosinase [J].China Journal of Leprosy and Skin Diseases, 2005(2): 103-104.
[28] Hong Y H, Jung E Y, Noh D O, et al. Physiological effects of formulation containing tannase-converted green tea extract on skin care: physical stability, collagenase, elastase, and tyrosinase activities [J]. Integrative Medicine Research, 2014, 3(1): 25-33.
[29] 官兴丽. 儿茶素对黑色素形成抑制效果初探[D]. 重庆: 西南大学, 2011. Guan X L. Inhibitory effect of catechins on the formation of melanin [D]. Chongqing: Southwest University, 2011.
[30] No J K, Soung D Y, Kim Y J, et al. Inhibition of tyrosinase by green tea components [J]. Life Sciences, 1999, 65(21): 241-246.
[31] 梁慧玲, 谭蓉, 杨秀芳. 茶提取物中儿茶素类和茶黄素类组成对酪氨酸酶抑制率的影响[C]//中国科学技术协会, 贵州省人民政府. 第十五届中国科协年会第20分会场: 科技创新与茶产业发展论坛论文集. 北京: 中国科学技术协会学会学术部, 2013: 169-172. Liang H L, Tan R, Yang X F.The inhibitory capability of tea extracts against tyrosine’s activity[C]//China Association for Science and Technology, Guizhou Provincial People's Government. The 20th parallel session of the 15th Annual Meeting of the Chinese Association for Science and Technology: Proceedings of the Forum on scientific and technological innovation and tea industry development. Beijing: Academic Department of the Association for Science and technology of China, 2013: 169-172.
[32] 周盈利, 刘静, 叶琼仙, 等. 茶黄素类化合物对酪氨酸酶的抑制作用[J]. 食品科技, 2014, 39(3): 169-172. Zhou Y L, Liu J, Ye Q X, et al. Inhibitory activies of different theaflavins against tyrosinase [J]. Food Science and Technology, 2014, 39(3): 169-172.
[33] 孙劲毅, 蔡春辉, 梁蓉, 等. 茶皂素的纯化及抑制酪氨酸酶活性的研究[J]. 日用化学工业, 2017, 47(6): 312-316. Sun J Y, Cai C H, Liang R, et al.Purification of tea saponin and its inhibition on tyrosinase activity [J].China Surfactant Detergent & Cosmetics, 2017, 47(6): 312-316.
[34] Kim Y C, Choi S Y, Park E Y. Anti-melanogenic effects of black, green, and white tea extracts on immortalized melanocytes [J]. Journal of Veterinary Science, 2015, 16(2): 135-143.
[35] 许兰, 张丹, 仝团团, 等. 茶树花提取物的抑菌和美白功效评价[J]. 天然产物研究与开发, 2018, 30(8): 1287-1293. Xu L, Zhang D, Tong T T, et al.Assessment on antibacterial and whitening effect of tea () flower extraction [J]. Nature Product Research and Development, 2018, 30(8): 1287-1293.
[36] 陈贞纯, 贾玲燕, 毛祖法, 等. 茶叶提取物对B16小鼠黑色素瘤细胞的生物学效应及机理研究[J]. 茶叶科学, 2014, 34(5): 465-472. Chen Z C, Jia L Y, Mao Z F, et al.Bio-efficacy of tea extract on mouse B16 melanoma cell in vitro and its mechanism [J].Journal of Tea Science, 2014, 34(5): 465-472.
[37] Kim E, Hwang K, Lee J, et al. Skin protective effect of epigallocatechin gallate [J]. International Journal of Molecular Science, 2018, 19(1): 173.doi: 10.3390/ijms19010173
[38] 张欣, 张伟伟, 张燕, 等. 茶溴香酰胺脂质体对黑色素瘤细胞生长和迁移的抑制作用[J]. 烟台大学学报(自然科学与工程版), 2019, 32(3): 262-270. Zhang X, Zhang W W, Zhang Y, et al.Inhibitory effect of TBrC-L on melanoma cell growth and migration [J].Journal of Yantai University (Natural Science and Engineering Edition), 2019, 32(3): 262-270.
[39] 岳学状. 部分天然植物成分对皮肤微循环、黑素合成以及VEGF分泌的影响[D]. 南京: 南京医科大学, 2006. Yue X Z. Effects of hesperidin, licorice and EGCG on skin microcirculation, melanogenesis and secretion of VEGF of keratinocytes [D]. Nanjing: Nanjing Medical University, 2006.
[40] Shaulian E, Karin M. AP-1 in cell proliferation and survival [J]. Oncogene, 2001, 20(19): 2390-2400.
[41] Chen W, Dong Z, Valcic S, et al. Inhibition of ultraviolet B-induced c-gene expression and p38 mitogen-activated protein kinase activation by (-)-epigallocatechin gallate in a human keratinocyte cell line [J]. Molecular Carcinogensis, 1999, 24(2): 79-84.
[42] Baldwin A S. The NF-kappa B and I kappa B proteins: new discoveries and insights [J]. Annual Review of Immunology, 1996, 14: 649-681.
[43] Ghosh S, May M J, Kopp E B. NF-kappa B and Rel proteins: evolutionarily conserved mediators of immune responses [J]. Annual Review of Immunology, 1998, 16: 225-260.
[44] Afaq F, Adhami V M, Ahmad N, et al. Inhibition of ultraviolet B-mediated activation of nuclear factor kappaB in normal human epidermal keratinocytes by green tea constituent (-)-epigallocatechin-3-gallate [J]. Oncogene, 2003, 22(7): 1035-1044.
[45] Balasubramanian S, Eckert R L. Keratinocyte proliferation, differentiation, and apoptosis: differential mechanisms of regulation by curcumin, EGCG and apigenin [J]. Toxicology and Applied Pharmacology, 2007, 224(3): 214-219.
[46] 兰海龙, 王正辉, 杨壮群, 等. 芦荟苦素对黑素细胞与角质形成细胞混合培养模型中黑素合成的影响[J]. 中国美容医学, 2007(3): 310-313. Lan H L, Wang Z H, Yang Z Q, et al.The effect of aloesin on melanocytes in the mixed cultivating model of keratinocytes and melanocytes [J]. Chinese Journal of Aesthetic Medicine, 2007(3): 310-313.
[47] Housman T S, Feldman S R, Williford P M, et al. Skin cancer is among the most costly of all cancers to treat for the Medicare population [J]. Journal of the American Academy of Dermatology, 2003, 48(3): 425-429.
[48] de Gruijl F R, Van der Leun J C. Estimate of the wavelength dependency of ultraviolet carcinogenesis in humans and its relevance to the risk assessment of a stratospheric ozone depletion [J]. Health Physics, 1994, 67(4): 319-325.
[49] Ichihashi M, Ueda M, Budiyanto A, et al. UV-induced skin damage [J]. Toxicology, 2003, 189(1/2): 21-39.
[50] Katiyar S, Elmets C A, Katiyar S K. Green tea and skin cancer: photoimmunology, angiogenesis and DNA repair [J]. The Journal of Nutritional Biochemistry, 2007, 18(5): 287-296.
[51] Huang M T, Xie J G, Wang Z Y, et al. Effects of tea, decaffeinated tea, and caffeine on UVB light-induced complete carcinogenesis in SKH-1 mice: demonstration of caffeine as a biologically important constitutent of tea [J]. Cancer Research, 1997, 57(13): 2623-2629.
[52] Wang Z Y, Huang M T, Lou Y R, et al. Inhibitory effects of black tea, green tea, decaffeinated black tea, and decaffeinated green tea on ultraviolet B light-induced skin carcinogenesis in 7,12-dimethylbenz[a]anthracene-initiated SKH-1 mice [J]. Cancer Research, 1994, 54(13): 3428-3435.
[53] Lu Y P, Lou Y R, Lin Y, et al. Inhibitory effects of orally administered green tea, black tea, and caffeine on skin carcinogenesis in mice previously treated with ultraviolet B light (high-risk mice) [J]. Cancer Research, 2001, 61(13): 5002-5009.
[54] Conney A H, Zhou S, Lee M, et al. Stimulatory effect of oral administration of tea, coffee or caffeine on UVB-induced apoptosis in the epidermis of SKH-1 mice [J]. Toxicology and Applied Pharmacology, 2007, 224(3): 209-213.
[55] Conney A H, Kramata P, Lou Y R, et al. Effect of caffeine on UVB-induced carcinogenesis, apoptosis, and the elimination of UVB-induced patches of p53 mutant epidermal cells in SKH-1 mice [J]. Photochemistry and Photobiology, 2008, 84(2): 330-338.
[56] 陆思千, 贾舒婷, 罗瑛. 突变p53功能研究新进展与个性化的肿瘤治疗新策略[J]. 遗传, 2011, 33(6): 539-548. Lu S Q, Jia S T, Luo Y.Recent advances inmutant p53 and novel personalized strategies for cancer therapy [J]. Hereditas, 2011, 33(6): 539-548.
[57] Lu Y P, Lou Y R, Li X H, et al. Stimulatory effect of oral administration of green tea or caffeine on ultraviolet light-induced increases in epidermal wild-type p53, p21(WAF1/CIP1), and apoptotic sunburn cells in SKH-1 mice [J]. Cancer Research, 2000, 60(17): 4785-4791.
[58] Lu Y P, Lou Y R, Peng Q Y, et al. Stimulatory effect of topical application of caffeine on UVB-induced apoptosis in the epidermis of p53 and Bax knockout mice [J]. Cancer Research, 2004, 64(14): 5020-5027.
[59] Choi S Y, Kim Y C. Whitening effect of black tea water extract on brown guinea pig skin [J]. Toxicology Research, 2011, 27(3): 153-160.
[60] 汪建, 杨长福, 王和生, 等. 茶多酚经皮给药对小鼠皮肤中酪氨酸酶活性的影响[J]. 中药药理与临床, 2013, 29(4): 82-83. Wang J, Yang C F, Wang H S, et al.Effects of transdermal drug delivery with tea polyphenols on the activity of tyrosine in the skin of mice [J].Pharmacology and Clinics of Chinese Materia Medica, 2013, 29(4): 82-83.
[61] Elmets C A, Singh D, Tubesing K, et al. Cutaneous photoprotection from ultraviolet injury by green tea polyphenols [J].Journal of the American Academy of Dermatology, 2001, 44(3): 425-432.
[62] Li Y H, Wu Y, Wei H C, et al. Protective effects of green tea extracts on photoaging and photommunosuppression [J]. Skin Research and Technology, 2009, 15(3): 338-345.
Inhibition of Active Compounds in Tea on Melanin Formation
WANG Wei1,2, CHEN Lin1,2, WANG Weiwei1, ZHANG Jianyong1, JIANG Heyuan1*
1. Tea Research Institute, Chinese Academy of Agricultural Sciences, Key Laboratory of Tea Plants Biology and Resources Utilization of Agriculture Ministry, Key Laboratory of Tea Processing Engineering of Zhejiang Province, Hangzhou 310008, China; 2. Graduate School of Chinese Academy of Agricultural Sciences, Beijing 100081, China
Melanin is a kind of high molecular biological pigment. The color of skin is determined by the type and accumulation of melanin as well as the redistribution and degradation of melanosome. Solar ultraviolet radiation is the most common cause of melanin formation. Although melanin can protect skin cells from UV damage, the abnormal accumulation of melanin will lead to diseases related with melanin disorders. Therefore, the development of green, safe and efficient melanin inhibitors extracted from plants has become a research hotspot in recent years. Many studies have proved that extract or monomer compounds of tea could significantly inhibit (a) the activity of tyrosinase, (b) the growth, proliferation, infiltration and metastasis of melanocytes, (c) the occurrence of skin cancer. In this paper, the research progress of tea active compounds inhibiting melanin formation in acellular tyrosinase test system, cell test system, animal model and human skin was reviewed to fully explore the key active compounds, find a safe and efficient inhibitor of melanin synthesis and provide reference for the comprehensive utilization of tea products and increasing the added value of tea industry.
tea active compounds, melanin, acellular tyrosinase test system, cell test system, animal model, human skin
S571;Q946.84+1
A
1000-369X(2021)01-007-12
2020-04-15
2020-05-25
国家自然科学基金(31670692)、国家重点研发计划项目(2017YFD04008)、中国农业科学院科技创新工程(CAAS-ASTIP-2020-TRICAAS)
王蔚,女,在读博士,主要从事茶叶化学与加工方面的研究,ww1040491839@163.com。*通信作者:jianghy@tricaas.com
(责任编辑:赵锋)
