血清PG G-17检测结合窄带成像放大内镜对早期胃癌的诊断价值
2021-02-06冀子中万里章燕红韩丰金夏乐月琴王霄腾费丽红
冀子中 万里 章燕红 韩丰 金夏 乐月琴 王霄腾 费丽红
胃癌是消化系统常见的恶性肿瘤,病死率居所有恶性肿瘤中第二位[1]。仅2015年我国新增胃癌病例近68万例,因胃癌死亡约50万例[2]。胃癌预后与分期相关,进展期胃癌患者术后5年生存率≤30%[3],早期胃癌患者经积极治疗5年生存率≥30%[4]。临床上,胃镜是诊断筛查胃癌的主要手段,窄带成像放大内镜(NBI+ME)用于早期胃癌的诊断已取得显著临床效果[5]。然而,设备依赖性、患者接受程度等因素较大规模限制胃镜在胃癌筛查中的应用。研究显示,血清胃蛋白酶原(PG)、胃泌素-17(G-17)水平可反映胃癌癌前病变,对胃癌的诊断有重要临床价值[6],且具有无创、简便易行等优点。本文结合窄带成像放大内镜,通过检测血清PG、G-17水平,评估血清PG、G-17单独及联合诊断对早期胃癌的诊断效果。
1 资料与方法
1.1 临床资料 选择2017年1月至2020年4月本院因上腹不适等上消化道症状就诊患者573例,男297例,女276例;年龄18~82岁,平均(54.4±11.1)岁。排除标准:(1)近期使用胃黏膜保护剂、H2受体拮抗剂及质子泵抑制剂;(2)严重重要脏器功能障碍;(3)严重精神病病史者;(4)出血倾向不能进行活检、内镜黏膜切除术及内镜黏膜下剥离术;(5)胃部手术史者(外科手术、内镜下剥离术等);(6)哺乳期、妊娠期妇女;(7)非自愿参与者。所有患者行血清PGⅠ、PGⅡ和G-17检测及普通白光胃镜检查,内镜下明显病变者行NBI+ME精查,可疑病变者再行靶向活检或内镜黏膜下剥离(ESD)。根据病理结果分为A组(非萎缩性胃炎组)、B组(胃癌癌前病变组)、C组(早期胃癌组)。本项目经本院伦理委员会批准,所有患者均签署知情同意书。
1.2 检查方法 (1)血清学检测:取受检者清晨空腹外周血5 ml于抗凝管内,于离心机中3000 r/min离心10 min(离心半径12 cm),吸取上层血清,以酶联免疫吸附试验定量检测血清PGⅠ、PGⅡ及G-17水平,计算PGⅠ/PGⅡ比值(PGR)。(2)胃镜及病理检查:患者检查前8~12 h禁饮食,检查前15 min口服利多卡因胶浆10 g、二甲硅油乳剂0.12 g/6 ml。采用Olympus GIFH290Z型胃镜行普通白光胃镜检查,于胃窦、胃体处常规取2块黏膜组织进行活检;内镜下明显病变者(颜色发红或变白,形态隆起或凹陷),按键转换后行NBI+ME精查;可疑病变者,再行靶向活检或内镜黏膜下剥离。将常规活检组织、靶向活检或ESD组织固定于10%中性福尔马林液中,制备成石蜡切片,由2名经验丰富的病理医师进行读片诊断。
1.3 统计学方法 采用SPSS 20.0统计软件。计量资料以M(Q1,Q3)表示,两组间比较采用t检验;以ROC曲线计算PGⅠ、G-17诊断胃癌最佳界值,计算PGⅠ、G-17及联合检测筛查胃癌的曲线下面积、95%置信区间、敏感度和特异度,采用Kruskal-Wallis检验;计数资料以n(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较 普通白光胃镜检查发现,明显及可疑病变218例,行NBI+ME精查,依据VS分类系统[7]进行早期胃癌判别,其中92例行靶向活检,126例行ESD术,检出早期胃癌63例。病理结果显示,非萎缩性胃炎387例,男186例,女201例,年龄18~77岁,平均(53.1±11.6)岁。胃癌癌前病变123例,男78例,女45例,年龄30~78岁,平均(55.6±9.1)岁。早期胃癌63例,男33例,女30例;年龄42~76岁,平均(57.4±9.5)岁。三组患者一般资料比较,差异无统计学意义(P>0.05)。
2.2 三组血清PGⅠ、PGⅡ、PGR及G-17水平比较 PGⅠ中位值98(83.4~123.8)μg/L,PGⅡ中位值为9.7(7.5~12.8)μg/L,PGR中位值为9.9(7.7~14.2),G-17中位值为8.5(6.4~11.8)pmol/L。与A组比较,B组和C组PGⅠ、PGR水平较低,G-17水平较高,差异均有统计学意义(P<0.05)。与B组比较,C组PGⅠ、PGR水平较低,G-17水平较高,差异有统计学意义(P<0.05)。见表1。

表1 三组血清PGⅠ、PGⅡ、PGR及G-17水平比较
2.3 血清PGⅠ、G-17单独及联合检测诊断早期胃癌的ROC分析 血清PGⅠ诊断早期胃癌的最佳临界值为70.1 μg/L,曲线下面积为0.937,敏感度和特异度分别为76.2%和88.4%;血清G-17诊断早期胃癌的最佳临界值为14.1 pmol/L,曲线下面积为0.723,敏感度和特异度分别为66.7%和93.5%;以血清PGⅠ≤70.1 μg/L、血清G-17≥14.1 pmol/L为标准,线下面积为0.946,敏感度和特异度分别为85.7%和96.5%。血清PGⅠ、G-17联合检测诊断早期胃癌的敏感度和特异度均显著高于单独诊断。见表2、图1。
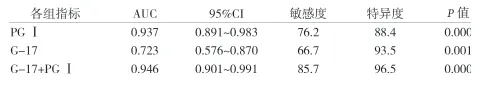
表2 血清PGⅠ、G-17单独及联合检测诊断早期胃癌的ROC分析
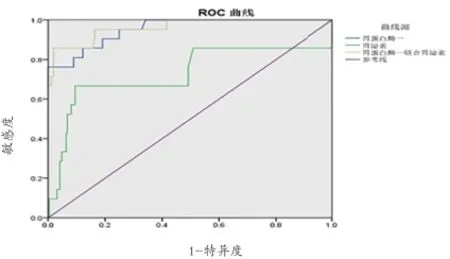
图1 血清PGⅠ、G-17单独及联合检测诊断早期胃癌的ROC曲线
2.4 三组血清指标异常检出情况比较 B组和C组血清指标异常检出率均高于A组,差异均有统计学意义(χ2=13.324,P=0.001;χ2=25.780,P=0.000);C组血清指标异常检出率高于B组,差异有统计学意义(χ2=6.283,P=0.043)。

表3 三组血清指标异常检出情况比较[n(%)]
3 讨论
1975年,CORREA等[8]提出胃癌发生的多步骤假设,即慢性胃炎→慢性萎缩性胃炎→胃黏膜肠上皮化生→胃黏膜异型增生→胃癌。目前,国内外多数学者均认为胃癌的发生、发展是一个多步骤、渐进的过程,胃癌前病变及早期胃癌的研究已渐成热点。
胃蛋白酶原(PG)是胃蛋白酶的无活性前体,有PGⅠ和PGⅡ两种亚型。PGⅠ主要由胃底腺的主细胞和颈黏液细胞分泌;PGⅡ由胃底腺分泌外,胃窦幽门腺和近端十二指肠Brunner腺也能分泌。PG是反映胃体黏膜泌酸功能的良好指标,因此也被称为“血清学活检”[9]。胃泌素-17(G-17)由胃窦G细胞分泌,可刺激胃酸分泌、促进胃黏膜细胞增殖与分化,是反映胃窦分泌功能的敏感指标之一,在胃癌的发生、发展过程中具有较强的促进作用[10]。PG、G-17水平可反映胃黏膜不同部位的形态和功能,当胃黏膜发生病变时,PG、G-17水平随之发生改变。胃黏膜出现萎缩性病变时,主细胞、腺体及胃窦G细胞数量明显减少[11],从而导致PGⅠ、G-17水平降低。胃癌多是由慢性胃炎、萎缩、肠化和异型增生逐级发展而来,因此PGⅠ和G-17检测可用于胃癌的筛查。
本资料结果显示,胃癌癌前病变组、早期胃癌组血清PGⅠ水平均低于非萎缩性胃炎组,PGⅠ诊断早期胃癌的界限值为70.1 μg/L,ROC曲线下面积为0.937,敏感度和特异度分别为76.2%和88.4%。胃癌癌前病变组和早期胃癌组血清G-17水平均高于非萎缩性胃炎组,G-17诊断早期胃癌的界限值为14.1 pmol/L,ROC曲线下面积为0.723,敏感度和特异度分别为66.7%和93.5%。黄广建等[12]研究表明,胃癌患者血清胃泌素水平较高,且与癌变部位、临床分期有关,胃底癌和胃体癌升高明显。因此,血清G-17水平升高可提示胃癌高风险,在临床诊断中有一定作用。
本文胃癌癌前病变患者和早期胃癌患者血清PGⅠ水平降低、PG Ⅱ水平升高不明显,表明胃黏膜自萎缩性病变发展至癌变的过程中,胃黏膜分泌能力下降。LORENTE等[13]研究认为,致癌因子使胚细胞中PG基因受损突变,从而失去分泌PGⅠ的能力,基因突变胚细胞又更新黏膜细胞,PGⅠ分泌持续降低。PGⅡ水平无明显变化,可能与分泌PGⅡ的细胞分布较为广泛有关。另外,本研究结果显示胃癌癌前病变、早期胃癌患者的血清G-17水平均升高,可能与癌变过程中胃酸分泌水平下降,胃内呈低酸状态,反馈性刺激胃窦部G细胞胃泌素分泌增加有关。
SHIOTANI等[14]研究表明,若以PG<45 ng/ml和G17>60 pg/ml为诊断标准,诊断胃癌的敏感度和特异度分别为83%和68%。本资料结果显示,以PGⅠ≤70.1 μg/L且G17≥14.1 pmol/L为诊断标准,早期胃癌检出率为88.9%,ROC曲线下面积为0.946,敏感度和特异度分别为85.7%和96.5%,高于PG或G-17单项诊断,故PGⅠ与G-17联合检测有助于早期胃癌的诊断。
根据2017年《中国慢性胃炎共识意见》[15],放大内镜结合染色能清楚显示胃黏膜微小结构,可指导活检。宋宝莹等[16]对可疑胃黏膜早期病变进行NBI+ME观察,提出NBI+ME指导靶向活检具有重要意义。本文所有研究对象进行血清学筛查后,在白光内镜发现可疑病变的基础上再行NBI+ME精查及靶向活检或ESD术,以提高胃癌癌前病变和早期胃癌诊断的精准性。
