干燥综合征并发神经系统病变的危险因素分析
2021-02-05李霞田真魏廉李赫赵义
李霞,田真,魏廉,李赫,赵义
首都医科大学宣武医院,北京100053
原发性干燥综合征(pSS)是一种以外分泌腺体受累为主的系统性自身免疫性疾病,常见系统受累包括白细胞减少、间质性肺病、肾小管酸中毒、自身免疫性肝炎、肌炎等,部分患者可有神经系统(NS)受累。pSS 的NS 病变表现复杂多样,可累及脑实质、脑膜、脊髓、周围神经等,严重者可出现意识障碍、截瘫、视力丧失及运动障碍等,如不及时干预,可遗留不可逆神经功能障碍,严重影响患者预后。虽然有关pSS并发NS病变的临床报道较多[1-3],但发生NS 病变的危险因素目前尚不清楚。本研究对142例pSS 患者进行回顾性分析,探讨pSS 并发NS 病变的危险因素,旨在为临床诊疗提供依据。
1 资料与方法
1.1 临床资料 回顾性分析2012 年1 月—2019 年1 月首都医科大学宣武医院住院收治的142 例pSS患者,男10 例、女132 例,发病年龄(49.9 ± 13)岁,中位病程48(11~120)个月。均符合2002 年pSS 国际分类标准[4],该标准包括口腔症状、眼部症状、口干症、干眼症的客观检查、唇腺活检病理及自身抗体抗SSA、抗SSB 共6 个方面,并排除继发于其他结缔组织病的干燥综合征。
1.2 pSS 并发NS 病变的判断方法 pSS 并发中枢神经系统(CNS)病变的定义:①具有CNS 损害的临床表现,如认知障碍、癫痫发作、肢体无力等;②辅助检查包括脑脊液检测、磁共振或脑电图提示异常;③除外其他可导致CNS 病变的其他疾病,如CNS 感染、肿瘤等。pSS并发周围神经系统(PNS)病变的定义:①具有PNS 损害的临床表现,如感觉异常(包括疼痛、麻木等)、运动障碍等;②肌电图提示PNS 损害;③除外其他可引起PNS 病变的情况,如糖尿病、甲状腺功能减低、椎间盘突出症、酗酒等。
1.3 pSS 并发NS 病变的影响因素收集与分析方法 通过住院病历记载,全面收集患者的临床资料,包括pSS相关腺体受累表现(包括口干症、干眼症)、其他器官系统受累情况如皮肤黏膜、关节、肺、血液系统及NS 等表现,实验室检查、病理检查以及肌电图、脑电图、影像学资料。采用欧洲抗风湿病联盟干燥综合征疾病活动度评分(ESSDAI)评估pSS 病情活动度,该评分涵盖12个器官系统:全身情况、淋巴结、腺体、皮肤、关节、肌肉、肺、肾脏、外周神经、中枢神经、血液系统及血清学指标。系统病变分为4 个活动水平,不活动为0分,低度活动为1分,中度活动为2 分,高度活动为3 分,病情活动分数为各个系统得分之和。自身抗体检测包括抗核抗体谱和抗水通道蛋白4(AQP4)、视神经脊髓炎—免疫球蛋白G(NMO-IgG)检测。抗核抗体谱采用免疫印迹法检测,包括抗ANA、SSA、SSB、Ro-52、nRNP、Sm、Scl-70、PM-Scl、Jo-1、CENP、PCNA、dsDNA、核小体、组蛋白、核糖体P蛋白、AMA M2共16项。抗水通道蛋白4(AQP4)和NMO-IgG 采用间接免疫荧光法检测,通过转染重组的AQP4 的人胚肾293(HEK293)细胞系表达AQP4肽段全长进行检测。采用SPSS19.0统计软件进行数据处理,对比并发与未并发NS病变患者的临床资料。计量资料采用Kolmogorov-Smirnov 法进行正态性检验,符合正态分布者以-x ± s 表示,组间比较采用独立样本t 检验;不符合正态分布者以中位数(四分位间距)表示,两组间比较采用Mann-Whitney检验。分类变量资料采用百分数表示,组间比较采用χ2检验或Fisher 精确概率法。影响因素分析采用二元Logistic 回归法。P<0.05 为差异有统计学意义。
2 结果
2.1 pSS 并发NS 病变的情况 142 例患者中,并发NS 病变46 例,未并发NS 病变96 例。并发NS 病变患者中,单纯并发CNS 病变36 例,其中视神经脊髓炎谱系疾病25 例,颅内脱髓鞘病变、脑膜炎各3 例,帕金森综合征2 例,认知障碍、多系统萎缩、中枢神经系统血管炎各1 例;单纯并发PNS 病变9 例,其中周围神经病7 例,格林巴利综合征和脊髓神经根病各1 例;同时并发CNS 和PNS 病变1 例,表现为脑脊髓神经根病。
2.2 pSS 并发与未并发NS 病变患者的临床资料比较 并发NS病变患者中,男5例、女41例,发病年龄(44.2 ± 11.7)岁,中位病程24(6.5~102)个月,中位ESSDAI 评分4(3~5)分;未并发NS 病变患者中,男5 例、女91 例,发病年龄(52.6±12.8)岁,中位病程66(12~120)个月,中位ESSDAI 评分2(1~3)分。两组pSS 相关器官受累的发生率见表1。与未并发NS 病变患者相比,并发NS 病变患者发病年龄低,病程短,ESSDAI 评分高,口干症及干眼症发生率低(P<0.05 或<0.01)。与未并发NS 患者比较,并发NS患者外周血白细胞减低的发生率降低,RF 滴度≤3倍上限的发生率升高(P<0.05或<0.01),见表2。并发NS 患者抗AQP4 抗体及抗NMO-IgG 抗体阳性率高于未并发NS者(P<0.01),见表3。

表1 pSS并发与未并发NS病变患者器官受累发生率比较(%)

表2 pSS并发与未并发NS病变患者白细胞、血沉、IgG、RF、C3、C4异常发生率比较(%)

表3 pSS并发与未并发NS病变患者自身抗体特征比较(%)
2.3 pSS 并发NS 病变的影响因素分析结果 将上述有统计学差异的因素纳入二元Logistic 回归方程,经多因素分析发现,年龄≤45 岁、病程≤4 年、RF 滴度升高≤3 倍上限、ESSDAI 评分>3 分是pSS 并发NS 病变的危险因素(P<0.05 或<0.01),而口干症是pSS并发NS病变的保护性因素。见表4。
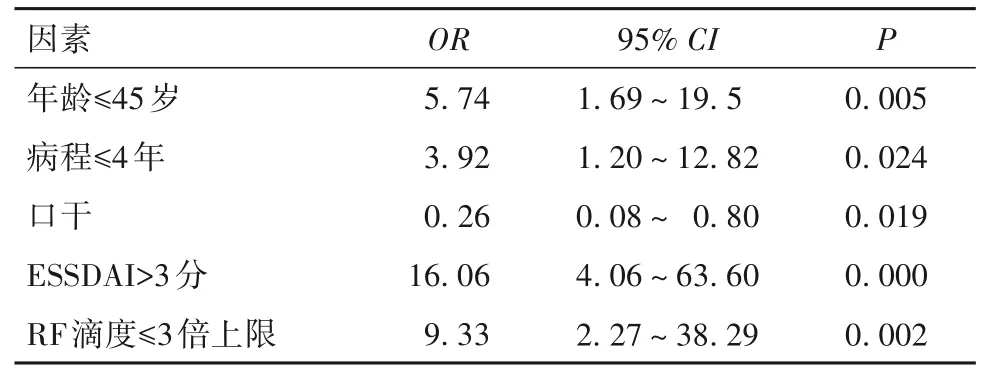
表4 pSS并发NS病变的二元Logistic多因素回归分析结果
3 讨论
文献报道,pSS并发NS的发生率波动于8.5%~70.0%[5]。总体而言,pSS 并发PNS 病变的发生率较并发CNS 病变的发生率高。CARVAJAL ALEGRIA等[6]的一项多中心前瞻性队列研究纳入395 例pSS患者,74 例(18.9%)并发NS 病变,其中并发PNS 病变63 例,并发CNS 病变14 例。国内相关研究较少,冯敏等[7]报道了86 例pSS 患者,其中并发PNS 病变22 例,占26%。费允云等[8]报道,pSS 并发CNS 病变者占同期住院pSS患者的4.1%(21/511)。文献报道的pSS 并发NS 病变的发生率差异较大可能与各研究纳入样本量大小、地区差异、参照的分类标准不同及pSS并发NS病变的定义不同等有关。本研究pSS并发NS病变的发生率为32.4%,略高于国外报道。
pSS 并发NS 病变表现复杂多样,CNS 病变主要累及脑、脊髓和视神经,脑部病变分为局灶性和弥漫性,可表现为失语/发音障碍、癫痫发作、头痛、认知障碍、急性或亚急性脑病、无菌性脑膜炎、脑卒中及运动障碍等。脊髓受累常见横贯性脊髓炎,可表现为四肢瘫、截瘫、括约肌功能障碍等,部分患者可出现球后视神经炎,导致视力下降甚至视力丧失[9],部分起病急骤,进展迅速,因此对于pSS 患者NS 病变的及时准确识别并及早干预,可避免遗留功能障碍。我院单中心回顾性数据显示,pSS 并发CNS 病变的表现形式更为多样化,包括视神经脊髓炎谱系疾病、头痛伴颅内脱髓鞘病变、无菌性脑膜炎、帕金森综合征、认知障碍、癫痫发作、脑卒中、多系统萎缩,并有1 例同时并发CNS 和PNS 病变,表现为脑脊髓神经根病。pSS 患者PNS 病变表现以周围神经病多见,包括远端轴突感觉性多神经病、感觉运动性多神经病、慢性炎症性脱髓鞘性多发性神经病、多发性单神经病、感觉性神经病和小纤维神经病变。另外,多发性神经根神经病类似格林-巴利综合征也有报道。本研究有7 例为周围神经病,另有1 例符合格林-巴利综合征,1例为脊髓神经根病。
本研究发现,与未并发NS 病变的pSS 患者比较,并发NS病变患者发病年龄低、病程短、疾病活动度高,而口干症、干眼症发生率低,提示pSS 并发NS病变患者的口干、干眼症状并不突出,与国内报道类似[3]。进一步行二元Logistic 回归分析发现,口干症状是pSS 并发NS 病变的保护因素,这与临床上并发NS病变患者主诉口干者比例较少相一致,因此更易被临床医生忽视pSS的存在。而年龄≤45岁、病程≤4年、ESSDAI 评分>3 分是pSS 并发NS 病变的危险因素,因此对于发病4年之内、持续病情高度活动的年轻pSS 患者,应警惕NS 病变的发生,及早识别及干预,有助于改善预后。研究发现,约1/3 的pSS 患者在确诊前就已经出现NS 病变,而另2/3 的患者则在确诊pSS的同时发现NS损害[6]。因此,对存在NS病变的患者,尤其首诊神经内科时,虽无明确口干、眼干的症状,应及时完善口腔科、眼科的客观检查,行免疫学指标的筛查甚至唇腺活检,有助于早期明确诊断,避免延误诊治。
pSS 的典型表现除了口干、眼干等腺体受累外,血白细胞减少、RF滴度升高、间质性肺病、肾小管酸中毒等较为常见[10]。本研究结果显示,与未并发NS病变的pSS 患者比较,并发NS 病变患者出现白细胞降低、RF 滴度降低的发生率较低,提示pSS 并发NS病变患者干燥综合征的相关表现并不典型,易漏诊。而血清抗AQP4阳性率高于普通pSS患者,这与本组患者并发视神经脊髓炎谱系疾病者比例高有关。二元Logistic回归分析证实,RF滴度≤3倍上限是pSS并发NS发病的独立危险因素,具有临床指导价值。
目前pSS 并发NS 病变的发生机制尚未明确,研究证实,血管炎与单神经病、多发单神经病的发生密切相关,血管炎可直接导致神经损害,血管壁的炎性介质可导致血管内皮细胞纤维素样坏死、血管闭塞继而导致组织缺血和神经病变的发生[11]。但血管炎仅发生在10%的pSS 患者中[12]。另外,B 细胞、自身抗体产生也是重要的发病机制。MOLL 等[13]在干燥综合征并发NS 病变的患者血清中发现了针对神经组织抗原的各种反应类型。DUDA 等[14]发现,抗stathmin-4 与多种神经病相关。另有研究表明,抗M3 毒蕈碱受体抗体可能与自主神经功能障碍相关[15]。而作为视神经脊髓炎谱系疾病的特异性抗体,抗AQP4 抗体在发病机制中起重要作用[16]。也有研究认为,pSS 并发CNS 病变的主要病理改变是轴突变性、肿胀及海绵样变性。YAGUCHI等[17]通过尸检发现,pSS 患者有多灶性脊髓损伤,伴有广泛血管周围淋巴细胞浸润,而脑白质中存在脱髓鞘、轴突肿胀及海绵样变性表现。
综上所述,pSS 并发NS 病变的临床表现形式复杂多样;年龄≤45岁、病程≤4年、RF滴度升高≤3倍上限和ESSDAI 评分>3 分是pSS 并发NS 的危险因素,应引起风湿科及神经内科的共同重视,避免漏诊及误治。目前有关pSS 并发NS 病变的类型和分类标准尚缺乏统一认识,发病机制尚未阐明。我院单中心回顾性研究,因病例数少,纳入因素为确诊NS 病变时的指标有一定的局限性,对于pSS 患者出现NS病变的危险因素,仍需要多中心、大样本、前瞻性队列研究进一步探索证实。
