早期糖尿病肾病患者血清CTRP9水平变化及其与25(OH)D的相关性
2021-02-05童梦霞郭久畅张琳王茜张晗章莹岳瑜廖鑫高琳
童梦霞,郭久畅,张琳,王茜,张晗,章莹,岳瑜,廖鑫,高琳
遵义医科大学附属医院,贵州遵义563003
糖尿病肾病(DN)是糖尿病最常见、最严重的微血管并发症之一,其发生机制十分复杂,治疗效果不理想,因此早期预防尤为重要。C1q/肿瘤坏死因子相关蛋白9(CTRP9)是近年新发现的脂肪因子,与脂联素(APN)具有高度同源性[1],在调节代谢、保护血管内皮、抗动脉粥样硬化、保护心脏、抗炎等方面有重要作用[2]。CTRP9 可抑制肾小球和肾小管糖原积累,缓解高血糖介导的氧化应激和细胞凋亡,从而改善肾功能不全[3]。研究表明,25(OH)D 在肥胖、胰岛β 细胞功能调控、氧化应激等方面发挥重要作用,且其水平可能影响DN 严重程度[4]。本研究通过观察单纯糖尿病和早期DN 患者血清中CTRP9、25(OH)D水平变化,探讨两者相关性。
1 资料与方法
1.1 临床资料 选取2019 年9 月—2020 年5 月我院收治的169 例2 型糖尿病患者,均符合WHO 1999年制定的诊断标准。排除标准:其他类型糖尿病;恶性肿瘤病史及使用激素药物史;其他原因引起的肾脏病变及肾功能不全;合并骨质疏松及其他骨代谢异常;甲状腺及甲状旁腺疾病;1 个月内使用过降糖或降脂药物;3 个月内使用过维生素D 及钙剂;急慢性感染、糖尿病相关急性并发症;绝经期女性。根据中国2 型糖尿病防治(2017 年版)标准[5],将患者分为单纯糖尿病组(T2DM 组,UACR<30 mg/g)88 例和早 期DN 组(DN 组,UACR 30~300 mg/g)81 例。T2DM 组男28 例、女60 例,年龄(51.71±10.57)岁;DN 组男25 例、女56 例,年龄(52.32 ± 10.73)岁。另择65 例健康体检者作为正常对照组,男21 例、女44 例,年龄(53.08±9.65)岁。三组性别、年龄具有可比性。三组其他临床资料比较见表1。本研究获本院医学伦理委员会批准,研究对象均知情同意。
1.2 血清CTRP9、25(OH)D 检测方法 采集受试者清晨空腹静脉血,采用电化学发光法测定25(OH)D,试剂购于德国罗氏公司;酶联免疫吸附法(ELISA)测定空腹血清CTRP9 水平,试剂盒购自上海江莱生物科技有限公司。
1.3 早期DN 患者血清CTRP9 与25(OH)D 水平的相关性分析方法 采用SPSS23.0 统计软件进行数据处理。符合正态分布的数据以±s 表示,不符合正态分布的数据以M(Q25,Q75)表示;多组间比较采用单因素方差分析,组间两两比较方差齐的采用LSD 法,方差不齐采用Dunnett"s T3法。正态分布采用Pearson相关分析,非正态分布采用Spearman相关分析;CTRP9 的影响因素分析采用多元逐步回归分析。P<0.05为差异有统计学意义。
表1 三组临床资料比较[±s/M(Q25,Q75)]

表1 三组临床资料比较[±s/M(Q25,Q75)]
注:与正常对照组比较,*P<0.05;与T2DM组比较,#P<0.05。
?
2 结果
2.1 三组血清CTRP9、25(OH)D 水平比较 与正常对照组比较,T2DM组和DN组血清CTRP9、25(OH)D 均降低(P 均<0.05);与T2DM 组比较,DN 组血清CTRP9、25(OH)D降低(P均<0.05)。见表2。
表2 三组血清CTRP9、25(OH)D比较(ng/mL,±s)
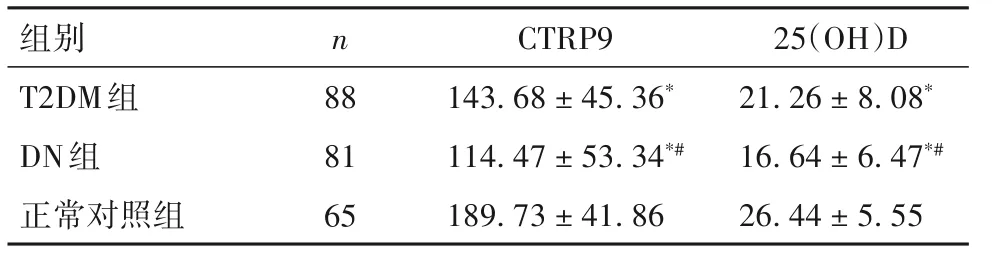
表2 三组血清CTRP9、25(OH)D比较(ng/mL,±s)
注:与正常对照组比较,*P<0.05;与T2DM组比较,#P<0.05。
?
2.2 血清CTRP9 水平与早期DN 患者25(OH)D 及其他临床特征的相关性 血清CTRP9 与病程、BMI、FPG、FINS、TG、HbA1c、HOMA-IR、UACR 呈负相关(r分别为-0.290、-0.253、-0.463、-0.171、-0.192、-0.374、-0.339、-0.316,P 均<0.05),与HDL-C、eGFR、25(OH)D 呈正相关(r 分别为0.253、0.210、0.683,P 均<0.05)。以CTRP9 为因变量,以病程、BMI、FPG、FINS、TG、HDL-C、HbA1c、HOMA-IR、UACR、eGFR、25(OH)D 为自变量,进行多元逐步回归分析。结果显示,25(OH)D(X1,β=0.593,P<0.01)、FPG(X2,β=-0.244,P<0.01)是CTRP9 的独立影响因素。回归方程YCTRP9=95.820+0.593X1-0.244X2。见表3。

表3 血清CTRP9影响因素的多元逐步线性回归分析
3 讨论
CTRP9 与APN 有相似的球状结构域和代谢功能,在所有CTRP 旁系同源物中,CTRP9 显示与APN的氨基酸序列同一性最高,因此CTRP9 的代谢调节作用与APN 类似。CTRP9 是一种保护性脂肪因子,可减少氧化应激,保护血管内皮功能,其水平升高是终末期DN 血管钙化的保护因素[6]。FUJITA 等[7]认为,血清CTRP9 可能是糖尿病患者肾血管损伤的生物标志物。CTRP9 过表达可降低细胞外蛋白质沉积,抑制肾小球硬化、肾小管间质纤维化、高血糖介导的氧化应激,从而延缓DN 进展[3]。DN 以肾小球损害为主,eGFR 反映了肾小球滤过功能,UACR 是DN 的诊断依据。本研究结果显示,DN 组血清CTRP9水平明显低于T2DM组,且CTRP9与eGFR呈正相关,与UACR 呈负相关。提示T2DM 在发展为早期DN 的过程中CTPR9 降低,同时eGFR 降低、UACR升高,表明CTRP9可能在早期DN的发生发展中起保护作用。
有研究表明,CTRP9 基因敲除小鼠更易形成胰岛素抵抗[8]。PETERSON 等[9]报道,高脂肪饮食诱导的肥胖小鼠血清CTRP9 水平降低了50%,CTRP9 转基因小鼠体内所需的胰岛素量明显减少,胰岛素敏感性增加,过表达CTRP9 的小鼠在外周组织中的葡萄糖处置率升高,因此血糖浓度更低。CTRP9 通过刺激AMPK、Akt、p44/42 等通路,增加线粒体的生物合成和脂肪氧化,并且过表达CTRP9 的转基因小鼠骨骼肌线粒体含量更高,加快机体新陈代谢,从而降低血脂浓度[10]。以上研究均表明,CTRP9 与糖脂代谢及胰岛素抵抗密切相关。本研究结果显示,T2DM 组及DN 组血清CTRP9 水平均低于正常对照组,DN 组最低,且CTRP9 与BMI、FPG、FINS、TG、HbA1c、HONMA-IR 呈负相关,FPG 是CTRP9 水平升高的独立影响因素。进一步说明CTRP9 与糖脂代谢、胰岛素抵抗密切相关。
维生素D 在维持β 细胞功能、胰岛素产生和分泌及组织对胰岛素的敏感性中起一定作用。有研究显示,维生素D 与糖尿病多种慢性并发症存在相关性,认为维生素D 缺乏的糖尿病患者罹患肾病的风险升高[11]。维生素D 也可以抑制肾素分泌,减少氧化应激和增加肾脏抗氧化能力,其干预治疗的慢性肾脏病患者的尿白蛋白水平有所下降,并且能显著减少足细胞丢失和凋亡、抑制肾小球纤维化[12]。本研究结果显示,DN 组25(OH)D 显著低于T2DM 组,表明25(OH)D与糖脂代谢、胰岛素抵抗、DN密切相关。
目前,国内外尚无相关研究直接显示CTRP9 与25(OH)D 之间代谢的关系。本研究结果显示,CTRP9 与25(OH)D 呈 正 相 关,且25(OH)D 是CTRP9 水平升高的独立影响因素。我们推测,CTRP9与25(OH)D 可能存在的关系包括:①CTRP9与APN的氨基酸序列同一性最高,有动物研究发现维生素D可能通过增加脂肪组织中APN mRNA 表达来提高APN 水平[13],CTRP9 可能与维生素D 存在类似的关系;②CTRP9可降低肿瘤坏死因子α(TNF-α)诱导的NF-κB 活化以及细胞间黏附分子1(ICAM-1)、血管细胞黏附分子1(VCAM-1)和单核细胞趋化蛋白1(MCP-1)表达[14],维生素D 可以通过抑制NF-κB,抑制高糖诱导的血管紧张素,从而减轻肾损害[15];③CTRP9可通过激活AMPKa 信号通路、下调TGF-β 抑制成纤维细胞成熟[16],维生素D 也可抑制转化因子β(TGF-β),从而阻止肾脏纤维化,减轻DN的肾脏损害[15]。因此推测,CTRP9与25(OH)D 在降低炎症反应及减轻肾脏损害方面具有相似的作用,CTRP9 与25(OH)D降低共同参与了早期DN的发生发展。
综上所述,早期DN 患者血清CTRP9、25(OH)D水平均降低,25(OH)D 是CTRP9水平升高的独立保护因素;CTRP9与25(OH)D 降低可能共同参与了早期DN的发生发展,其具体机制有待进一步研究。
