空腹血糖受损患者KCNB1 基因rs1051295 位点多态性与特异组织胰岛素抵抗的关系
2021-02-05文静翟琪张艺博何燕
文静翟琪张艺博何燕
1 首都医科大学公共卫生学院,北京100069;2 临床流行病学北京市重点实验室
糖尿病的危险因素包括环境因素(如饮食模式、 生活方式等)、遗传因素和表观修饰等,2 型糖尿病(T2DM)的遗传度为30%~70%[1]。目前,连锁分析、候选基因法和全基因组关联研究(GWAS)已经成功确认了全球主要人种的100 多个T2DM 易感基因,其中大部分在欧洲人群中发现[2]。Li 等[3]报道,中国汉族人群PAX4 rs10229583 多态位点在胰岛β细胞发育过程中起关键作用,可能会使T2DM 风险增加18%。KCNB1基因编码由857个氨基酸组成的电压门控性钾通道2.1亚型(Kv2.1通道),主要分布于脑皮质、海马等脑内组织,心房、心室、骨骼肌、肺动脉平滑肌等肌肉组织,胰岛β 细胞及视网膜等[4]。其主要功能是控制膜电位,参与神经及内分泌物质的释放、细胞的分化、活化、增殖及凋亡等生理过程。我们的前期研究显示,中国汉族人群中KCNB1基因3"非翻译区(3" UTR)的rs1051295 位点的基因多态性与T2DM 的发生相关,基因型TT 通过降低外周胰岛素敏感性进而导致T2DM 的发病风险升高[5]。由于外周胰岛素抵抗来源于特异组织,在人体内最主要的胰岛素敏感组织包括肝脏、肌肉和脂肪组织[6];因此我们推测,KCNB1 基因rs1051295 位点多态性与胰岛素敏感的特异组织即肝脏和骨骼肌组织胰岛素抵抗之间可能存在关联。本研究探讨了空腹血糖受损患者KCNB1 基因rs1051295 位点基因多态与特异组织胰岛素抵抗之间的关联,旨在识别rs1051295 发挥其功能影响胰岛素敏感性的特异组织。
1 资料与方法
1.1 临床资料 选择2010年9月—2010年11月在北京宣武医院就诊的76例空腹血糖受损患者,其中男33例、女43例。纳入标准:空腹血糖6.1~7.0 mmol/L,收缩压(SBP)<140 mmHg,舒张压(DBP)<90 mmHg,BMI 18.5~24.0 kg/m2。排除肿瘤、器质性疾病患者及妊娠妇女。本研究经首都医科大学伦理委员会批准,研究对象均知情同意。
1.2 KCNB1基因rs1051295位点多态性检测 禁食8~12 h后,采集肘静脉血2 mL,加入EDTA 抗凝管中,-4 ℃冰箱保存,用于提取全血DNA。①基因组DNA 提取:使用TaKaRa 的全基因组DNA 提取试剂盒,按操作说明进行基因组DNA 的提取。②引物合成:根据基因库(GeneBank)上公布的KCNB1基因序列(http://www. ncbi. nlm. nih. gov/pubmed/)设计引物,此序列在GeneBank 中的编号为NT_002370。运用Primer5软件设计引物,引物由上海生工生物工程技术服务有限公司合成。上游引物:biotin-GCGCAAAACCCTTACTCAAAT,下 游 引 物 :GCCAGGGGGCAATTAGAAT。③基因型检测:扩增目的基因片段,PCR 反应体系(50 μL):100 ng 基因组DNA,0.5 pmol 引物,2×Master Mix(反应缓冲液,MgCl2和DNA 聚合酶,日本ToYoBo)。反应条件:95 ℃预变性2 min,95 ℃30 s,59 ℃30 s,72 ℃1 min,40 个循环,最后72 ℃延伸10 min。1.5%琼脂糖凝胶电泳鉴定PCR产物。使用PSQ96全自动焦磷酸测序仪进行基因型测定及分型。取PCR扩增产物制备生物素标记的单链DNA模板,再将洗脱分离的单链DNA 模板在PSQ96 Plate 内与测序引物混合,80 ℃孵育2 min,自然冷却至室温后放入PSQ96MA 仪器上进行等位基因序列测定。通过PSQ96MA 系统进行等位基因分型分析,将实际所得测序峰图与软件自动生成的3 种基因型对应的模式峰图比较,最终判断该样本的基因型。基因分型检出率为100%(76/76)。在5%的随机样品中重复进行基因分型以进行验证和质量控制,基因型数据错误率<1%。
1.3 糖耐量检查及肝脏组织胰岛素抵抗指数(Hepa-IRI)和骨骼肌组织胰岛素敏感指数(Mus-ISI)测算 患者禁食10 h后,口服75 g葡萄糖溶液,实施OGTT,检测0、30、60、120 min 的血糖(Glu0、Glu30、Glu60、Glu120)和 胰 岛 素(Ins0、Ins30、Ins60、Ins120)。根据血糖和胰岛素浓度绘制曲线,计算曲线下面积(AUC)。Hepa-IRI=GlutAUC(0-30)×InstAUC(0-30),GlutAUC(0-30)和InstAUC(0-30)分别为OGTT 前30 min 内血糖 和胰 岛素 的AUC。Mus-ISI=(dG/dt)/I,dG/dt 为OGTT 血糖浓度从最高峰到最低点的衰减速率,I 为OGTT过程中血浆平均胰岛素浓度[6]。
1.4 统计学方法 采用Epidata、SPSS23.0 软件进行数据分析。计数资料以百分数表示,组间比较采用χ2检验;正态分布的计量资料以±s表示,组间比较采用t检验或方差分析;偏态分布的计量资料以中位数(M)和四分位间距(P25,P75)表示,组间比较采用秩和检验。正态性检验采用Kolmogorov-Smirnov 检验,对不符合正态分布的计量资料采用log变换。采用多重线性回归模型分析不同基因型与Heap-IRI和Mus-ISI 的关联,并校正T2DM 相关的性别、年龄和BMI 等因素对其的影响,给出偏回归系数(b)及95%可信区间(95%CI)。P<0.05为差异有统计学意义。
2 结果
2.1 KCNB1 基因rs1051295 位点多态性检测结果KCNB1 基因的rs1051295 位点存在T 和C 两种等位基因,基因频率分别为50.65%(77/152)、49.35%(75/152)。TT、TC、CC 基因型的分布频率分别为23.68%(18/76)、53.95%(41/76)和22.37%(17/76)。
2.2 KCNB1 基因rs1051295 位点不同基因型Hepa-IRI、Mus-ISI 比较 由于TC 和CC 基因型的Hepa-IRI、Mus-ISI 水平相近,为了观察TC 与CC 的累加效应,我们将TC+CC 进行联合分析。TT 基因型Hepa-IRI 高于TC、CC、TC+CC,Mus-ISI 低于TC、CC、TC+CC(P均<0.05),TC与CC比较差异无统计学意义(P均>0.05)。见表1。

表1 KCNB1基因rs1051295位点不同基因型患者Hepa-IRI、Mus-ISI比较[M(P25,P75)]
2.3 KCNB1基因rs1051295位点不同基因型患者的临床资料比较 见表2和表3。TT、TC、CC基因型之间比较以及TT与TC+CC 比较,性别、年龄、BMI、TC、TG、SBP、DBP、血糖均无统计学意义(P 均>0.05)。OGTT 结果显示,TT 基因型Ins30 水平高于TC、CC、TC+CC,Ins120水平高于CC和TC+CC(P均<0.05)。
表2 KCNB1基因rs1051295位点不同基因型患者的性别、年龄、BMI、血压、血脂比较[mmol/L,±s/M(P25,P75)]

表2 KCNB1基因rs1051295位点不同基因型患者的性别、年龄、BMI、血压、血脂比较[mmol/L,±s/M(P25,P75)]
?
表3 KCNB1基因rs1051295位点不同基因型患者的血糖、胰岛素比较[±s/M(P25,P75)]
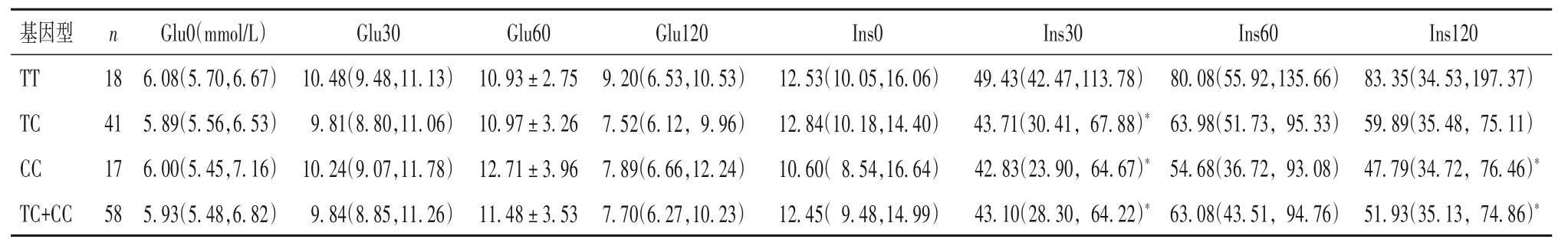
表3 KCNB1基因rs1051295位点不同基因型患者的血糖、胰岛素比较[±s/M(P25,P75)]
注:与TT基因型比较,*P<0.05。
?
2.3 KCNB1 基因rs1051295 位点不同基因型与Hepa-IRI、Mus-ISI 的相关性 见表4。将基因型TT 分别与TC、CC 和TC+CC 相比较,结果显示基因型TT 与Hepa-IRI 存 在 正相关、与Mus-ISI 存在负相关。校正性别、年龄、BMI 后,将基因型TT分别与TC、CC 和TC+CC 相比较,结果显示基因型TT 与Hepa-IRI 存 在 正 相 关、与Mus-ISI 存 在 负相关。
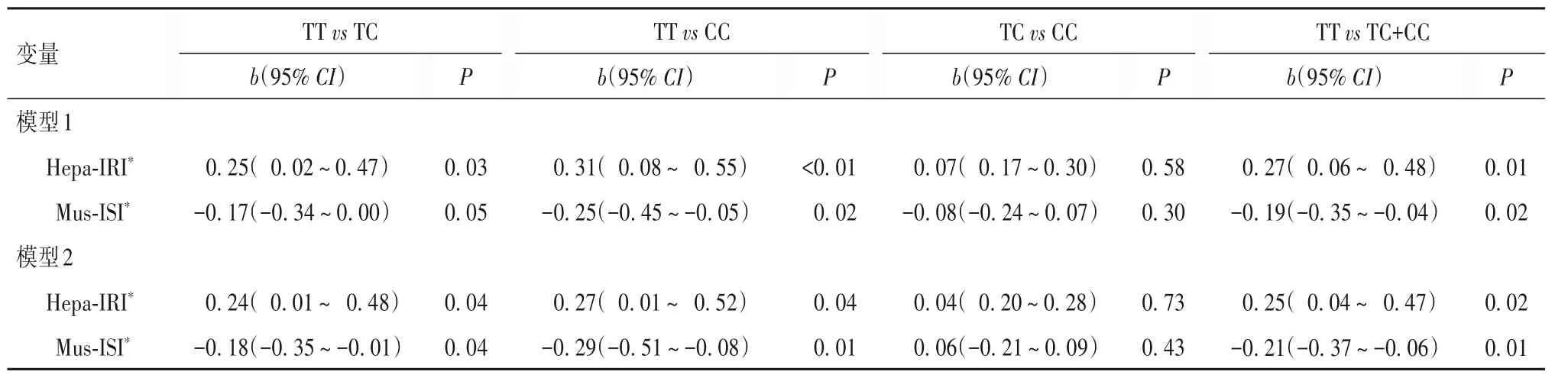
表4 rs1051295位点不同基因型与Hepa-IRI及Mus-ISI的相关性
3 讨论
外周组织胰岛素抵抗是2 型糖尿病的重要病理生理学机制,特异组织胰岛素抵抗是外周组织胰岛素抵抗的重要来源[6]。我们的前期研究证实,KCNB1 基因rs1051295 位点多态性与外周组织胰岛素抵抗之间存在关联[5]。本研究结果显示,空腹血糖受损患者KCNB1 基因rs1051295 位点的TT 基因型与TC、CC 和TC+CC 相比较,Hepa-IRI 和Mus-ISI水平升高,在校正性别、年龄和BMI 后,TT 基因型与Hepa-IRI 正相关、与Mus-ISI 负相关,即TT 基因型与Hepa-IRI 升高、Mus-ISI 降低相关。表明TT 基因型与特异组织胰岛素抵抗存在关联。
Kv2.1 通道由KCNB1 基因编码,其主要功能是控制膜电位,参与神经及内分泌物质的释放、细胞的分化、活化、增殖及凋亡等生理过程[4]。KCNB1基因多态性可能会影响Kv2.1通道表达量及细胞膜上功能性通道的组装[7],与多种疾病相关。美国一项针对高血压疾病的研究发现,在非裔美国人群中,位于KCNB1 内含子区的rs756529 位点与左心室肥厚有关,提示高血压患者左心室肥厚发展的潜在机制[8]。另一项研究证实,在日本人群中,位于KCNB1 外显子区的1071 C>T 以及768 G>A 位点突变与长QT 间期综合征发生相关[9]。PEREZ 等[10]研究显示,位于KCNB1 编码区的c. 1133T>C 位点突变与特发性癫痫脑病的发病直接相关,该变异导致Kv2.1 V378A通道表达以及亚细胞定位缺陷是癫痫脑病的遗传病病因之一。除此之外,美国另一项GWAS 研究还报道了位于KCNB1 的3" UTR 的rs1051295 位点通过与HLA-DRB1基因的相互作用而与风湿性关节炎相关,为Kv2.1 通道蛋白与炎症反应相关的作用机制提供了遗传学证据支持[11]。在人类[12-13]和啮齿动物[12,14]中,由KCNB1 编码的Kv2.1 通道是主要的β细胞Kv 通道,70%的K+由此外流,小鼠Kv2.1 缺失会引起严重的胰岛素释放和血糖紊乱。我们的前期研究显示,编码Kv2.1 通道蛋白的KCNB1 基因rs1051295位点TT基因型与外周胰岛素抵抗相关[5],TT通过降低外周胰岛素敏感性导致T2DM的发病风险增高。进一步探讨KCNB1 基因多态与脂代谢和胰岛素抵抗之间的关联,发现许多KCNB1基因非连锁标签基因多态性与TC、TG、LDL 和外周胰岛素抵抗相关,提示KCNB1 基因编码的Kv2.1 通道蛋白可能参与脂代谢的调控过程,进而影响胰岛素敏感性[15],为深入认识遗传因素在T2DM 发病过程中的作用提供了依据。
本研究结果显示,基因型TT 在OGTT 30 min 时Ins 水平均高于TC 和CC,并且TT 在30 min 和120 min 时Ins 水平高于TC+CC。这可能与胰岛素抵抗导致的β细胞代偿分泌胰岛素相关。空腹血糖异常与肝脏组织胰岛素抵抗相关,餐后血糖异常与脂肪组织胰岛素抵抗相关。TT 基因型与肝脏组织胰岛素抵抗相关,肝脏组织胰岛素抵抗导致过多的肝糖原分解成甘油和葡萄糖,引起空腹血糖的升高,进一步引起β 细胞代偿分泌胰岛素,引起高胰岛素血症[16]。骨骼肌组织胰岛素敏感性降低引起骨骼肌组织胰岛素抵抗,导致糖原无法储存在骨骼肌组织中,引起餐后血糖升高,导致胰岛素代偿分泌,引起胰岛素水平升高[6]。肝脏和骨骼肌组织的胰岛素抵抗进一步促进外周组织胰岛素抵抗,血糖水平升高和胰岛素分泌增加进一步加重,最终导致β 细胞功能的失代偿,引起T2DM的发生。
综上所述,空腹血糖受损患者KCNB1 基因rs1051295 位点TT 基因型与特异组织胰岛素抵抗存在关联;KCNB1 基因rs1051295 位点TT 基因携带者肝脏和肌肉组织胰岛素抵抗风险显著升高。本研究存在的局限性:首先,样本量较少,未来需要在大样本的人群中验证这种关联;其次,本研究是在汉族人群中进行的,是否在其他的种族也存在这样的关联尚不清楚;最后,由于数据收集过程缺乏游离脂肪酸等指标,因此无法对脂肪组织胰岛素抵抗指数进行计算,故本研究只纳入了肝脏和肌肉组织胰岛素抵抗,下一步我们将继续研究TT基因型与脂肪组织胰岛素抵抗的关联。
