超高效液相色谱法测定人血清中伏立康唑血药浓度与临床应用
2021-02-05陈君黄春新王敏
陈君,黄春新,王敏
海南省人民医院&海南医学院附属海南医院药学部,海南 海口 570311
伏立康唑是临床常用的可口服和静脉制剂的三唑类抗真菌药物,对念珠菌属、曲霉菌属、足放线菌属和镰刀菌属都有抗菌作用,美国感染病学会(Infectious Diseases Society of America,IDSA)指南推荐首选伏立康唑用于治疗和预防侵袭性真菌感染。伏立康唑主要在肝脏通过细胞色素P450酶系代谢,因其代谢具有饱和性,呈非线性药代动力学特点,随着给药剂量的增加,药物-时间曲线下面积(AUC)升高的比例远大于给药剂量增加的比例,过低浓度临床上常表现为治疗效果不佳或失败,过高浓度易诱导不良反应的发生[1]。通过对已有的研究文献调研分析发现患者个体化差异对最终临床疗效影响显著。因此,在一些重症患者人群中,实时监测患者体内伏立康唑血药浓度的变化十分必要。通过建立超高效液相色谱法(ultra performance liquid chromatography,UPLC)测定人血清中伏立康唑浓度,结合患者个体化差异,协助临床优化给药方案,以促进其在临床治疗过程中的合理使用。
1 材料与方法
1.1 仪器 十万分之一分析天平(德国Sartorius公司),Waters UPLC H-CLASS超高效液相色谱仪,Waters PDA检测器,Empower 2数据采集处理软件(Waters Corporation);WH-2微型旋涡混合仪(上海沪西分析仪器厂有限公司);MDF-382E超低温保存箱(三洋科研医疗设备公司);R20医用高速冷冻离心机(安新县白洋离心机厂)。
1.2 药品与试剂 伏立康唑对照品(上海源叶生物科技有限公司,批号B25090,HPLC纯度≥98%);磷酸二氢钾(KH2PO4,分析纯,西陇化工股份有限公司,批号 1411021);乙腈(CH3CN,Avantor Performance Materials,批号0000169419,UPLC色谱纯);纯化水由Milli-Q Advantage A10纯水机(美国Millipore公司)制备。空白血清来自健康人群。
1.3 溶液的配置
1.3.1 伏立康唑储备液1 精密称取30 mg伏立康唑标准品,乙腈溶解并定容至10 mL容量瓶,即制成3 mg/mL伏立康唑储备液1,于4℃冰箱中储存。
1.3.2 伏立康唑储备液2 精密量取2 mL 3 mg/mL伏立康唑储备液1至100 mL容量瓶中,用乙腈稀释定容至100 mL,即制成60 μg/mL伏立康唑储备液2,于4℃冰箱中储存。
1.3.3 血清伏立康唑标准液 精密量取伏立康唑储备液2 500 μL,加入适量空白血清,配制成血清伏立康唑浓度分别为0.1 μg/mL、0.5 μg/mL、1.0 μg/mL、5.0 μg/mL、10.0 μg/mL和20.0 μg/mL的各标准曲线血清浓度。
1.4 检测条件 色谱柱:Waters UPLC Acquity BEH C18(3.0 mm×100 mm,1.7 μm);流动相为乙腈(A)-0.01 mol/L磷酸盐缓冲液(B),梯度洗脱:0~5 min,40%~55%A;5~10 min,55%~75%A;10~15 min,75%~90%A;流速0.25 mL/min;柱温40℃;检测波长254 nm;进样量10 μL;Waters PDA检测器;分析时间15 min。
1.5 血清样品处理 精密量取500 μL血清样品置2 mL离心管中,加入1 000 μL乙腈,涡旋混合1 min,离心(4 ℃,14 000 r/min,12 min),取1 000 μL上清液转移至2 mL离心管中,取上清液500 μL用0.22 μm滤膜过滤后进样分析。
1.6 方法学考察
1.6.1 系统适应性及专属性考察 空白血清、空白血清+伏立康唑、乙腈+伏立康唑和用药患者的血清样品各6份,按照“1.5”项下方法处理后,按“1.4”项下方法检测。
1.6.2 标准曲线的建立 分别取血清伏立康唑各标准曲线浓度500 μL,按“1.5”项下方法处理后按“1.4”项下方法检测。
1.6.3 准确度试验 取空白血清,配制含伏立康唑定量下限0.1 μg/mL、1 μg/mL、10 μg/mL、和20 μg/mL低、中、高4个浓度各6份样品,按“1.5”项下方法处理后按“1.4”项下方法检测。乙腈溶液配制伏立康唑 0.1 μg/mL、1 μg/mL、10 μg/mL、20 μg/mL浓度各6份样品按“1.4”项下方法检测,平行操作6次。
1.6.4 精密度试验 (1)日内精密度:取空白血清,配制含伏立康唑定量下限0.1 μg/mL、1 μg/mL、10 μg/mL和20 μg/mL低、中、高4个浓度各6份样品,按“1.5”项下方法进行处理后按“1.4”项下方法检测,24 h内平行测定6次,计算日内精密度。(2)日间精密度:取上述定量下限和低、中、高4个浓度各6份样品,连续3 d每日测定一次,计算日间精密度。
1.6.5 稳定性试验 取空白血清,配制伏立康唑1 μg/mL、10 μg/mL、20 μg/mL低、中、高3个浓度各6份样品,按“1.5”项下方法处理后,分别放置于室温24 h(复溶稳定性)、反复冻融3次(冻融稳定性)及-20℃冷冻保存4周(长期冷冻稳定性),按“1.4”项下方法检测,计算RSD。
1.7 临床样本的测定 经海南省人民医院伦理委员会批准,采用该方法为临床8例使用伏立康唑治疗的重症患者进行血药浓度测定。取患者血药浓度达稳后,外周静脉血3 mL,按“1.5”项下方法处理后按“1.4”项下方法检测,另配制1 μg/mL、10 μg/mL和20 μg/mL低、中、高3个浓度的质控样本平行测定。
2 结果
2.1 系统适应性及专属性考察 结果发现伏立康唑在空白血清、空白血清+伏立康唑、乙腈+伏立康唑、含伏立康唑的患者血清保留时间分别为0 min、6.22 min、6.23 min、6.21 min,各峰分离度均大于1.5,理论塔板数均大于1 000,空白血清和流动相中干扰组分的响应低于分析物定量下限响应的20%,基质效应值(基质效应=往基质溶液里面添加一定量标准品测得的数值/实际添加数值的比值)为0.96±0.08,介于0.8~1.0,结果表明色谱分离系统良好,专属性强,血清中的内源性物质对血清中伏立康唑的干扰不显著,如图1所示。
2.2 标准曲线的建立 以伏立康唑峰面积为纵坐标(Y),伏立康唑浓度为横坐标(X),得到线性回归方程:Y=21556X+368.7,R2=0.999,线性范围为0.1~20 μg/mL,定量下限为0.1 μg/mL,见图2。
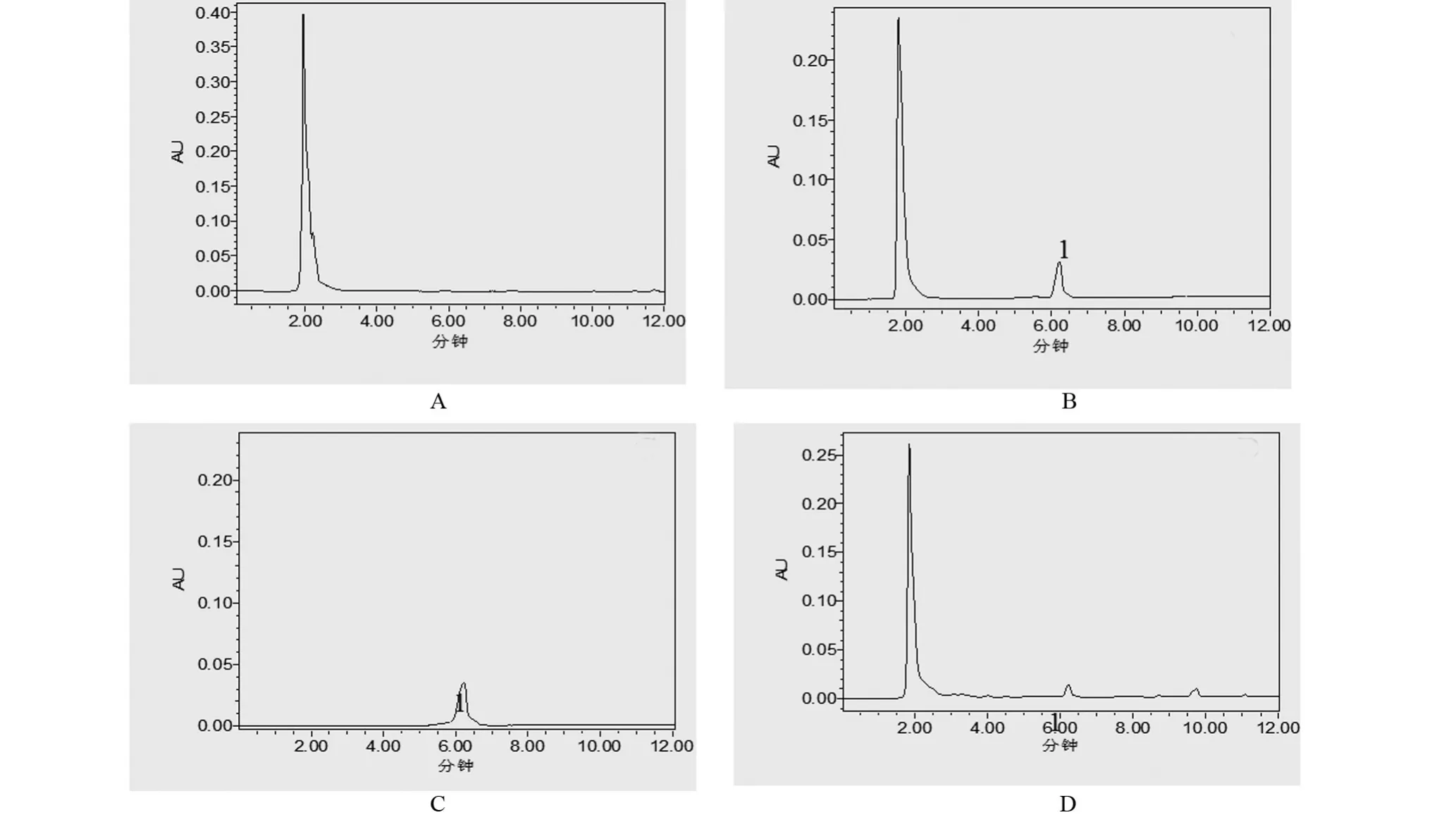
图1 伏立康唑检测方法系统适应性及专属性考察色谱图

图2 伏立康唑检测方法的标准曲线图
2.3 准确度试验 以伏立康唑峰面积与乙腈峰面积的比值表示绝对回收率;用标准曲线法测得伏立康唑浓度与配制浓度比值为方法回收率。按“1.4”项下方法检测,定量下限的绝对回收率和方法回收率分别为(90.14±2.98)%和(93.35±2.75)%,低、中、高3个浓度的绝对回收率和方法回收率RSD均小于5%,见表1。
2.4 精密度试验 按“1.4”项下方法检测,定量下限和低、中、高3个浓度的日内精密度和日间精密度RSD均小于5%,见表2。
表1 伏立康唑检测方法的准确度试验结果(±s,n=6)

表1 伏立康唑检测方法的准确度试验结果(±s,n=6)
理论质量浓度(μg/mL)绝对回收率(%) 方法回收率(%)0.1 1 10 20计算值90.14±2.98 92.50±2.95 93.88±3.68 93.25±2.65 RSD 3.31 3.19 3.92 2.83计算值93.35±2.75 93.50±3.96 99.90±2.20 97.65±2.10 RSD 2.95 4.23 2.20 2.15
2.5 稳定性试验 考察不同浓度样品在室温、反复冻融及长期冷冻条件下的稳定性。低、中、高3个浓度的稳定性RSD均小于10%,见表3。
2.6 临床样品的测定 8例重症患者监测结果显示,伏立康唑浓度在1.15~8.08 μg/mL之间,不同患者间药物浓度具有较大差异。浓度高于5.0 μg/mL时患者比较容易出现不良反应,维持剂量需要减少,见表4。
表2 伏立康唑检测方法的精密度试验结果(±s,n=6)

表2 伏立康唑检测方法的精密度试验结果(±s,n=6)
理论质量浓度(μg/mL)日内精密度日间精密度0.1 1 10 20实测质量浓度(μg/mL)0.09±0.01 0.93±0.04 9.99±0.22 19.53±0.42 RSD(%)3.35 4.23 2.2 2.15实测质量浓度(μg/mL)0.09±0.00 0.96±0.04 10.05±0.21 19.73±0.34 RSD(%)3.95 3.94 2.13 1.74
表3 伏立康唑检测方法的稳定性试验结果(±s,n=6)

表3 伏立康唑检测方法的稳定性试验结果(±s,n=6)
理论浓度(μg/mL)复溶稳定性 冻融稳定性1 10 20实测浓度(μg/mL)0.97±0.03 10.21±0.28 19.91±0.81 RSD(%)3.34 2.71 4.05实测浓度(μg/mL)0.93±0.06 10.30±0.52 20.94±0.59 RSD(%)6.48 5.03 2.81长期冷冻稳定性实测浓度(μg/mL)1.04±0.09 10.29±0.19 20.93±0.94 RSD(%)9.23 1.84 4.48

表4 8例重症患者伏立康唑血药浓度监测结果及治疗情况
3 讨论
伏立康唑血药浓度的色谱检测方法主要集中在液相色谱-质谱分析法(LC-MS)、高效液相色谱(HPLC)、UPLC[2]。本研究建立的UPLC法,每个样本仅需15 min的分析时间,能及时为临床出具报告;成本较LC-MS低,重现性也好,定量下限能达到0.1 μg/mL,较适合用于临床检验。
在研究过程中,血清样品处理方法采取了蛋白沉淀法,发现乙腈沉淀蛋白后杂峰较少,伏立康唑目标峰形较好,回收率较高。同时还对血清和乙腈的不同体积比(1:2、1:3、1:4)进行了考察,发现2倍体积的乙腈去蛋白沉淀效果最好。流动相中磷酸盐浓度配成0.01 mol/L,并采取梯度洗脱:0~5 min,40%~55%乙腈;5~10 min,55%~75%乙腈;10~15 min,75%~90%乙腈,发现并未使目标峰形变差,考虑对色谱柱的保护,本研究采取了0.01 mol/L的磷酸盐作为缓冲液。用本研究中的测定方法检测了8例重症患者的血样,结果显示,患者伏立康唑浓度在1.15~8.08 μg/mL之间。高于5.0 μg/mL的4例患者中有2例患者出现了不良反应的症状,具体表现为:第1例患者第5天谷浓度为6.38 μg/mL,并在晚上出现兴奋、心率加快症状,经排除其他因素,考虑由伏立康唑浓度高引起,第6天浓度8.17 μg/mL,给予停药一次处理,同时给予右美托咪定200 μg对症治疗一次,并将维持剂量调整为0.2 g,qd,ivgtt。第7天浓度7.43 μg/mL,此后患者无兴奋、心跳加快等不良反应。第7例患者第30天谷浓度为5.04 μg/mL,出现精神异常、胡言乱语症状,给予停药处理一次,因病情好转,院外换用卡泊芬净给药。
在《伏立康唑个体化用药指南》中推荐伏立康唑治疗浓度范围为0.5~5.0 μg/mL,首日给予负荷剂量,首次监测时间为给药后第3天;未给予负荷剂量,文献报道一般第4~7天达稳态,但指南中未推荐首次监测时机,同时提示谷浓度与精神、神经、视觉等安全性指标关联性仍还不明确。文献报道,伏立康唑不良反应发生率为29.26%~35.7%,包括视觉异常、肝酶升高、头痛、焦虑、心动过速等症状,多数轻至中度,调整剂量或停药可恢复[3-5]。本研究中虽有2例患者因浓度高出现不良反应症状,但样本数太少,还需更多临床数据来证实其相关性。抗真菌治疗是需要长期服用抗真菌药物的,这2例患者出现不良反应的时间一个在治疗的第6天,一个在治疗的第33天,分析可能是患者的不同治疗阶段生理病理变化引起伏立康唑浓度波动。因此对于长期服用伏立康唑患者,每周或每个月定期监测血药浓度非常有必要,如出现剂量调整、严重腹泻、疾病进展加快、增加血滤或侵入性治疗、临床疗效不佳或出现不良反应时,应及时复查浓度,对提高临床治疗效果和预防相关不良反应的发生极为重要。
深部真菌感染多数较为严重,加之伏立康唑代谢动力学特征,在相同给药方案下,伏立康唑血药浓度在0.2~12 μg/mL内均有分布[6-7],严重影响着治疗的疗效,因此,需要更加精准的个体化治疗。本研究测定伏立康唑血药浓度的方法,具有灵敏度高、操作简便快速、成本低等优点,可为临床真菌感染的精准治疗提供一些指导和参考。
