帕金森病患者伴发便秘的临床特征及其对生活质量的影响
2021-02-05孙百花王涛乔晋
孙百花,王涛,乔晋
1.西安交通大学第一附属医院神经内科,陕西 西安 710061;2.陕西省森林工业职工医院神经内科,陕西 西安 710300;3.西安交通大学第一附属医院康复医学科,陕西 西安 710061
帕金森病(Parkinson's disease,PD)是中枢神经系统常见的变性病之一,临床表现除了运动迟缓、静止性震颤、肌强直、姿势平衡障碍等运动症状外,还伴发很多非运动症状(non-motor symptom,NMS),如情绪障碍、自主神经功能障碍、嗅觉减退、睡眠障碍、消化道症状、认知障碍等[1-2]。非运动症状可以出现在病程任何阶段,有些甚至在运动症状发生之前5年或更长时间已经出现,NMS严重影响患者的生活质量,特别是在中晚期。近年来认为脑-肠道-微生物轴在帕金森病发病和疾病进展中具有重要作用,肠道神经系统可能是帕金森病发病的初始累及部位,临床前期或临床期的消化道症状与帕金森病发病或进展存在一定的联系[3-4]。有关帕金森病便秘虽有研究,但由于便秘引起的原因复杂,生活方式和饮食习惯与便秘发生也有关系,不同种族和地区生活方式和饮食习惯差异较大,有必要探讨不同地域帕金森病便秘的特征和相关因素。同时了解帕金森病消化道的症状的特点对于认识帕金森病的发病机制和临床表现的异质性也具有重要意义。本文以陕西地区帕金森病患者为研究对象,对帕金森病便秘的相关情况进行了筛查,着重分析了伴发便秘患者的临床特征、影响因素和对生活质量的影响。
1 资料与方法
1.1 一般资料 连续选取2018年3~9月在西安交通大学第一附属医院神经内科门诊就诊及住院的帕金森病患者122例,其中门诊99例,住院23例。所有患者均符合2015年国际运动会障碍协会制定临床确诊的或很可能的帕金森病诊断标准[1]。排除标准:药物性、脑炎后、血管性等继发性帕金森综合征和进行性核上性麻痹、多系统萎缩、纹状体黑质变性等帕金森叠加综合征;合并急慢性肠道疾病者;因精神障碍、重度认知功能障碍等原因不能完成量表评定的患者。
1.2 方法
1.2.1 资料收集 采用自行设计的调查表详细记录性别、年龄、受教育水平、既往病史和帕金森病病程、发病年龄、起病侧别、临床表现、药物使用情况和运动并发症等。
1.2.2 运动症状和分期分型评估[3]采用统一的帕金森病评定量表(Unified Parkinson's Disease Rating Scale,UPDRS)Ⅲ部分对运动症状进行评分,依据改良的Hoehn-Yahr分级标准进行疾病严重程度分期。统一PD评定量表(UPDRS)评分量表第Ⅱ部分第16项及第Ⅲ部分第20、21项的平均分定义为震颤得分;UPDRS第Ⅱ部分第5、7、12~15项及第Ⅲ部分18~19、22~31项的平均分为非震颤得分。根据震颤得分/非震颤得分是否>1,将患者分为两种亚型:震颤为主型(震颤得分/非震颤得分>1分)和非震颤为主型(强直少动型,震颤得分/非震颤得分≤1分)。
1.2.3 非运动症状评估[3]采用非运动评价量表(Non-motor Symptom Scale,NMSS)评估非运动症状的程度及频率,帕金森病患者生活质量问卷-39(39-item Parkinson's Disease Questionnaire,PDQ-39)评定生活质量,按照罗马Ⅲ功能性便秘的诊断标准评价便秘,Wexner评分评价便秘严重程度。
1.3 统计学方法 应用SPSS18.0软件进行数据统计学分析。用Schapiro-Wilk检验对每个参数的数据进行正态性检验。符合正态分布的计量资料以均数±标准差(x-±s)表示,组间比较采用t检验,非正态分布的计量资料的统计描述用中位数(四分位数)表示,组间比较采用非参数检验;组间计数资料比较采用χ2检验;符合双变量正态分布的计量资料用Pearson相关分析,其他资料采用Spearman相关分析。单因素分析差异有统计学意义的数据进一步进行逐步非条件Logistic回归分析或线性回归分析,均以P<0.05为差异有统计学意义。
2 结果
2.1 PD患者一般资料和临床特征 122例患者中男性67例,年龄(65.16±9.55)岁,发病年龄(59.84±10.25)岁;改良Hoehn-Yahr分级1期15例,1.5期22例,2期37例,2.5期18例,3期20例,4期10例;震颤型74例,非震颤型48例;NMSS评分为53.00(23.75,81.00)分,Wexner评分为8.0(5.0,12.0)分,PDQ-39评分为33.00(18.75,57.25)分;合并剂末现象34例,开关现象5例,异动症22例;使用左旋多巴98例,多巴胺受体激动剂68例,单胺氧化酶B抑制剂(MAO-B)28例,儿茶酚-氧位-甲基转移酶抑制剂(COMT)9例,抗胆碱能药物18例,金刚烷胺12例;伴发高血压病46例,糖尿病12例,冠心病11例,有帕金森病家族史4例。
2.2 PD患者伴和不伴有便秘者的临床特征比较 PD患者中伴发便秘者71例(58.20%),其中29例(40.85%)便秘发生于运动症状之前约5(2.0,11.5)年。便秘组患者的年龄、起病年龄、病程、Hoehn-Yahr分级、UPDRSⅢ得分、异动症发生率、左旋多巴及多巴胺受体激动剂使用率、NMSS评分和PDQ-39评分明显大于或高于非便秘组,差异均有统计学意义(P<0.05)。但两组间的性别、临床分型、剂末和开关现象发生率比较差异均无统计学意义(P>0.05),见表1。

表1 便秘组和非便秘组患者的一般临床特征比较
2.3 不同Hoehn-Yahr分级患者便秘发生率和严重程度比较 根据改良的Hoehn-Yahr分级,1~1.5级、2~2.5级、3级、4级患者的便秘发生率分别为45.95%、61.82%、60.00%,80.00%,差异无统计学意义(P>0.05),但随着改良Hoehn-Yahr分级增加,Wexner评分逐渐增加,差异有显著统计学意义(P<0.01),见表2。
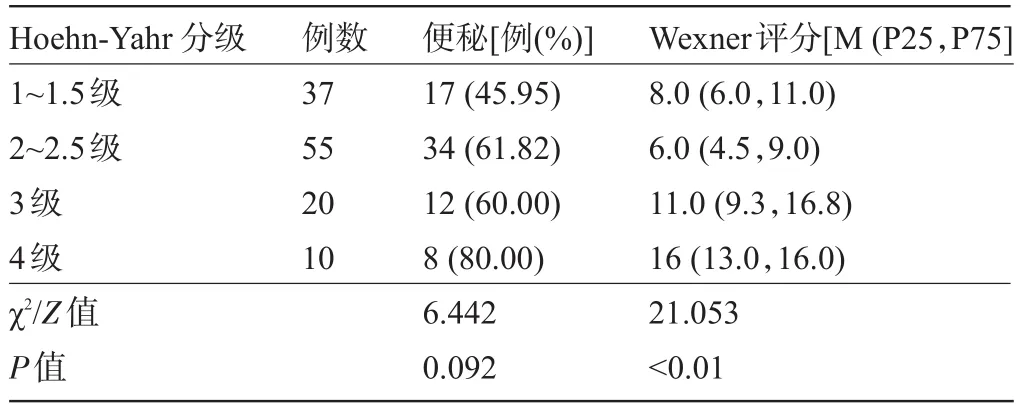
表2 不同Hoehn-Yahr分级PD患者便秘发生率及严重程度比较
2.4 影响便秘发生及PDQ-39分值的相关因素 相关分析结果显示,便秘发生与病程、Hoehn-Yahr分级、NMSS评分、UPDRSⅢ评分、PDQ-39评分呈正相关(r=0.48、0.24、0.26、0.25、0.29,P<0.05)。以是否发生便秘作为因变量,以年龄、发病年龄、病程、Hoehn-Yahr分级、UPDRSⅢ评分、PDQ-39评分、NMSS评分作为自变量,Logistic回归分析显示NMSS评分为便秘发生的独立危险因素(P<0.05),见表3。PDQ-39分值和年龄、Hoehn-Yahr分级、UPDRSⅢ评分、NMSS评分及Wexner评分呈正相关(r=0.52、0.62、0.70、0.82,0.51,P<0.01)。以PDQ-39分值为因变量,年龄、性别、发病年龄、病程、Hoehn-yah分级、UPDRSⅢ评分、Wexner评分为自变量进行线性回归分析显示性别、Hoehn-yahr分级、UPDRSⅢ评分和Wexner评分是影响PDQ-39评分的独立危险因素(P<0.05),见表4。
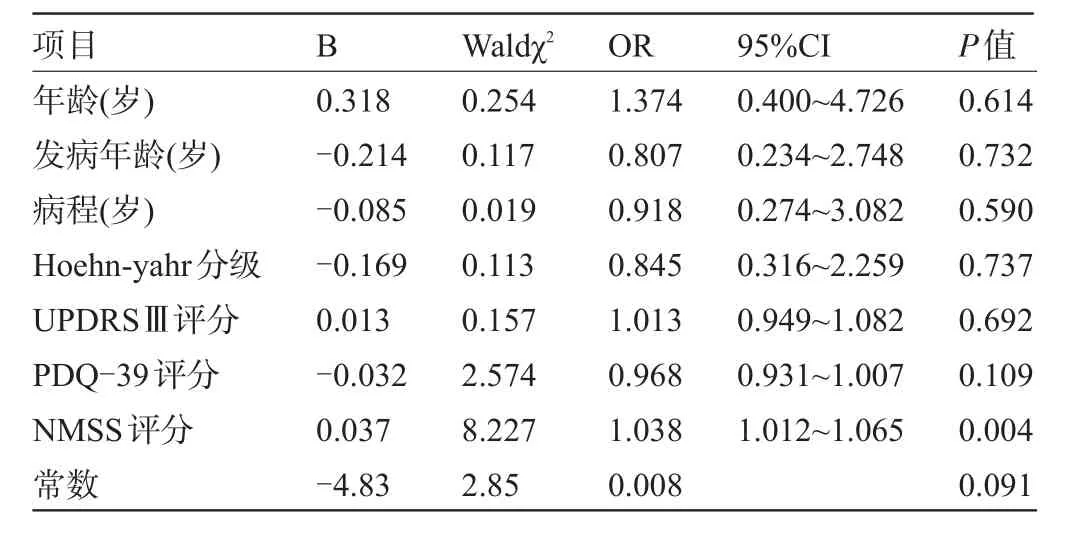
表3 便秘发生的多因素Logistic回归分析

表4 影响PDQ-39评分的多因素线性回归分析
3 讨论
传统观点认为PD主要是α突触核蛋白(α-synuclein,α-SYN)形成的路易小体异常沉积于中脑黑质致密部,造成多巴胺能神经元功能异常引起的神经系统变性疾病。目前认为PD的病变部位较为广泛,在肠道、胰腺、心脏、唾液腺和皮肤都有异常α-SYN沉积,存在着多巴胺能通路、肾上腺素能通路、5羟色胺能通路和胆碱能通路等多种神经通路的功能紊乱,是多器官损害的功能障碍综合征[5]。临床上不只表现为运动症状,还存在嗅觉减退、认知损害,睡眠障碍、抑郁、便秘等NMS[1]。临床已认识到NMS对患者的生活质量产生不良影响,对部分PD患者而言,NMS可能比运动障碍更具有致残性[6]。尽管人们对PD的认识有200多年的历程,但是对PD的发病机制和治疗手段仍有限,特别是中枢神经系统之外的PD相关病理机制知之甚少,在NMS的发生机制和治疗上缺乏深入研究[7]。因此研究帕金森病的NMS具有重要的意义。
本研究发现58.20%的帕金森病患者伴发便秘,且40.85%的患者便秘发生于运动症状之前平均约5年。有研究发现几乎100%的PD患者中至少存在一种NMS,平均为8个[8]。韩国研究发现即使未经治疗早期PD患者,消化道症状也非常常见,其中便秘的发生率为46.3%[9]。在运动症状出现之前,就可出现多种NMS,且发展为PD的风险更高,提示某些NMS可能是PD早期阶段的表现[10]。既往报道PD便秘的发生率为4%~71%,大多为24%~63%,有些报道甚至高达80%[3,11],可能与研究标准及研究人群差异有关。前瞻性研究发现每天排便大于1次的人随访10年后,PD发生的风险是每天排便少于1次人的2.7倍[12]。病理研究发现每天排便大于1次的人与每天排便少于1次的人相比,以后发生Lewy体沉积的概率增加了4倍[13]。由此可见,便秘可显著增加PD发病的风险。
根据Braak病理分期,PD病变部位最早并非起始于中脑黑质多巴胺能神经元,嗅球、舌咽神经、迷走神经运动背核及肠道肌间神经丛可能是其最先侵犯的部位[14]。近年来研究发现PD的病理改变可能是通过肠道菌群波及肠道神经系统。肠道菌群改变导致α-SYN的错误折叠,这些病理性α-SYN通过肌间神经丛被肠黏膜吸收进入肠道神经丛,然后沿迷走神经逆行传入脑干及大脑,造成黑质多巴胺能神经元损伤。另外,肠道菌群通过产生与宿主神经系统相互作用的激素和神经递质,如单胺类、GABA、短链脂肪酸等,对宿主神经活动产生直接影响,中枢神经系统胶质细胞活化、促炎信号分子产生和氧化应激等改变可能是导致PD神经退行性变的重要机制[4,15]。通过肠黏膜活检方式发现在PD早期,Lewy体已沉积于肠黏膜下神经丛[16],LIN等[17]的研究发现便秘患者发生为PD的可能性较无便秘患者高3.3~4.2倍,且便秘严重程度与PD的发生亦存在关系,因此认为便秘是PD的前驱标志之一。便秘是PD的固有症状,和其发病直接相关。
单因素分析显示便秘组患者年龄较大,起病年龄较晚,运动症状更严重,生活质量更差。PD除了多巴胺递质紊乱外,实际上还伴有乙酰胆碱、去甲肾上腺素和5羟色胺等多种神经递质的减少,这是引起PD运动和非运动症状的关键所在。PD便秘的原因和机制较为复杂,可能除了疾病本身原因外,不能排除与使用左旋多巴等抗PD治疗药物有关,其次饮食习惯亦有一定影响。研究发现PD便秘患者液体摄入量、新鲜水果、生蔬菜、鱼类、肉类等摄入明显减少[18]。根据中国、韩国、印度等亚洲国家的调查,与西方人群相比,亚洲人群的PD便秘发病率更高。这种差别与不同种族人群饮食习惯、运动、营养状况、肠道菌群、教育及PD药物治疗等方面有关[19]。
近年来PD肠道的起源学说很好地解释了PD发生消化道症状的原因。PD除了中枢神经变性外,肠神经亦发生变性,甚至肠神经变性的发生早于中枢神经变性。随着PD患者年龄增加,肠道菌群发生变化,肠黏膜通透性及肠道炎性改变,导致α-SYN错误折叠,错误折叠的α-SYN沉积于肠黏膜神经元及脊髓骶副交感神经元,引起肠道神经元功能障碍,进而造成结肠转运延迟及出口梗阻,从而发生排出型便秘[20]。另外,迷走神经背核发生退行性变性,导致自主神经功能紊乱,加重胃肠功能障碍,导致排便相关的肌肉收缩和肌肉松弛协同机制失灵,造成盆底肌和肛门直肠括约肌功能障碍也是一个很重要的原因[3]。便秘患者抑郁、焦虑等其他NMS发生率明显增高,这些NMS严重影响患者生活质量,致使身体活动能力下降,日常活动量下降,食欲下降,胃肠活动功能减弱,促进便秘的发生及程度加重[21]。临床调查发现便秘患者左旋多巴及多巴胺受体激动剂使用率更高,便秘的发生也可能与药物对外周多巴胺受体刺激有关[22]。随着病程延长,病情加重,药物治疗时间及剂量增加,药物的不良反应可能进一步增加。这些因素都可能是PD患者发生便秘的影响因素。本研究多因素回归分析仅发现NMSS评分为便秘的独立危险因素,NMSS评分越高的患者,非运动症状出现频率越高,程度也越严重,与其他因素似乎关系不大,因此推测便秘可能为PD的固有症状,其他的相关因素可能并非是便秘发生的核心因素。
PD患者便秘非常多见,贯穿于疾病的整个过程中,甚至早于运动症状前出现,严重影响患者的生活质量[23]。其发生机制仍需要进一步探索,研究消化道症状对于理解PD肠道起源学说具有重要意义。
本研究系单中心横断面调查研究,存在许多不足。对于影响便秘的因素仅限疾病本身的部分特征因素,未考虑其他非运动症状对于便秘和生活质量的影响,也未进一步具体分析治疗药物及其生活方式、饮食习惯等因素。下一步应进行多中心多因素的横断面调查研究,并探索帕金森病便秘的可能机制,了解肠道动力异常和肠道菌群改变及其代谢产物等在帕金森病伴发便秘中的作用。
