术前区域动脉化疗联合全身化疗在局部进展期直肠癌中的应用
2021-02-05黄文鹏巫佳明刘桂黄金球李万浪
黄文鹏,巫佳明,刘桂,黄金球,李万浪
广西科技大学第二附属医院普通外科,广西 柳州 545006
新辅助放化疗联合全直肠系膜切除术是局部进展期直肠癌的标准治疗方法[1]。尽管术前放疗在肿瘤局部控制方面取得良好的效果,但放疗有增加手术并发症的可能,并且损害膀胱、肠道功能,降低术后化疗耐受性及增加继发癌的风险[2-4]。术前放疗还可导致严重的组织黏连和纤维化,使得手术过程中难以分辨正常组织和肿瘤组织,导致手术操作十分困难[5]。近年来有一些研究评估单独应用新辅助化疗而不使用术前放疗的疗效,这些研究均取得了满意的效果[6-9]。
术前区域动脉化疗是一种治疗肿瘤的有效方案,动脉给药可使肿瘤部位的化疗药物达到很高的局部浓度,肿瘤反应远大于全身静脉给药[10-11]。目前,术前区域动脉灌注化疗多为单独局部应用而未和全身化疗相结合,术前介入次数,介入和外科手术间隔等仍未确定,对于局部进展期直肠癌,术前区域动脉化疗是否能有效替代放疗,目前较少该方面的相关研究。
理论上,术前区域动脉化疗联合全身化疗(PRAC/SC)可能是局部进展期直肠癌的有效治疗方案,该方案的剂量和疗程根据FOLFOX6(奥沙利铂/亚叶酸/5-FU)制定,此方案的目的是避免放疗毒性和缩短新辅助化疗和手术的间隔。本文旨在评价局部进展期直肠癌患者术前应用PRAC/SC的安全性及有效性。
1 资料与方法
1.1 一般资料 选取2017年2月至2019年6月在广西科技大学第二附属医院就诊的54例直肠癌患者,所有患者临床分型为T3~T4或区域淋巴结阳性,肿瘤下缘距离肛缘12 cm内。其中男性42例,女性12例,中位年龄64岁。全部患者经临床病理学确诊,其中低分化腺癌7例,中分化腺癌35例,高分化腺癌12例。应用随机排列表随机分为A组和B组各27例,A组(28例,B组有1例要求行PRAC/SC而转入A组)实施PRAC/SC;B组(26例)实施单纯手术。两组患者在年龄、性别、肿瘤大小、病理分期方面比较差异均无统计学意义(P>0.05),具有可比性,见表1。本研究经广西科技大学第二附属医院伦理委员会批准,所有患者在入组前均提供书面知情同意书。
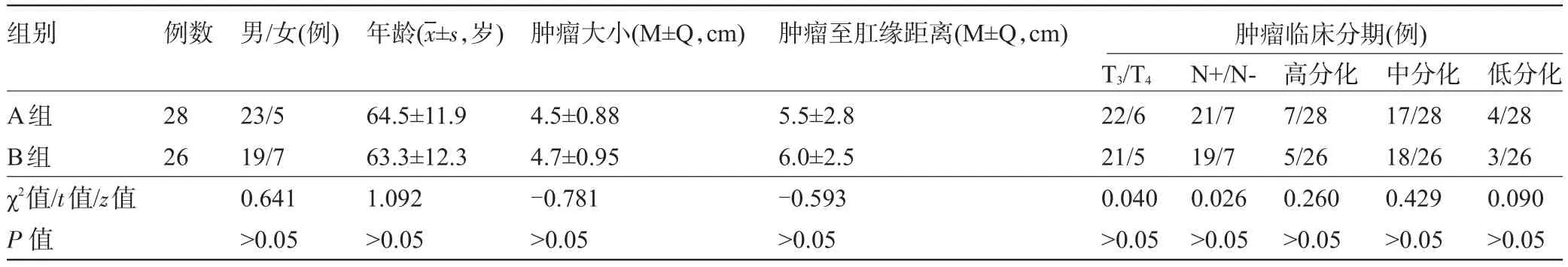
表1 两组患者的临床资料比较
1.2 治疗方法 A组患者术前行两周期PRAC/SC,化疗周期为两周一次,PRAC/SC结束后3~4周手术,术后3周应用XELOX化疗方案6个疗程。PRAC/SC方案为:奥沙利铂100 mg/m2,亚叶酸200 mg/m2,5-FU 1 000 mg/m2,直肠上动脉和双侧髂内动脉注入(比例约4∶3∶3),然后静脉滴注亚叶酸200 mg/m2,再用5-FU 2 400 mg/m2持续全身输注46 h。PRAC采用Seldinger经股动脉入路。根据血管造影,对直肠上动脉和双侧髂内动脉进行超选择性插管,并通过导管给予化疗药物(图1)。B组为对照组,术前未行放化疗,直接手术,术后3周应用XELOX化疗方案8个疗程。
1.3 观察指标与评价方法 (1)术前行直肠内超声、增强盆腔MRI和增强CT明确肿瘤分期。按Dworak标准进行病理肿瘤退缩分级,共分为TRG 0~4五个等级。TRG0代表肿瘤无退缩,而TRG4则代表无肿瘤细胞残留(PCR)。(2)R0切除定义为切除标本边缘1 mm内没有肿瘤细胞。(3)化疗不良反应按美国国家癌症研究所通用不良反应标准(4.0版)分为1~5级,1、2级反应为低级反应,3、4级反应为严重反应。记录其级别最高的不良反应。(4)生存时间为从新辅助化疗开始到死亡的时间;远处转移时间定义为从新辅助化疗开始到出现远处转移的时间;局部复发时间定义为从新辅助化疗开始到出现盆腔局部复发的时间。

图1 PRAC/SC前后变化
1.4 统计学方法 应用SPSS13.0(美国)统计学软件分析数据。正态连续变量以均数士标准差(x-±s)表示;非正态分布资料用中位数加减四分位数间距(M±Q)表示,分类变量以比例和百分比表示。正态分布的连续变量比较采用t检验;非正态分布的连续变量如肿瘤大小,肿瘤至肛缘距离采用Wilcoxon非参数检验;两组率的比较采用χ2检验。生存分析应用Kaplan-Meier曲线,并绘制生存曲线,用Log-rank检验计算χ2比较两组患者的生存曲线是否有差异。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者术后化疗不良反应比较 A组患者术前均成功进行PRAC,无操作并发症发生。术前PRAC/SC最常见的化疗不良反应为白细胞减少17例,其次为中性粒细胞减少15例,贫血5例,28例中3例出现3级不良反应。两组患者术后化疗不良反应比较差异均无统计学意义(P>0.05),见表2。围手术期化疗未出现4级不良反应。
2.2 两组患者术后并发症比较 两组患者的术后总并发症发生率比较差异无统计学意义(P>0.05),见表3。
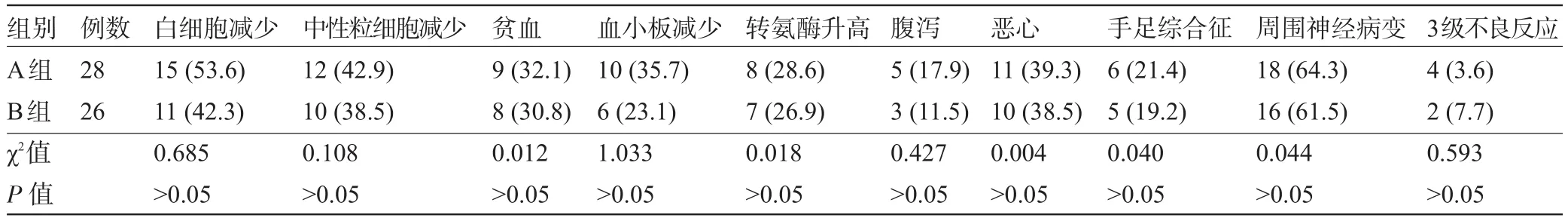
表2 两组患者术后化疗不良反应比较[例(%)]

表3 两组患者术后并发症比较(例)
2.3 两组患者手术切除情况比较 A组患者化疗后局部症状均有不同程度缓解,CT提示肿瘤较前缩小,与周围组织之间可见明显脂肪间隙(图2)。术中直肠周围组织虽然有炎症水肿,但并不影响手术分离。术后标本发现肿物明显缩小,形成疤痕,周围肠壁平坦(图3)。其中A组行低位前切除术(Dixons)21例,经腹会阴联合切除术(Miles)7例,PCR率为17.9%(5/28),R0切除率为 96.4%(27/28)。B 组行Dixons手术18例,Miles手术8例。R0切除率为76.9%(20/26)。两组患者的R0切除率比较差异有统计学意义(χ2=4.546,P<0.05)。

图2PRAC/SC前后CT变化
2.4 两组患者的复发及生存时间比较 A组和B组患者术后1年生存率分别为96.3%、92.1%,3年生存率分别为78.0%、63.2%,差异无统计学意义(Log-rank检验χ2=1.231,P>0.05),见图4。A组及B组术后3年远处转移率分别为17.9%和23.1%,差异无统计学意义(Log-rank检验χ2=0.998,P>0.05)。A组及B组术后3年局部复发率分别为7.1%和26.9%,差异有统计学意义(Log-rank检验χ2=4.483,P<0.05)。
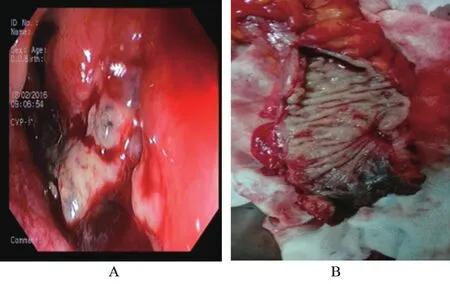
图3 PRAC/SC前肠镜检查及手术切除之直肠标本

图4 两组患者术后生存率
3 讨论
区域动脉灌注化疗采用介入方法,通过导管在肿瘤供血动脉内直接灌注化疗药物,经动脉灌注的化疗药物可高度抑制肿瘤细胞的活性,最大限度地杀伤癌细胞,减少术中医源播散,防止术后复发及转移。区域动脉灌注化疗具有疗效高,副反应小的特点,可明显减轻胃肠道肿瘤患者的临床症状,延长患者术后生存时间[12-13]。
目前术前区域动脉灌注化疗多为单独局部应用而未和全身化疗相结合,术前介入次数、介入后和手术的间隔时间等仍未确定。PRAC/SC对手术并发症、肿瘤R0切除率、肿瘤病理改变、1年、3年复发率和生存率的影响极少研究。本课题应用术前两疗程PRAC/SC,采用超选择性动脉插管,将导管插入直肠上动脉和双侧髂内动脉,使化疗药物能最大限度地进入瘤体及其边缘组织,充分发挥其肿瘤杀伤作用,同时联合全身化疗杀伤介入过程中可能脱落的肿瘤细胞。这种动静脉联合、局部和整体结合的治疗方案,可有效杀灭肿瘤细胞。该方案的另一目的为缩短介入化疗和手术的间隔,化疗和手术间隔的缩短可能降低肿瘤远处转移的风险。本研究中介入化疗和手术间隔为3~4周,低于新辅助放化疗的6~8周,新辅助化疗的14~20周[6-9],所有患者术前均未发现有转移,表明早期手术有可能降低转移的风险。
该方案有很好的耐受性,所有患者均能完成术前介入化疗及手术,并按时进行术后化疗。该方案能明显缓解患者疼痛、腹泻、便血、里急后重等临床症状,而且能改善术后生存率。在本研究中,PRAC组的PCR率为17.9%,基本和新辅助放化疗一致(10%~25%),但并无放疗导致的伤口愈合不良、吻合口狭窄或永久性瘘道形成等现象。PRAC/SC组患者术后3年生存率为78.0%,对照组为63.2%,PRAC/SC组3年生存率高于对照组,但差异无统计学意义,可能由于观察时间短及样本例数较少的原因。术后3年远处转移率PRAC/SC组和对照组分别为17.9%和23.1%,两组比较差异无统计学意义(P>0.05)。但术后3年局部复发率分别为7.1%和26.9%,两组比较差异无统计学意义(P<0.05),表明PRAC/SC可有效地控制肿瘤,减少局部复发率。
综上所述,术前区域动脉化疗联合全身化疗对局部进展期直肠癌疗效确切,不良反应及术后并发症发生率少,可以提高局部进展期直肠癌患者R0切除率,减少局部复发率;但术前区域动脉化疗联合全身化疗的远期疗效、总生存率尚需进一步观察。
