胆汁酸谱在肺炎和肺癌鉴别诊断中的应用价值
2021-02-05徐润灏张舒林
徐润灏,邹 琛,张 洁,李 敏,张舒林
(1.上海交通大学医学院,上海 200025;2.上海交通大学医学院附属仁济医院检验科,上海 200001)
肺癌是我国最常见的恶性肿瘤之一,占恶性肿瘤死亡人数的25%[1]。血清学检查相对于其他检查手段,具有简单、快速、无痛、微创等特点,适用于肺癌的初筛及辅助诊断。胆汁酸按结构可分为游离胆汁酸和结合胆汁酸,按来源又可分为初级胆汁酸和次级胆汁酸。初级胆汁酸是肝细胞以胆固醇为原料直接合成的胆汁酸,包括胆酸(cholic acid,CA)、鹅脱氧胆酸(chenodeoxycholic acid,CDCA)及相应的结合胆汁酸;次级胆汁酸由初级胆汁酸随胆汁进入肠道,在回肠、结肠上段由肠道菌、酶催化,脱去羟基转化而成,包括脱氧胆酸(deoxycholicacid,DCA)、石胆酸(lithocholic acid,LCA)、熊脱氧胆酸(ursodeoxycholic acid,UDCA)及相应的结合胆汁酸。根据以往的认知,由于胆汁酸主要存在于肠肝循环系统中,因此关于胆汁酸谱的研究多与肝胆疾病、肠道疾病相关,与肺部疾病相关的报道极少。近年来,有研究结果显示,在一些呼吸系统疾病患者中,其支气管肺泡灌洗液内含有较高水平的胆汁酸[2],且合并胃食管反流病的概率也相当高[3]。还有研究结果显示,法尼醇X受体(farnesoid X receptor,FXR)、G蛋白偶联受体5(takeda G protein-coupled receptor 5,TGR5)等胆汁酸受体在肺组织中有不同程度地表达[4-5],这些胆汁酸受体在肺部参与多种信号通路的激活[6-9],且在肺癌组织中表达上调[8-9]。为此,本研究拟探讨血清胆汁酸谱在肺癌中的价值。
1 材料和方法
1.1 研究对象
选取2018年9月—2019年6月上海交通大学医学院附属仁济医院经组织病理学检查确诊为原发性非小细胞肺癌的患者108例(肺癌组),其中男75例、女33例,年龄39~84岁;根据临床进展分为早中期(Ⅰ~Ⅲ期53例)、晚期(Ⅳ期51例);根据病理分期分为鳞癌(34例)、腺癌(74例);排除已知伴有肝、肠等消化道器官转移的患者。选取经检查排除肺部肿瘤,诊断为肺炎的患者80例(肺炎组),其中男41例、女39例,年龄25~92岁。所有患者均排除肝功能异常、肠道炎症、胆囊结石以及肠道切除等病症,并排除服用过胆汁酸受体激动剂及免疫抑制剂者。另选取上海交通大学医学院附属仁济医院体检中心健康体检者106名(正常对照组),其中男62名、女44名,年龄41~84岁,入组标准:胃肠道功能未见异常,且排除糖尿病、高血压、慢性肝胆疾病及肝、肾功能等异常。
1.2 方法
1.2.1 样本采集 采用含促凝剂的真空采血管采集所有对象空腹静脉血4 mL,2 h内16 000×g离心10 min,分离血清。
1.2.2 胆汁酸谱检测 采用液相色谱-串联质谱法(liquid chromatography tandemmass spectrometry,LC-MS/MS)检测胆汁酸谱,包括5种游离胆汁酸(CA、CDCA、DCA、LCA、UDCA)及10种结合胆汁酸[甘氨胆酸(glycocholic acid,GCA)、甘氨鹅脱氧胆酸(glycochenodeoxycholic acid,GCDCA)、甘氨脱氧胆酸(glycodeoxycholic acid,GDCA)、甘氨石胆酸(glycolithocholic acid,GLCA)、甘氨熊脱氧胆酸(glycoursodeoxycholic acid,GUDCA)、牛磺胆酸(taurocholic acid,TCA)、牛磺鹅脱氧胆酸(taurochenodeoxycholic acid,TCDCA)、牛磺脱氧胆酸(taurodeoxycholic acid,TDCA)、牛磺石胆酸(taurolithocholic acid,TLCA)、牛磺熊脱氧胆酸(tauroursodeoxycholic acid,TUDCA)],检测仪器为API3200MD三重四级杆质谱仪(美国ABSciex公司)及Shimadzu 20AD液相色谱仪(日本岛津公司),试剂购自上海可力梅塔生物医药科技有限公司。
1.2.3 总胆汁酸(total bile acid,TBA)检测 采用酶循环法检测TBA。检测仪器为7600全自动生化分析仪(日本日立公司),试剂购自四川迈克生物股份有限公司。
1.2.4 肿瘤标志物检测 采用cobas e801全自动电化学发光分析仪(瑞士罗氏公司)及配套试剂(电化学发光法)检测糖类抗原(carbohydrate antigen,CA)125、CA19-9、癌胚抗原(carcinoembryonic antigen,CEA)、细胞角蛋白19片段(cytokeratin 19 fragment,CYFRA 21-1)、神经元特异性烯醇化酶(neuron specific enolase,NSE)。
1.3 统计学方法
采用SPSS 22.0软件及MedCalc 15.0软件进行统计分析。采用K-S检验进行正态性分布检验。呈非正态分布的数据以中位数(M)[四分位数(P25~P75)]表示,组间比较采用Mann-WhitneyU检验。采用逐步法二元Logistic回归分析进行相关性分析并筛选优化诊断指标,根据Logistic回归分析结果,以训练样本建立诊断模型;以模型Y为新变量,采用受试者工作特征(receiver operating characteristic,ROC)曲线评估诊断模型鉴别诊断肺炎与肺癌的效能,以验证样本加以验证。以P<0.05为差异有统计学意义。
2 结果
2.1 肺炎组、肺癌组及正常对照组之间血清胆汁酸谱的比较
与正常对照组比较,肺炎组血清游离胆汁酸DCA、LCA、UDCA水平及结合胆汁酸GDCA、GLCA、TDCA、TLCA水平降低(P<0.01),血清结合胆汁酸GCDCA、TCDCA水平升高(P<0.01);肺癌组血清游离胆汁酸CA、CDCA水平及结合胆汁酸GCDCA、TCDCA水平升高(P<0.01),血清结合胆汁酸TDCA、TLCA水平降低(P<0.01)。血清TBA水平3组之间差异均无统计学意义(P>0.05)。肺癌组血清游离胆汁酸CA、CDCA、DCA、LCA、UDCA及结合胆汁酸GDCA、GLCA高于肺炎组(P<0.01)。见表1、表2。
2.2 不同类型及不同分期肺癌患者血清胆汁酸谱的比较
早中期肺癌组与晚期肺癌组之间、肺鳞癌组和肺腺癌组之间血清TBA及5种游离胆汁酸、10种结合胆汁酸差异均无统计学意义(P>0.05)。见表3~表6。
2.3 肺炎组与肺癌组血清肿瘤标志物的比较
肺癌组血清CEA、CYFRA21-1、NSE水平均明显高于肺炎组(P<0.01、P<0.05),2个组之间血清CA125、CA19-9水平差异均无统计学意义(P>0.05)。见表7。
2.4 胆汁酸谱及肿瘤标志物鉴别诊断肺炎与肺癌的价值
采用ROC曲线分析肺炎组与肺癌组之间有差异的7种胆汁酸和2种肿瘤标志物。结果显示,DCA、UDCA、CEA鉴别诊断肺炎与肺癌的曲线下面积(area under curve,AUC)分别为0.781、0.707、0.704,敏感性分别为73.2%、86.1%和62.0%,特异性分别为77.5%、50.0%和72.5%。其他指标的AUC均<0.7。见表8。

表1 肺炎组、肺癌组及正常对照组之间血清TBA及5种游离胆汁酸水平的比较 M(P25~P75)
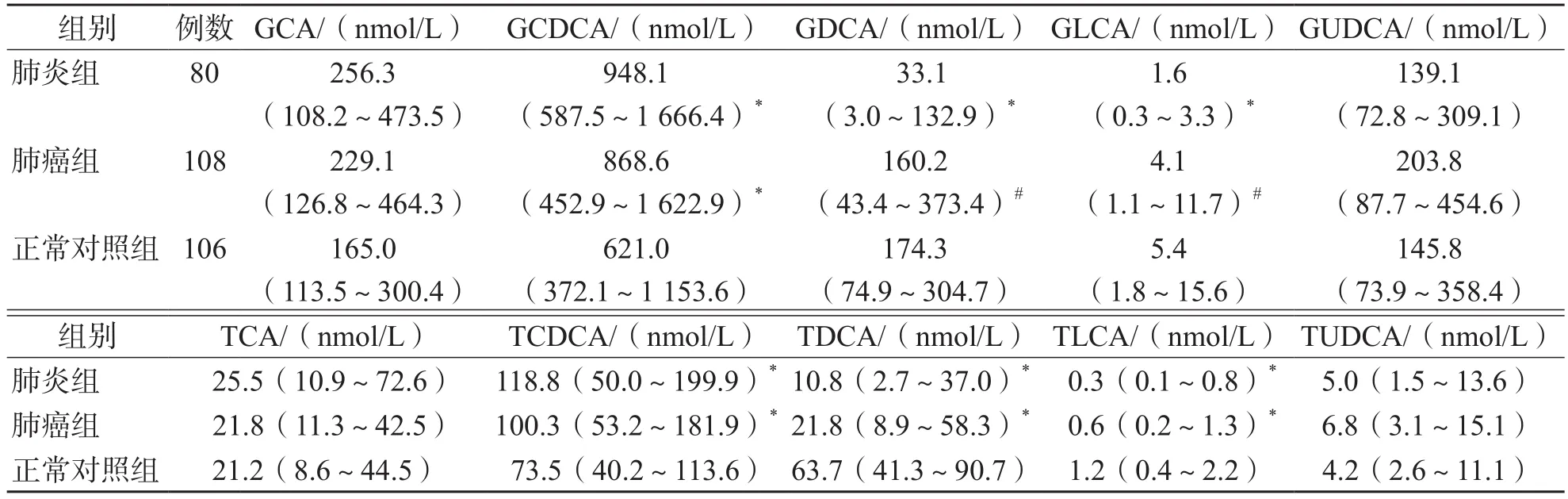
表2 肺炎组、肺癌组及正常对照组之间血清结合胆汁酸水平的比较 M(P25~P75)

表3 早中期肺癌组及晚期肺癌组之间血清TBA及游离胆汁酸水平的比较 M(P25~P75)
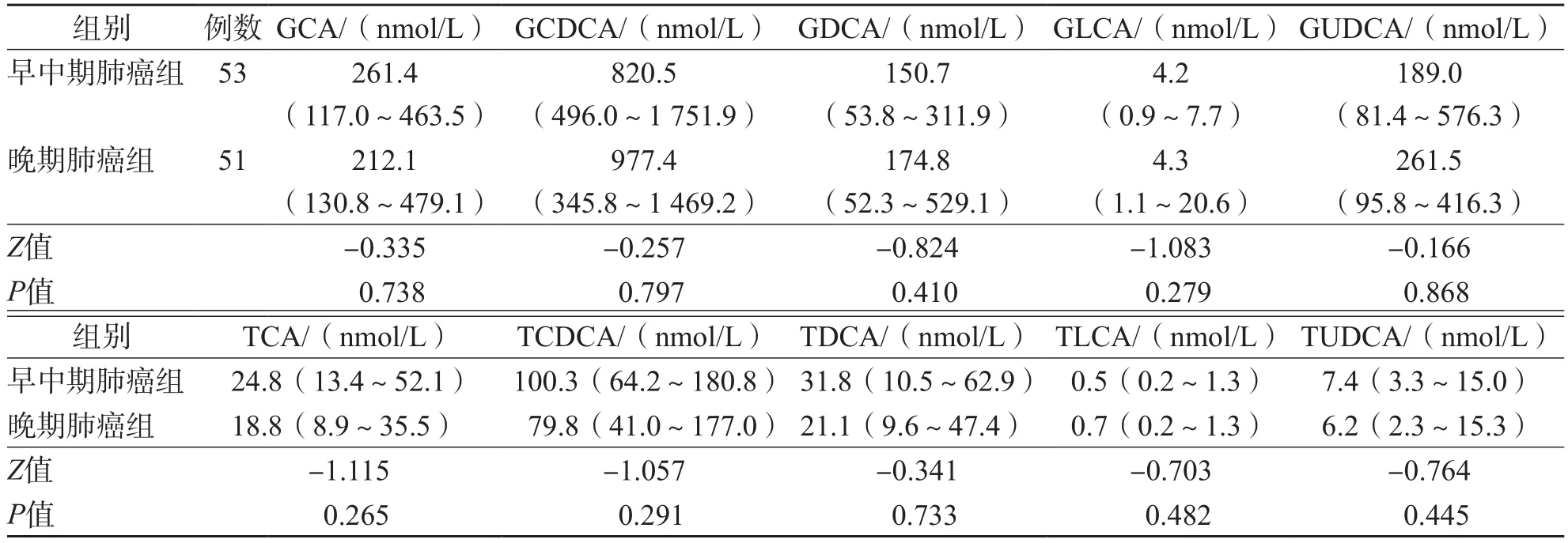
表4 早中期肺癌组及晚期肺癌组之间血清结合胆汁酸水平的比较 M(P25~P75)
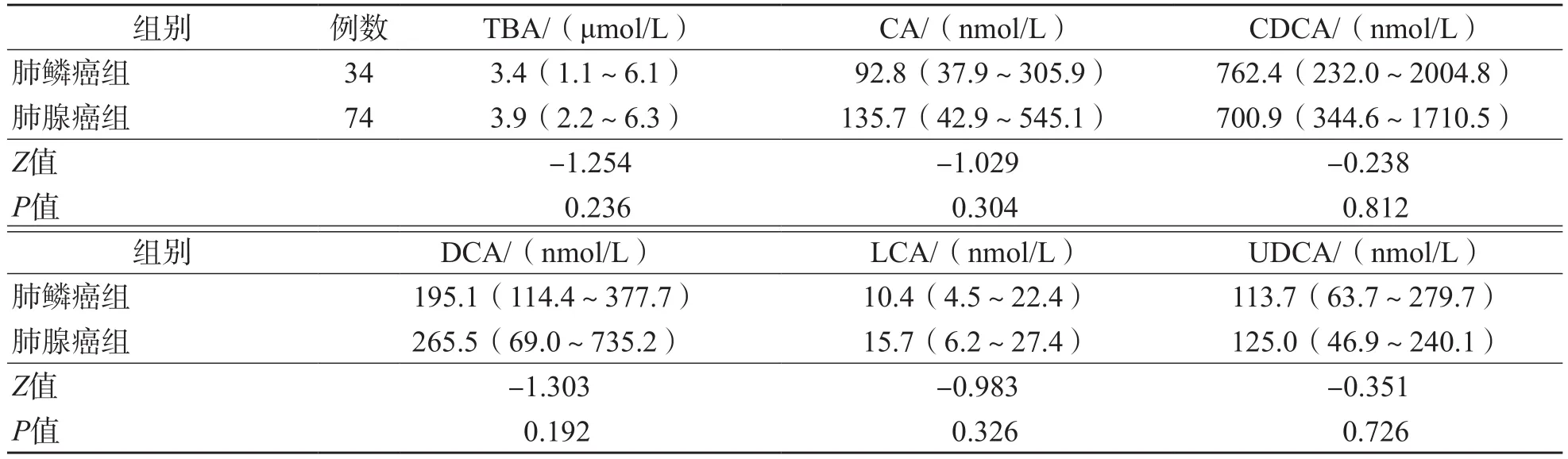
表5 肺鳞癌组及肺腺癌组之间血清TBA及游离胆汁酸水平的比较 M(P25~P75)

表6 肺鳞癌组及肺腺癌组之间血清结合胆汁酸水平的比较 M(P25~P75)

表7 肺炎组与肺癌组血清5种肿瘤标志物水平的比较 M(P25~P75)

表8 7种胆汁酸和2种肿瘤标志物鉴别诊断肺炎与肺癌的价值
2.5 肺炎与肺癌鉴别诊断模型的建立
2.5.1 诊断模型建立 随机抽取样本量的70%组成训练样本,其中肺炎患者56例、肺癌患者76例。将2个组之间有差异的9项指标(CA、CDCA、DCA、LCA、UDCA、GDCA、GLCA、CEA、CYFRA21-1)纳入逐步法二元Logistic回归分析。结果显示,DCA、CDCA、CYFRA-211是鉴别诊断肺炎和肺癌的主要影响因素,见表9。据此建立诊断模型Y=1/(1+e-LogitP),式中LogitP=0.007×DCA+0.001×CDCA+0.176×CYFRA21-1-2.293,模型系数综合检验和Hosmer-Lemeshow检验结果显示,模型拟合度良好(χ2=62.10,P<0.05;χ2=5.58,P>0.05)。
2.5.2 诊断模型Y鉴别诊断肺炎与肺癌的效能分析 ROC曲线分析结果显示,诊断模型Y鉴别诊断肺炎与肺癌的AUC(95%CI)为0.873(0.804~0.925),最佳临界值为0.52,敏感性CT)也存在过度诊断、辐射量大等不足[12]。因此,血清学标志物对肺癌和肺炎的辅助鉴别诊断至关重要。现阶段肺癌的血清学筛查和诊断主要依靠CEA、NSE等肿瘤标志物,这些肿瘤标志物在区分肺癌患者与健康人时具有较高的敏感性和特异性[11],但由于大部分肿瘤标志物在肺部炎症时也会有不同程度地升高,因此在对肺癌和肺炎进行鉴别诊断时往往不能达到令人满意的效果[13]。
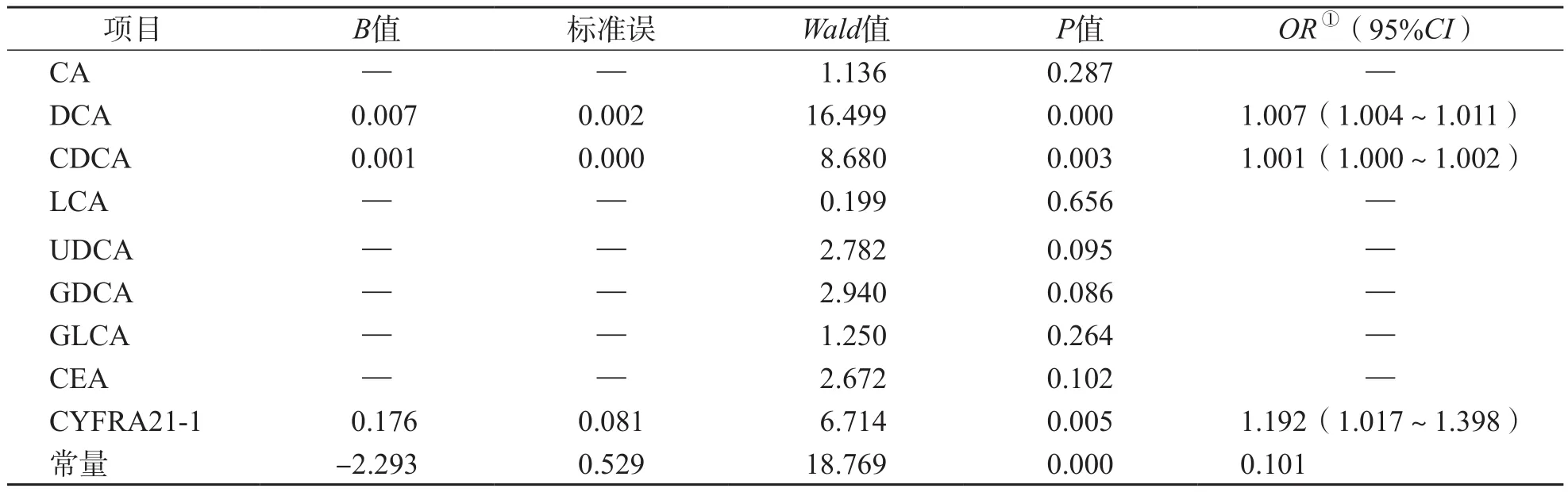
表9 训练样本9项指标逐步法二元logistic回归分析结果
胆汁酸是胆汁的重要成分,各类游离胆汁酸是FXR、TGR5等胆汁酸受体的主要配体[14],游离胆汁酸的改变会进一步导致结合胆汁酸的改变。本研究结果显示,与正常对照组比较,肺癌患者血清胆汁酸谱以初级游离胆汁酸CA、CDCA升高为主要特征,与LIU等[8]的研究结果基本一致。对胆汁酸受体的最新研究结果表明,肺癌患者血清游离胆汁酸水平与癌组织中胆汁酸受体的表达呈明显正相关,一些游离胆汁酸可活化肺癌细胞中的胆汁酸受体,使其表达升高,而在高于正常水平的情况下,胆汁酸受体能进一步促进肿瘤的增殖[8],如FXR能通过激活细胞周期蛋白-D1促进肺部肿瘤的增殖[9],TGR5能通过激活两面神激酶2(janus kinase 2,JAK2)/信号转导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)信号通路刺激肺部肿瘤细胞的增殖[8]。因此,高水平的游离胆汁酸可能是推动肺癌进展的原因之一。此外,本研究结果显示,肺炎患者血清胆汁酸谱以次级游离胆汁酸DCA、LCA、UDCA降低为主要特征。在动物模型中,胆汁酸受体激动剂已被证实是治疗肺部炎症性纤维化的可能手段[15],胆汁酸受体TGR5可为89.3%,特异性为75.4%,符合率为82.4%。见图1。
2.5.3 诊断模型Y的验证 将剩余样本(肺炎24例、肺癌32例)作为验证样本,代入诊断模型Y进行验证。共检出18例肺炎患者和25例肺癌患者,总符合率为76.8%,与ROC曲线分析结果基本符合。

图1 诊断模型Y鉴别诊断肺炎与肺癌的ROC曲线
3 讨论
目前,临床病理分期,即TNM分期仍是预测肺癌患者生存时间最主要的指标[1],而高误诊率是肺癌确诊时分期晚、预后差的主要原因之一。有研究结果显示,在我国部分地区,40岁以下人群中肺癌的误诊率可达50%以上,且主要误诊为肺炎[10]。这是由于肺癌的早期症状多为咳嗽、呼吸困难、发热等,与肺炎极为相似。胸部X线检查由于缺乏特异性,常被阻塞性肺炎和肺不张等掩盖了肺部肿瘤病变的特征[11]。电子计算机断层扫描(computed tomography,通过抑制核因子-κB(nuclear factor-kappa B,NF-κB)信号通路的激活来达到抑制肺部炎症的效果[6],同时FXR还可通过抑制脂多糖促进的肺部某些促炎细胞因子的分泌,达到抑制炎症的作用,但此过程中会大量消耗胆汁酸受体[7,16],这可能是一些游离胆汁酸水平降低的原因。
本研究对肺癌组和肺炎组的胆汁酸谱进行了比较,同时还纳入了5种临床常用的肿瘤标志物,对胆汁酸谱和常用肿瘤标志物的诊断效能进行综合评价。结果显示,肺癌组与肺炎组之间有5种游离胆汁酸(CA、CDCA、DCA、LCA、UDCA)、2种结合胆汁酸(GDCA、GLCA)及2种肿瘤标志物(CEA、CYFRA21-1)差异有统计学意义(P<0.01),单个指标中鉴别诊断效能最好的是DCA,AUC为0.781,敏感性为73.2%,特异性为77.5%。将上述9项指标纳入逐步法二元Logistic回归分析,联合诊断的最优组合是CDCA、DCA、CYFRA21-1,其中CDCA是FXR最有效的内源性配体[17];在所有稳定参与肠肝循环的胆汁酸中,DCA是TGR5最强的天然激动剂[18];CYFRA21-1是对非小细胞肺癌最敏感的肿瘤标志物。3项指标组成的诊断模型鉴别诊断肺炎与肺癌的敏感性为89.3%,特异性为75.4%,AUC为0.873,诊断效能明显优于单项指标。
本研究结果显示,肺炎组、肺癌组与正常对照组之间血清TBA水平差异均无统计学意义(P>0.05)。这可能是由于胆汁酸的合成、转运和代谢过程复杂,受多种因素调节,在不同疾病状态下胆汁酸的组分呈现不同的改变,而总量却保持不变所致。肺鳞癌组与肺腺癌组之间、早中期肺癌组与晚期肺癌组之间血清胆汁酸谱差异均无统计学意义(P>0.05)。因此,血清胆汁酸谱无法区分肺癌的分期和类型。
由于本研究未对小细胞肺癌与其他良性肺部疾病,如肺结核等的胆汁酸谱进行分析,也尚未纳入鳞状上皮细胞癌抗原、胃泌素释放肽前体等与肺部肿瘤相关的标志物,因此后续研究将进一步扩展验证,继续揭示胆汁酸谱在肺癌和其他肺部疾病中的作用和意义。
综上所述,血清胆汁酸谱的变化与肺部疾病的有一定关系,胆汁酸谱有成为肺癌诊断标志物的潜能。但目前关于肺癌血清胆汁酸谱的研究很少,因此本研究的结论和诊断模型还需大样本、多中心研究加以验证。
