不同eGFR公式与ACR联合应用在肾功能损伤高危人群中的临床价值
2021-02-05徐文俊李甲勇李会丹
徐文俊,李甲勇,李会丹
(上海交通大学附属第一人民医院检验医学中心,上海 200080)
慢性肾病(chronic kidney disease,CKD)是各种原因引起肾脏结构和功能异常的一类疾病,以出现肾脏损伤标志物或肾小球滤过率(glomerular filtration rate,GFR)<60 mL/(min·1.73 m2)且持续时间超过3个月为诊断标准。根据GFR分期标准,G2期属于肾功能下降早期、肾功能轻度受损,G3~G5期为肾功能中度受损至肾功能衰竭[1]。高血压、糖尿病、心血管疾病等慢性疾病患者是肾功能损伤的危险人群,常会继发CKD。全世界CKD患病率为14.3%,我国18岁以上人群的患病率为10.8%[2],若能早期诊断,尽早干预,即可显著改善患者肾功能。长久以来,临床将估算肾小球滤过率(estimated glomerular filtration rate,eGFR)作为诊断、监测肾功能的首选指标,但各估算公式由于标志物的不同,导致计算结果与实际GFR出现不同程度的偏差,在不同种族、人群和性别中的适用性也不同。另外,尿白蛋白/肌酐比值(albumin to creatinine ratio,ACR)是判断肾小球滤过膜电荷、机械屏障受损的敏感指标,其价值越来越为被临床认可[3]。为此,本研究拟探讨基于胱抑素C(cystatin C,Cys C)的eGFR对基于血清肌酐(serum creatinine,SCr)的eGFR的弥补作用以及联合ACR后对提高高危人群中肾功能损伤和早期肾功能下降检出率的价值。
1 材料和方法
1.1 研究对象
选取2016年1月—2017年12月上海市第一人民医院内分泌科和肾内科的住院患者1 253例,通过查阅患者病史,收集性别、年龄、身高、体重、SCr、血清Cys C、ACR、血清尿素、血清尿酸(uric acid,UA)、基于99m锝-二乙烯三胺五乙酸(99mtechnetium-diethylene triamine pentaacetic acid,99mTC-DTPA)肾动态显像法的测量肾小球滤过率(measuring glomerular filtration rate,mGFR)及基础病史等资料。计算体质量指数(body mass index,BMI)及体表指数(body surface area,BSA),BMI(kg/m2)=体质量(kg)/身高(m)2,BSA=0.007 184×体质量(kg)0.425×身高(cm)0.725。排除标准:(1)患急性肾脏病或急性肾功能不全;(2)既往做过一侧或双侧肾脏手术,如肾移植、肾切除等;(3)合并肾脏其他疾病,如肾脏占位、严重肾积水等;(4)肾动态显像前1周内做过透析治疗;(5)合并水肿、胸腔积液、腹腔积液或甲状腺疾病、病毒性肝炎(不含肝炎病毒携带者);(6)肢体、五官及体表不全;(7)正在服用药物,尤其是苯羟磺酸钙、甲氧苄啶和西米替丁;(8)前3个月应用过激素;(9)患白血病或恶性肿瘤。根据以上排除标准,共入选符合CKD诊断标准的患者850例,男511例,年龄59(51~67)岁,女性339例,年龄62(55~71)岁。850例患者中患糖尿病559例(65.8%)、高血压540例(63.5%)、冠心病165例(19.4%)、动脉粥样硬化599例(70.5%)。参照mGFR结果并依照肾脏病预后质量倡议(the Kidney Disease Out-comes Quality Initiative,K/DOQI)指南的分期标准,将850例患者分为6期,具体结果见表1。以G2期为早期肾功能下降,以G3~G5期为肾功能受损。

表1 肾功能分期标准及患者分期结果
1.2 样本采集及测定
采用干燥真空无菌管采集所有对象入院后第2天清晨空腹静脉血,1 000×g离心10 min,分离血清;同时留取10 mL晨尿(中段),1 000×g离心5 min,取上清。
SCr、血清尿素、血清UA、血清Cys C及尿Cr采用cobas 8000全自动生化分析仪(瑞士罗氏公司)及配套试剂检测。尿微量白蛋白(microalbumin,mAlb)采用BNⅡ特定蛋白分析仪及配套试剂(德国西门子公司)检测。严格按标准操作规程进行操作,所有仪器质控均在控。
1.3 mGFR
mGFR采用核素肾动态显像Gate'S法[4]测定,检测仪器为EXCEL EVO型单光子发射计算机断层扫描系统(德国西门子公司),配低能高分辨率平行孔准直器(能峰140 keV,窗宽±20%)。99mTC-DTPA由上海原子科兴药业有限公司提供。显像前20~30 min使患者充分水化(常规饮水300~500 mL),于前臂肘静脉弹丸式注射99mTC-DTPA 0.5 mL(185 MBq/mL)后立即进行双探头前后位动态采集图像。前1 min采集血流灌注相,2 s/帧,共30帧;后20 min采集皮质功能相,1 min/帧,共20帧。在后期处理软件中输入患者的身高、体质量信息,勾画肾脏及本底的感兴趣区(region of interest,ROI)并采用Gate'S法测定双侧肾脏的GFR。本研究中mGFR为双侧肾脏mGFR之和。
1.4 eGFR公式[5]
分别采用3种基于SCr的eGFR公式(CKDEPI 2009SCr公式、简化MDRD方程和改良MDRD方程)、6种基于Cys C的eGFR公式(CKD-EPI 2012Cys C公式、Grubb公式、Arnal-Dade公式、Rule公式、Macisaac公式、Tan公式)和1种基于Cys C、SCr联合检测的eGFR公式(CKD-EPI 2012SCr-Cys C公式)计算eGFR。见表2。

表2 各种eGFR公式
1.5 统计学方法
采用SPSS 19.0软件进行统计分析。采用K-S检验进行正态性检验。呈正态分布的数据以±s表示,组间比较采用t检验。呈非正态分布的数据以中位数(M)[四分位数(P25~P75)]表示,2个组之间比较采用Mann-WhitneyU检验,多组间比较采用Kruskal-Wallis检验。计数资料以率表示,组间比较采用χ2检验。各项目之间的相关性采用Spearman相关分析。eGFR与mGFR的一致性采用Bland-Altman一致性分析进行评价。以P<0.05为差异有统计学意义。
2 结果
2.1 不同性别的CKD患者之间一般资料及eGFR、mGFR的比较
男、女性CKD患者基于SCr的eGFR水平均高于mGFR(P<0.01),基于血清Cys C的eGFR水平均低于mGFR(P<0.01)。见表3。
2.2 不同公式计算的eGFR之间及与mGFR的相关性
2.2.1 基于SCr的3种eGFR公式之间及与mGFR的相关性 eGFR简化MDRD、eGFR改良MDRD、eGFRCKD-EPI2009SCr与mGFR均呈正相关(r值分别为0.800、0.799、0.812,P<0.01);eGFR简化MDRD、eGFR改良MDRD和eGFRCKD-EPI2009SCr之间均呈正相关(P<0.01)。见表4。
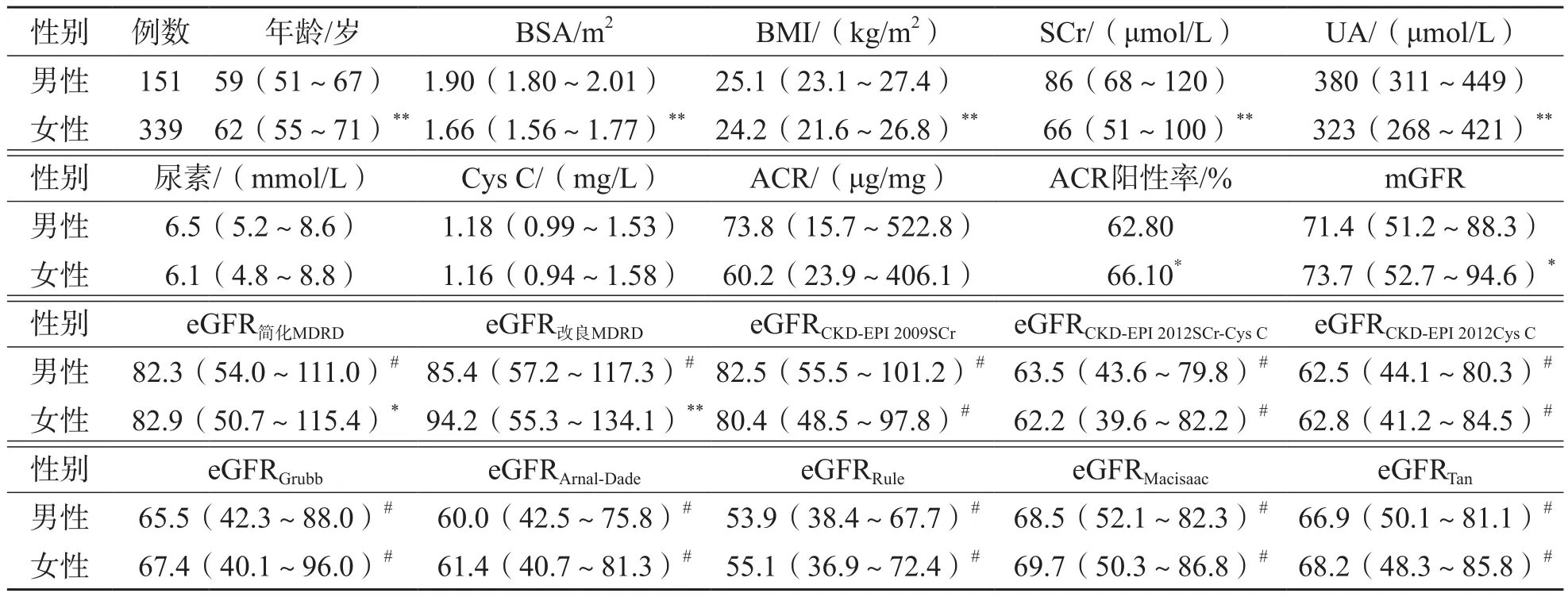
表3 CKD患者不同性别之间一般资料及eGFR、mGFR的比较

表4 基于SCr的eGFR之间及与mGFR的相关性 r值
2.2.2 基于Cys C的6种eGFR公式之间及与mGFR的相关性 eGFRMacisaac、eGFRRule、eGFRTan、eGFRGrubb、eGFRCKD-EPI2012CysC、eGFRArnal-Dade均与mGFR呈正相关(r值分别为0.793、0.793、0.793、0.793、0.809、0.793,P<0.01);eGFRMacisaac、eGFRRule、eGFRTan、eGFRGrubb、eGFRCKD-EPI2012CysC和eGFRArnal-Dade之间均呈正相关(P<0.01)。见表5。
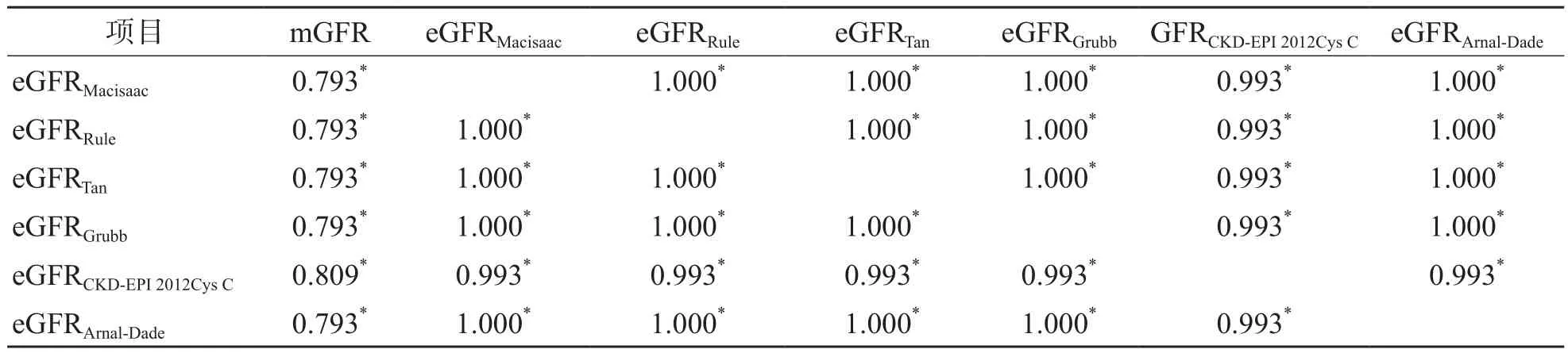
表5 基于Cys C的eGFR之间及与mGFR的相关性 r值
2.2.3 基于SCr和Cys C联合检测的eGFR公式与mGFR的相关性 eGFRCKD-EPI2012SCr-CysC与mGFR呈正相关(r=0.838,P<0.01)。
2.3 eGFR与mGFR的一致性
Bland-Altman一致性分析结果显示,基于SCr的3种eGFR公式计算出的eGFR与mGFR的平均偏差为-4.2~-20.8 mL/(min·1.73 m2),高估了患者的GFR,落在界限外的百分比为2.71%~3.18%。基于Cys C的6种eGFR公式计算出的eGFR与mGFR的平均偏差为3.7~16.9 mL/(min·1.73 m2),低估了患者的GFR,落在界限外的百分比为2.94%~3.76%。基于SCr与Cys C联合检测的eGFR公式计算出的eGFR与mGFR的平均偏差为9.6 mL/(min·1.73 m2),低估了患者的GFR,落在界限外百分比为3.53%。
基于SCr的3种eGFR公式中以eGFRCKD-EPI2009Scr与mGFR的一致性最好,基于Cys C的6种eGFR公式中以eGFRMacisaac与mGFR的一致性最好,基于SCr与Cys C联合检测的eGFRCKD-EPI2012SCr-CysC与mGFR的一致性结果不理想。见表6、图1、图2。
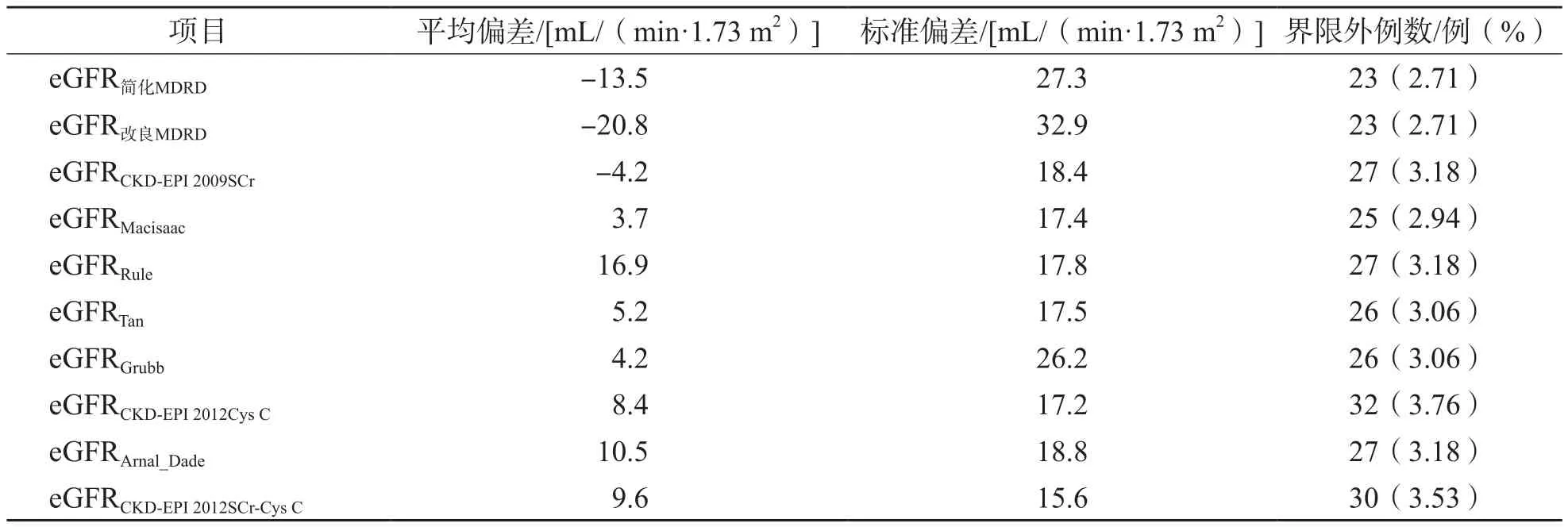
表6 不同eGFR公式得出的eGFR与mGFR的Bland-Altman一致性分析
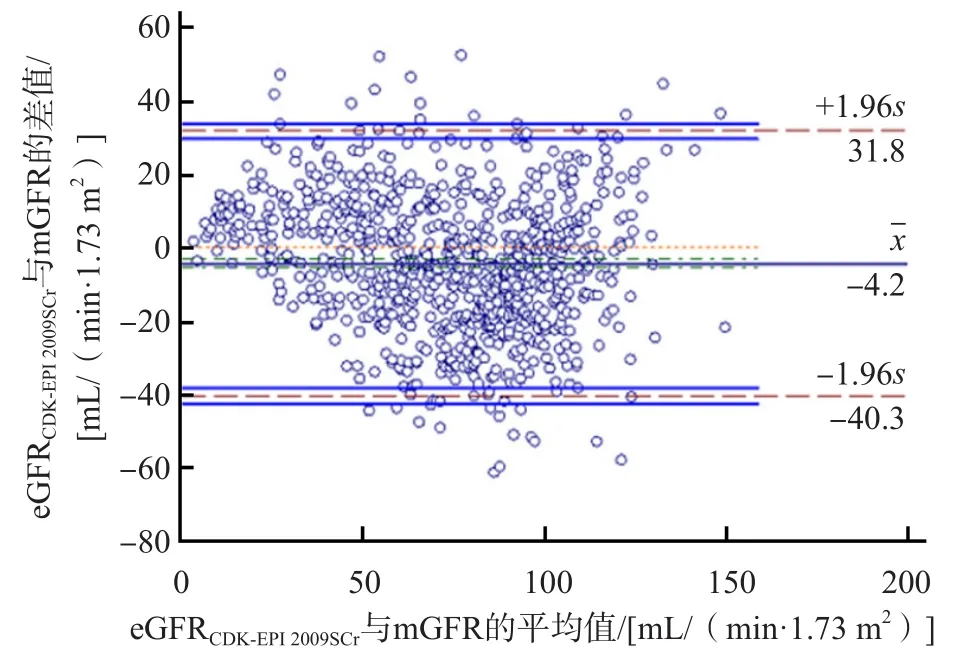
图1 eGFRCKD-EPI 2009SCr与mGFR的Bland-Altman图

图2 eGFRMacisaac与mGFR的Bland-Altman图
2.4 基于SCr的eGFR公式联合eGFR-sCys C和/或ACR对肾功能异常检出率的分析
以eGFRCDK-EPI2009SCr为基于SCr的eGFR公式的代表,以eGFRMacisaac为基于Cys C的eGFR公式的代表,联合ACR进行肾功能异常检出率的分析。将因eGFRCDK-EPI2009SCr>mGFR导致G2期误分为G1期或G3~G5期误分为G2期作为eGFRCDK-EPI2009SCr漏检。
在G2期患者中,依据eGFRCDK-EPI2009SCr结果漏检患者为154例(45.4%),其中分别有122例(79.2%)和86例(55.8%)可依据eGFRMacisaac60~<90 mL/(min·1.73 m2)和ACR>30 μg/mg被检出,eGFRMacisaac与ACR联合可检出135例(87.7%)。
在G3~G5期患者中,依据eGFRCDK-EPI2009SCr结果漏检患者为90例(31.1%),其中分别有39例(43.3%)和55例(61.1%)可依据eGFRMacisaac<60 mL/(min·1.73 m2)和ACR>30 μg/mg被检出。eGFRMacisaac与ACR联合可检出66例(73.3%)。
分别用eGFRCKD-EPI2009SCr、eGFRCKD-EPI2009SCr+eGFRMacisaac、eGFRCKD-EPI2009SCr+ACR、eGFRCKD-EPI2009Scr+eGFRMacisaac+ACR 4种模式对G2期、G3期~G5期患者进行筛查,G2期以满足eGFRCKD-EPI2009SCr或eGFRMacisaac<90 mL/(min·1.73 m2)、ACR>30 μg/mg中任意一项为阳性检出,G3~G5期满足以eGFRCKD-EPI2009SCr或eGFRMacisaac<60 mL/(min·1.73 m2)、ACR>30 μg/mg中任意一项为阳性检出。在G2期和G3~G5期的筛查中,eGFRCKD-EPI2009SCr+eGFRMacisaac+ACR模式可将阳性检出率分别提高至94.4%、91.7%。见表7。

表7 4种检测模式对G2期和G3~G5期患者检出率的比较
2.5 eGFRCKD-EPI 2009SCr+eGFRMacisaac+ACR联合应用漏检患者血清尿素、UA水平分析
G2期患者采用eGFRCKD-EPI2009SCr+eGFRMacisaac+ACR模式判别后仍有19例患者被漏检,漏检患者的血清尿素水平明显高于G1期患者(P<0.05),而血清UA水平差异无统计学意义(P>0.05)。见表8。
G3~G5期患者采用eGFRCKD-EPI2009Scr+eGFRMacisaac+ACR判别后仍有24例患者被漏检,漏检患者的血清尿素、UA水平与G1期+G2期患者比较,差异均无统计学意义(P>0.05)。见表9。

表8 eGFRCKD-EPI 2009SCr+eGFRMacisaac+ACR模式判别G2期漏检患者的血清尿素、UA水平分析M(P25~P75)

表9 eGFRCKD-EPI 2009SCr+eGFRMacisaac+ACR模式判别G3~G5期漏检患者的血清尿素、UA水平分析M(P25~P75)
3 讨论
流行病学统计结果显示,我国CKD患者数在2012年就已达到了1.2亿,且呈逐年上升趋势[2]。高血压、糖尿病和心血管疾病等高发慢性病大大增加了肾脏损伤的风险[1]。肾脏一旦形成器质性损伤,病情就不可逆转,前驱病因的持续存在或加剧促进了肾功能衰竭的发生。本研究患者中有65.8%患糖尿病、63.5%患高血压、19.4%患冠心病、70.5%患动脉粥样硬化。在这些基础疾病的持续负作用下,本研究1 253例患者中仅有26.1%的患者肾功能正常(G1期),39.9%的患者出现早期肾功能下降(G2期),剩余44.0%的患者肾功能受损(G3~G5期)。处于G2期的患者通过早期干预、慎用药物、着重监测,发展为G3期以上的风险将大大降低。处于G3~G5期的患者的生存时间和生存质量将受到影响,除了要更加谨慎地对待肾脏功能下降的趋势外,更要面临考虑最终措施——透析或移植。因此,对于肾脏功能的正确评估是临床关注的焦点及患者预后的重点[6]。
目前,国内、外均以mGFR作为临床评估肾脏功能的金标准,但由于准备和操作过程繁琐,且为有创检查,需要使用同位素制剂,因此其在临床上的应用受到了一定的限制[4]。与mGFR结果有较好一致性的eGFR,仅需采集患者血液检测SCr、Cys C就可计算GFR,现已作为肾功能筛查的有效方法。目前临床上已有多个eGFR公式,但对于各种公式的适用人群范围、适用肾功能阶段及与mGFR的一致性等问题始终存在不同的观点[7-10]。因此,为了更准确地反映肾功能改变,需要选出最适合本地区人群的代表公式。本研究结果显示,基于SCr的3种eGFR公式之间和基于Cys C的6种eGFR公式之间均呈正相关(P<0.01),说明基于同一标志物计算出的eGFR结果具有同一趋势。Bland-Athman一致性分析结果显示,eGFRCKD-EPI2009SCr与mGFR呈正相关(r=0.812,P<0.01),平均偏差为-4.2 mL/(min·1.73 m2),高估了患者的GFR;eGFRMacisaac与mGFR呈正相关(r=0.793,P<0.01),平均偏差为3.7 mL/(min·1.73 m2),低估了患者的GFR。依据一致性分析结果,以eGFRCKD-EPI2009SCr为基于SCr的eGFR公式的代表,以eGFRMacisaac为基于Cys C的eGFR公式的代表。
除了GFR,ACR也是诊断肾功能损伤的常用指标之一。在相关共识中,均以GFR<60 mL/(min·1.73 m2)或ACR≥30 μg/mg持续3个月及以上作为诊断CKD的重要标准[1,11]。美国肾脏病协会(the National Kidney Foundition,NKF)也明确将ACR列入CKD诊断标准,并且要求在3~6个月内至少检测3次ACR,有2次异常方可诊断为CKD[12]。但在实际工作中,以SCr及基于SCr的eGFR为主的临床筛查、诊断过程较为常见,ACR的使用远不及eGFR。
由于eGFR是通过血流灌注、肾脏滤过水平来反映肾脏功能,因此也有局限性,且受诸多因素影响。在有些情况下是血流灌注降低而非肾实质受损,如突发的心力低下造成大循环血流不足,从而降低肾脏灌注;肝硬化患者大量腹水时由于醛固酮水平异常而并发“肝性肾病”,表面上出现SCr、UA水平升高及尿量减少,提示肾脏灌注不足,其实肾实质并未受到损伤,腹水消除后,肾功能恢复正常;还有些情况是肾实质已经受损但血流灌注仍未降低,如自身免疫性肾病,沉积的自身抗体激活补体损伤肾小球基底膜,早期因屏障效应降低导致尿微量白蛋白出现,后期演变成肾小球硬化时GFR才开始出现明显下降。所以对于肾功能的全面评价,有必要将GFR与ACR联合应用。本研究结果显示,在G2期和G3~G5期使用eGFRCKD-EPI2009SCr判断后漏检的患者中分别有55.8%和61.0%的患者ACR异常。
由于SCr和血清Cys C在反映肾功能上有一定的差异,所以基于SCr或Cys C的eGFR也会出现一定的差异[13]。如单一使用基于SCr的eGFR,会造成一部分患者漏检。本研究结果显示,在G3~G5期患者中,有31.1%的患者eGFRCKD-EPI2009SCr>60 mL/(min·1.73 m2),出现高估患者GFR而漏检的情况,通过eGFRMacisaac或ACR可以检出其中43.3%或61.1%的患者,二者联合可以检出其中的73.3%;在G2期患者中,有45.4%的患者GFRCKD-EPI2009SCr>90 mL/(min·1.73 m2),出现高估患者GFR而漏检的情况,通过eGFRMacisaac或ACR可以检出其中79.2%或55.8%的患者,二者联合应用可检出其中87.7%的患者。在G2期患者中,eGFRCKD-EPI2009Scr、eGFRMacisaac和ACR联合应用可将检出率提高至94.4%;在G3~G5期患者中,可提高至91.7%。由此可见,基于SCr的eGFR、基于Cys C的eGFR和ACR联合应用可显著提高高危人群中肾功能损伤与早期肾功能下降者的检出率。但三者联合应用后仍存在一定的漏检情况,分析这些漏检患者的情况,仅G2期中漏检患者的血清尿素水平高于G1期患者(P<0.05),其他项目差异均无统计学意义(P>0.05)。提示由此入手寻找相关切点来完善肾功能改变的检出是有可能的。然而由于样本量的限制,本研究未能给出相关结论,这也是本研究的不足之处。另一个不足就是所有患者的ACR仅检测了1次,且无24 h尿蛋白结果,这也可能是本研究使用ACR判断G2期漏检患者肾功能损伤的敏感性不及eGFRMacisaac的原因。
综上所述,基于SCr的eGFR存在高估患者GFR的情况,将eGFRCKD-EPI2009SCr、eGFRMacisaac和ACR联合应用可以有效解决这一问题。虽然Cys C是一个较敏感的肾功能标志物,但基于Cys C的eGFR会出现低估肾功能的情况。然而,该低估情况恰是一个肾功能损伤的风险提示,反而高估肾功能极易导致临床忽视,进而产生不良后果。目前,对于eGFR公式的选择和联合ACR的使用尚无统一标准,实际工作中如何进行取舍需要通过循证及大数据的验证,期望本研究结果能为临床相关工作提供借鉴。
