123I-MIBG SPECT/CT断层显像在儿童神经母细胞瘤Curie评分中的价值分析
2021-02-05杨吉刚
王 巍 鲁 霞 刘 俊 阚 英 刘 洁 杨吉刚
(首都医科大学附属北京友谊医院核医学科,北京 100050)
神经母细胞瘤是儿童时期最常见的颅外实体肿瘤,该肿瘤的一大特点是肿瘤异质性较大,部分低危的患儿可自行缓解,但部分高危的患儿即使接受了诱导化学药物治疗(以下简称化疗)、巩固化疗、手术及免疫治疗,其预后仍然较差。因此在治疗过程中,早期对疾病的全身状况进行准确评估对于患者的进一步治疗及预后评估有着重要的意义[1-2]。123碘-间碘苄胍(123I-metaiodobenzylguanidine,123I-MIBG)对神经母细胞瘤的检测具有极高的特异度和灵敏度,已广泛应用于该病的诊断、分期和疗效监测等方面。为了评估肿瘤负荷及量化治疗反应,目前已经开发了多种半定量评分系统,其中Curie评分应用最为广泛,可用于神经母细胞的预后、疗效判断等方面[3-4]。Curie评分的高低与患者的预后密切相关,有研究[3]指出,Curie评分高于2分的患者,预后较差。因此获得准确的Curie评分对于患者的诊治具有重要的价值。
以往的Curie评分都是基于123I-MIBG平面显像所获得,而单光子发射型计算机断层成像(single-photon emission computed tomography,SPECT/CT)相较于123I-MIBG平面显像具有空间分辨率高、图像清晰等优势,对于神经母细胞瘤病灶的判断具有重要的价值,从而可能会影响Curie评分[5]。但是极少有研究探讨123I-MIBG SPECT/CT断层显像在Curie评分中的价值。因此本研究探讨了123I-MIBG SPECT/CT断层显像在儿童神经母细胞瘤Curie评分中的价值。
1 对象与方法
1.1 研究对象
收集2018年6月至2020年6月在首都医科大学附属北京友谊医院核医学科行123I-MIBG全身平面显像和局部SPECT/CT断层显像的神经母细胞瘤患儿211例,其中术前9例,术后202例;男性113例,女性98例,平均年龄(5.07±2.95)岁。所有患儿均经病理组织学证实为神经母细胞瘤。术前的患儿行123I-MIBG显像主要是对疾病进行分期、评估全身病情;术后的患儿可能接受了诱导化疗、巩固化疗、手术、放射治疗(以下简称放疗)、131I-MIBG治疗、免疫治疗、骨髓移植等单独治疗或联合治疗,行123I-MIBG显像的主要目的是评估治疗疗效、监测有无复发。
1.2 123I-MIBG的显像方法
在显像前3 d至显像后2 d,使用卢戈士碘液封闭甲状腺。123I-MIBG由北京原子高科股份有限公司提供(放化学纯度>95%,无菌、无热源)。按年龄和体质量静脉注射123I-MIBG 5.2 MBq/kg(37~370 MBq)[6]。注射后20~24 h进行前后位全身123I-MIBG平面显像和局部SPECT/CT断层显像。SPECT/CT局部断层显像主要集中于123I-MIBG平面显像不能确定的病变性质、可疑有病变的部位;如果平面显像阴性,则行术区的局部SPECT/CT断层显像。采用德国西门子公司生产的SPECT/CT(Symbia T16或Intevo 16)进行采集,采集时使用低能通用型准直器,矩阵为256×256。在平面显像后即刻进行局部SPECT/CT断层显像。
1.3 123I-MIBG图像分析
所有影像均由2名高年资核医学医师进行双盲评阅。如果产生不同的解释,则由上级医师参与判读,最后获得一致的意见。首先评估123I-MIBG平面显像,平面显像上任何的异常浓聚灶、浓聚远超周围背景组织或对侧相应部位,且除外器官或组织的生理性摄取,即可认为是病灶。平面显像后,随即行SPECT/CT局部断层显像。基于123I-MIBG平面显像和SPECT/CT断层显像及Curie评分标准,进行Curie评分。
病灶金标准的判断,依据以下标准的一项或多项:①获得病灶的病理组织学诊断;②123I-MIBG显像后,其他相关的影像学诊断,包括彩超、增强CT和磁共振(magnetic resonance imaging,MRI)、氟-18-脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG )正电子发射型计算机断层扫描显像(positron emission tomography/computed tomography, PET/CT)和治疗后的131I-MIBG SPECT/CT显像;③临床随访2~12个月明确为病灶。
Curie评分标准:人体分为10个区域(第10个区域是软组织),每个区域可得0~3分,全身最高得分30分;如果未见123I-MIBG异常浓聚,则为0分,如果有1个异常的病灶,得1分;如有2个异常的病灶,得2分;大于该区域范围50%,得3分。
1.4 统计学方法
2 结果
2.1 123I-MIBG平面显像和SPECT/CT断层显像的Curie评分的比较
在211例患儿中,SPECT/CT断层显像和123I-MIBG平面显像评分一致的患儿有103例(48.82%),不一致患儿有108例(51.18%)。其中患者Curie评分减少1分的有43人(20.38%),减少2分及以上的有3人(1.42%),增加1分的有30人(14.22%),增加2分的有20人(9.48%),增加3分及以上的有12人(5.69%)。同时SPECT/CT断层显像改变了27位(12.80%)123I-MIBG平面显像为阴性患者的Curie评分,其中Curie评分由0分改变为1分的有17人(8.06%),改变为2分的有8人(3.79%),改变为3分及以上的有2人(0.95%)。基于123I-MIBG平面显像的Curie评分为0(0,1)分,基于SPECT/CT断层显像的Curie评分为0(0,2)分,两种方法的Curie评分比较差异具有统计学意义(Z=-3.46,P<0.001)。Curie评分降低和增加的病例SPECT/CT断层显像见图1,2。
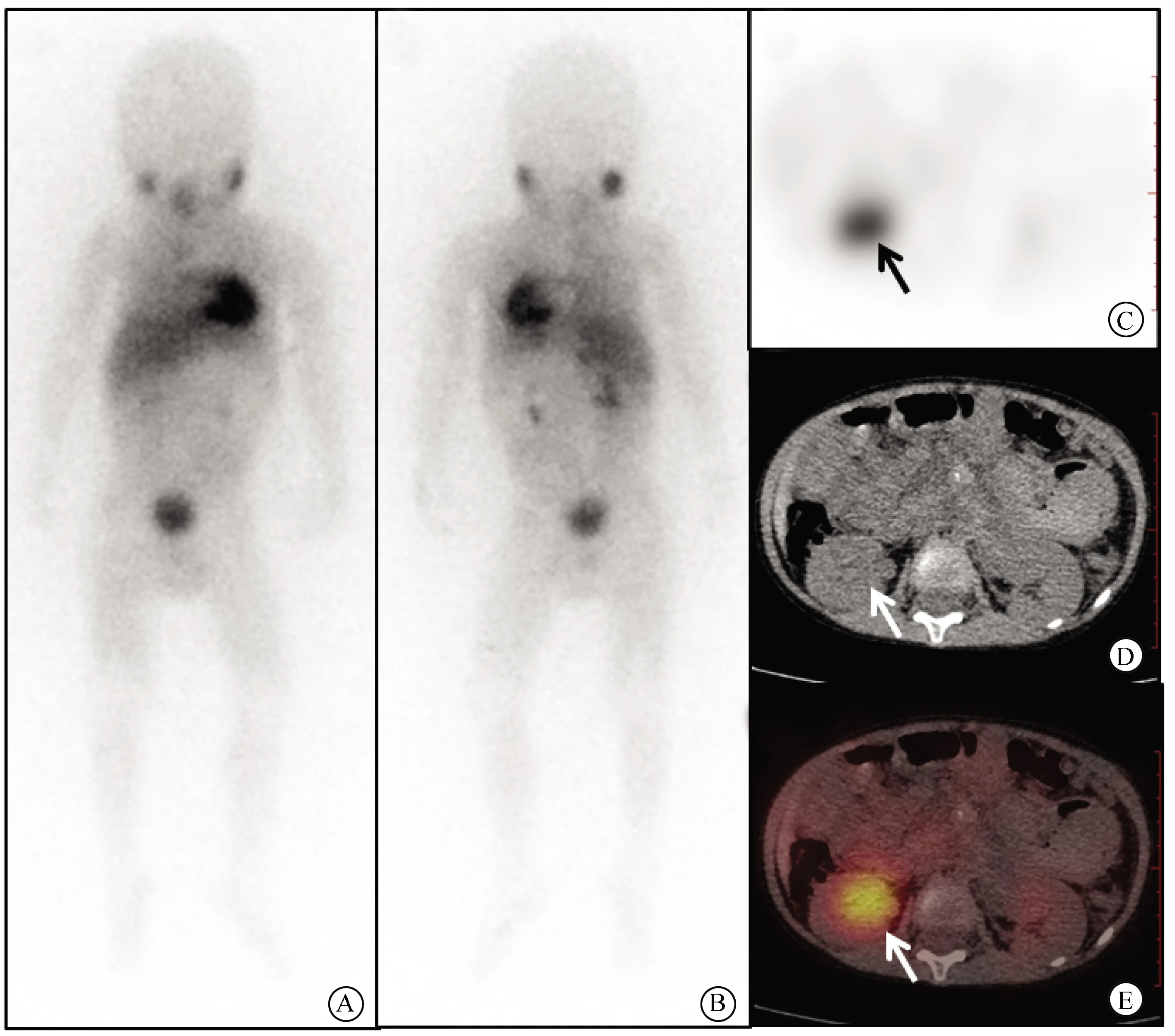
图1 SPECT/CT断层显像发现假阳性病灶,患者的Curie评分降低Fig.1 The SPECT/CT tomography imaging found false positive lesions and reduced patient’s Curie scoreA (anterior position) and B (posterior position): A 2 years old boy with the history of “left retroperitoneal neuroblastoma, pancreatic body and tail, pelvic lymph node resection”, underwent 123I-MIBG imaging to assess the recurrence of the disease, The 123I-MIBG planar imaging showed radiotracer in the right kidney area, and the Curie score was 1 point; C: 123I-MIBG SPECT/CT showed abnormal concentration of radioactivity in the right kidney area (black arrow); D: Urine retention was showed on CT (white arrow); E: the fusion image confirms this information, and the Curie score was 0 points based on 123I-MIBG SPECT/CT images (white arrow); SPECT: single-photon emission computed tomography; CT: computed tomography.
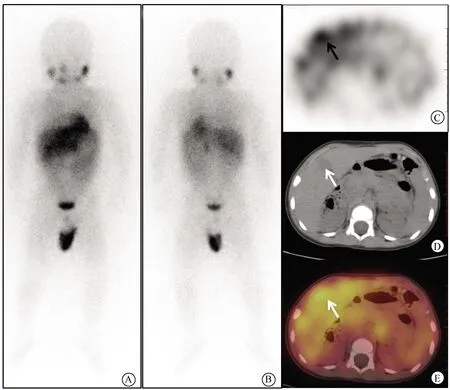
图2 SPECT/CT断层显像发现更多病灶,患者的Curie评分增加Fig.2 The SPECT/CT tomography imaging found more lesions and increased patient’s Curie scoreA (anterior position) and B (posterior position): A 21 months old boy with the history of right retroperitoneal neuroblastoma surgery and chemotherapy, underwent 123I-MIBG imaging to evaluate the therapeutic effect. The planar imaging did not show abnormal concentration of 123I-MIBG, and the Curie score was 0; C: The 123I-MIBG SPECT/CT tomography showed abnormal concentration of 123I-MIBG in the liver (black arrow); D: The Circular low-density shadow with clear border seen on CT (white arrow); E: The fusion image confirms the above information, and the Curie score is 1 point based on 123I-MIBG SPECT/CT tomography images (white arrow). SPECT: single-photon emission computed tomography; CT: computed tomography.
2.2 两种显像方法Curie评分分组的结果比较
依据Curie评分将患者分为高分组(≥2)和低分组(<2),比较123I-MIBG平面显像和SPECT/CT断层显像的分组结果。平面显像高分组有47人,低分组有164人;断层显像高分组62人,低分组149人。两种显像方式的患者分组,差异有统计学意义(P=0.001)。断层显像发现了更多的高分组患者,这可能会改变这部分患儿的后续治疗,详见表1。
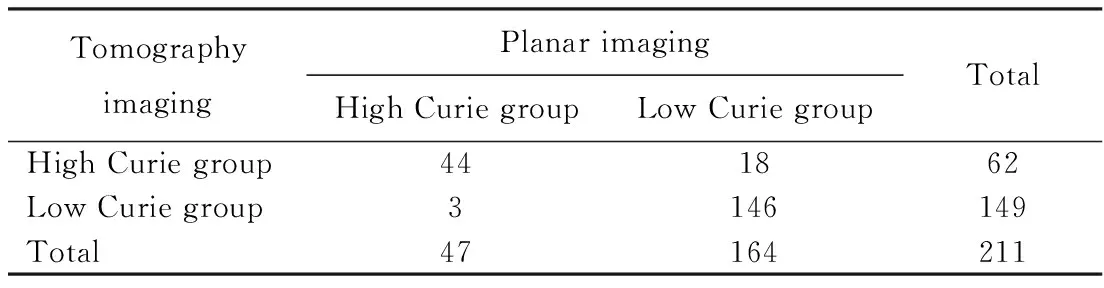
表1 SPECT/CT断层显像和平面显像Curie评分的差异性分析Tab.1 Comparison of the SPECT/CT planar imaging and tomography imaging in Curie scores
2.3 诊断价值分析
以金标准为依据,分别对123I-MIBG平面显像和SPECT/CT断层显像检测出的病灶与金标准进行比较,评估两种方法的诊断准确性。123I-MIBG平面显像和SPECT/CT断层显像对儿童神经母细胞瘤诊断准确率分别为51.66%(109/211)和93.84%(198/211),两种显像方法差异具有统计学意义(P<0.001),断层显像具有更高的准确性,详见表2。

表2 SPECT/CT断层显像和平面显像准确性的比较Tab.2 Comparison of diagnostic accuracy between theSPECT/CT planar imaging and tomography imaging
同时依据Curie评分,将患者分为0,1,2和3分及以上4组(3分以上由于分类太多,每类患者人数过少,为了便于计算将其简化为一组),分别比较不同显像方法与金标准的一致性。123I-MIBG平面显像和SPECT/CT断层显像与金标准的诊断一致性的Kappa值分别为0.44和0.90,平面显像一致性中等,而断层显像与金标准具有极好的一致性。断层显像具有更高的诊断准确率及诊断一致性,具有更高的诊断价值,更符合Curie评分的诊断要求。详见表3、4。

表3 平面显像的Curie评分与金标准的一致性分析Tab.3 Analysis of the consistency between the Curie scores of planar imaging and gold diagnosis results
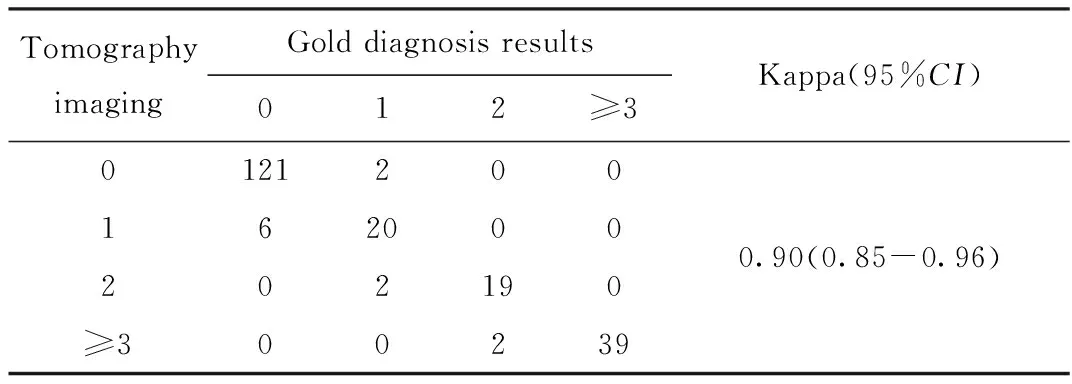
表4 断层显像的Curie评分与金标准的一致性分析Tab.4 Analysis of the consistency between the Curie scores of tomography imaging and gold diagnosis results
3 讨论
本研究显示,在211例患儿中,约48.82%的患儿基于123I-MIBG平面显像和SPECT/CT断层显像的Curie评分是一致的。而约51.18%患儿基于123I-MIBG平面显像和SPECT/CT断层显像的Curie评分存在差异。大多数神经母细胞瘤的细胞膜上有去甲肾上腺素转运蛋白的表达,MIBG是去甲肾上腺素的类似物,约90%的神经母细胞瘤可从血液中摄取MIBG,该摄取过程具有较高的特异性。MIBG被放射性123I或131I标记之后可用于神经母细胞瘤的诊断、疗效判断、疾病复发、随访等。但由于131I的物理特性并不适合用作诊断,因此123I标记的MIBG显像在国外广泛地应用于神经母细胞瘤的诊疗过程中,且多个指南[7-8]指出,123I-MIBG显像是神经母细胞瘤患儿“必须”的检查方法。2008年美国食品药品监督管理局批准123I-MIBG应用于神经母细胞瘤和嗜铬细胞瘤的诊断。123I-MIBG扫描结束后,基于图像不仅可做出定性诊断,而且可做出半定量的诊断。其中法国居里研究院[9]提出来的MIBG显像半定量积分法在临床上得到广泛的应用,该方法将全身的骨骼分为9个区域,全身的软组织作为第10个区域,根据每个区域病灶的多少和MIBG的摄取程度进行评分。Curie评分由于其简单、实用以及较好的可重复性,读片者内及读片者之间的一致性可高达92%~95%,因此在临床上广泛地应用于神经母细胞瘤的疗效评价[3]。但是目前的Curie评分是基于123I-MIBG平面显像,近年的多项研究[10-11]指出,123I-MIBG SPECT/CT断层显像可明显提高神经母细胞瘤诊断的灵敏度、特异度和准确性,降低假阳性、假阴性的发生。笔者前期的研究[12]显示:与123I-MIBG平面显像相比,123I-MIBG SPECT/CT断层显像改善了44.12%的术前神经母细胞瘤患儿的诊断和分期以及61.11%的术后神经母细胞瘤患儿的诊断。Liu等[13]研究了123I-MIBG SPECT/CT断层显像相比123I-MIBG平面显像在神经母细胞瘤的增益价值,结果发现,约39%的患儿的123I-MIBG SPECT/CT断层显像提供了额外的病灶信息,并影响了患儿的下一步诊疗计划。上述这些研究均强调了123I-MIBG SPECT/CT断层显像在神经母细胞瘤治疗中的重要性[14-16]。
Curie评分不仅用于神经母细胞瘤疗效的判断,而且用于预后评估。诱导化疗后,Curie评分≥2分的患者的预后明显比<2分的患者的预后差,5年生存率分别为(10.5%±10.0%)和(42.0%±5.8%)[17],另一项研究[3]也显示这两组患者的3年生存率分别为(15.4%±5.3%)和(44.9%±3.9%)。并且Curie评分<2分的患者,在诱导化疗后接受抗体治疗并不能改善预后,3年无病生存率分别为(48.7%±8.0%)和(43.9%±4.5%)。诱导化疗后,如果Curie评分≥2分,提示患者不良事件的发生率较高;且Curie评分≥2分是独立的预后危险因素,与禽类骨髓细胞瘤病毒癌基因神经母细胞瘤衍生同源基因(myelocytomatosis viral oncogene neuroblastoma derived homolog,MYCN)扩增、染色体畸变、组织学分级等都不相关。从这些研究就可以看出,准确的Curie评分在神经母细胞瘤的诊断、治疗、疗效判断、预后评估中有着非常重要的价值。而上述这些研究中,Curie评分均是基于MIBG平面显像,并不是基于123I-MIBG SPECT/CT断层显像。在本研究中,笔者将患者依据Curie评分的不同划分为高分组和低分组,并比较了123I-MIBG平面显像和SPECT/CT断层显像在分组上的差异,可以发现两种显像方法在分组上差异有统计学意义,断层显像明显地增加了高分组的患儿人数。基于笔者的研究,如将123I-MIBG SPECT/CT断层显像应用于Curie评分中,可能使患儿Curie评分半定量评估更加精准,更好的用于患儿的预后评估。
另外,本研究显示27例(12.80%,27/211)患者基于123I-MIBG平面显像的Curie评分是0分,而基于123I-MIBG SPECT/CT断层显像的Curie评分有不同程度的增加,这一研究结果对临床有非常重要的指导意义,对于MYCN扩增的神经母细胞瘤,如诱导化疗后仍存在MIBG的摄取(即Curie评分>0分),提示这些患者的3年无病生存率较低,约为(11.8%±7.8%),而Curie评分为0分的患者,3年无病生存率约为(49.6%±7.7%),两者的生存率之间差异具有统计学意义[3,18]。如神经母细胞瘤患者接受了干细胞移植治疗,Curie评分>0分患者的无病生存率明显低于Curie评分0分的患者[6]。而在本研究中笔者依据金标准对两种显像方法的诊断价值进行了分析,123I-MIBG平面显像和SPECT/CT断层显像的准确率分别为51.66%和93.84%,一致性Kappa值分别为0.44和0.90。断层显像具有更高的诊断准确率和极好的诊断一致性,这对患者的治疗指导和疗效监测具有重要意义。
本研究仍存在一些局限性,首先这是一个回顾性研究,一些临床因素较难控制,如纳入本研究的神经母细胞瘤的患者有的是接受了单纯的化疗,有的是单纯放疗后,而有的患者是接受了联合治疗(放疗+化疗+干细胞移植等);这可能会对结果产生一定的影响。其次,神经母细胞瘤的转移灶确定,大多数是基于影像学检查结果、临床随访等,并不是基于病理学结果。第三,本研究只是研究了单次基于123I-MIBG SPECT/CT断层显像的Curie评分与123I-MIBG平面显像Curie评分的差异,并没有对系列或多次的基于123I-MIBG SPECT/CT断层显像和123I-MIBG平面显像的Curie评分进行比较。最后,这些由显像方式不同导致的Curie评分差异,其最终的临床意义仍然需要进一步的探讨。这些不足,笔者将在未来的研究中加以改善和验证。
总之,与123I-MIBG平面显像的Curie评分相比,基于123I-MIBG SPECT/CT断层显像的Curie评分更加准确,同时与金标准具有极好的一致性,这些改变对患者下一步诊疗方案的制定、疗效监测和预后评估都有着非常重要的意义。
