高压氧促进小鼠脊髓损伤后功能恢复
2021-02-05廖小俊陈亚星文泽贤
廖小俊 李 兰 陈亚星 文泽贤
脊髓损伤包括原发性和继发性损伤,原发性损伤不可逆,治疗重点在继发性损伤[1]。高压氧治疗(hyperbaric oxygen,HBO)可减少脊髓损伤后继发性损伤[2],机制主要有减轻炎症反应、抑制神经元凋亡、减轻脊髓水肿、促进血管再生、促进轴突再生等[3]。Nrf2具有神经保护作用,是否参与HBO 治疗脊髓损伤的机制,目前尚不清楚。本研究拟采用小鼠脊髓损伤模型,分析HBO治疗对小鼠脊髓损伤后Nrf2的影响,进一步探讨HBO治疗脊髓损伤的机制。
1 材料与方法
1.1 实验动物及分组45 只成年雌性ICR 小鼠[购于北京华阜康生物科技股份有限公司,体质量(24±2)g]按随机数字表法分为3 组假手术组(A 组,n=15)、模型组(B组,n=15)、HBO组(C组,n=15)。
1.2 动物模型建立 腹腔注射4%水合氯醛(10 ml/kg)麻醉小鼠,以T11 棘突为中心,在背部正中做长约2 cm切口,依次切开皮肤、皮下组织,切开椎旁肌向两侧分离,显露T9~L1 椎体棘突及椎板。小鼠左侧第13肋骨脊柱发出部位为T12与L1交界处,以此判定T11脊椎位置。咬除T11椎体棘突及背侧椎板,血管夹从左右两侧将T11节段脊髓压迫至0.2 mm[4],持续15 s,保持脊膜完整,止血、缝合各层组织。假手术组只打开椎板,不损伤脊膜及脊髓。术后置于暖光灯下复苏,苏醒后BMS 评分0 分判断为建模成功。术后分笼饲养,每天挤压膀胱协助排尿2次。
1.3 HBO 治疗方法及管理 将HBO 组小鼠置于动物实验高压氧仓,加压10 min 使仓内压力达到0.2 Mpa,仓内氧浓度达到95%以上,稳压吸氧40 min[5],每日1次,共7 d。造模后护理:每日按压膀胱排尿2次,间隔12 h,直至小鼠排便功能基本恢复。
1.4 小鼠后肢运动功能评分 造模后1、7、28 d 采用BMS 评分法[6]评估小鼠后肢运动功能恢复情况,每组5只。将小鼠置于直径100 cm、高30 cm的塑料盆持续观察,按评分标准相应判分,0分表示后肢完全瘫痪,9分表示运动功能正常。
1.5 免疫荧光染色 造模后7 d取损伤部位脊髓组织及假手术组相应部位脊髓组织行免疫荧光染色,每组5只。以4%多聚甲醛溶液灌注固定后,分离脊髓组织,4%多聚甲醛溶液4 ℃后固定24 h,30%蔗糖溶液脱水过夜,取出脊髓组织,以损伤部位为中心,前后各留取5 mm,剪去多余脊髓,冰冻切片,厚度14 μm。将切片于50 ℃烤箱中烘烤1 h,PBS 漂洗,4%多聚甲醛浸泡,1% Triton X-100 通透细胞膜,10%正常山羊血清封闭,滴加兔抗Nrf2 多克隆抗体(1∶200,美国Abcam 公司)4℃孵育过夜,滴加Cy3 标记山羊抗兔IgG 抗体(1∶200,美国Beyotime 公司)37 ℃孵育2 h,DAPI 染色,抗荧光淬灭剂封片,激光共聚焦显微镜观察结果。
1.6 免疫印迹法检测细胞核Nrf2蛋白表达 造模7 d,取损伤部位脊髓组织及假手术组相应部位脊髓组织,每组5只。小鼠麻醉后快速取出脊髓组织,以损伤部位为中心,前后各留取5 mm,剪去多余脊髓。将脊髓标本以细胞核蛋白抽提试剂盒抽提蛋白,BCA 蛋白浓度测定试剂盒检测浓度,浓度调定一致后等体积上样,SDS-PAGE 电泳分离蛋白,湿转到PVDF膜,封闭1 h,一抗4 ℃孵育过夜(Nrf2,1∶500);二抗孵育2 h,化学发光液显影,用Image Lab 软件分析各条带相对值。
1.7 统计学方法 应用SPSS 20.0软件分析;计量资料以±s表示,行单因素方差分析;检验水准α=0.05。
2 结果
2.1 各组小鼠后肢功能评分比较 假手术组各时间点BMS 评分均为9 分,后肢运动功能无明显异常。造模后1 d,模型组和HBO 组BMS 评分均为0 分,后肢完全瘫痪。造模7 d,模型组BMS 评分仍为0 分;HBO 组MBS评分明显高于模型组(P<0.05,表1),明显低于假手术组(P<0.05,表1);提示后肢功能有所恢复。造模后28 d,模型组和HBO组BMS评分均明显提高(P<0.05,表1),HBO 组提高更明显(P<0.05,表1)。
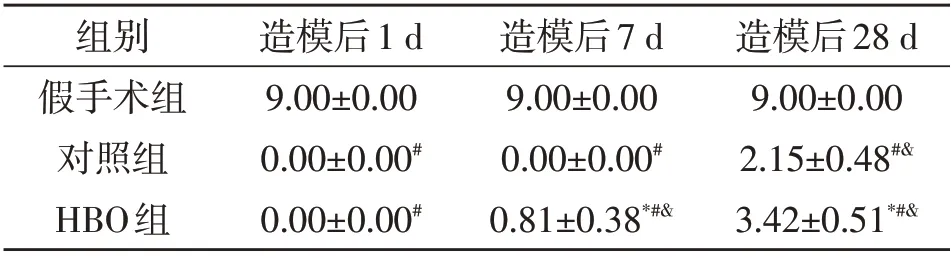
表1 各组小鼠BMS评分比较(分)
2.2 免疫荧光染色结果 免疫荧光染色显示细胞核为蓝色,Nrf2为红色。激光共聚焦显微镜观察,各组细胞核染色无差别,假手术组Nrf2染色较弱,模型组Nrf2 染色明显增强,可见脊髓损伤后Nrf2 表达增加。蓝色细胞核与红色荧光重叠表示Nrf2发生核移位,假手术组未见明显Nrf2核移位,HBO组与模型组均可见部分细胞核蓝色荧光与红色荧光重叠,存在Nrf2 核移位;而且,HBO 组红色荧光更强,发生Nrf2核移位更多,可见HBO明显促进Nrf2的表达及核移位。见图1。
2.3 细胞核Nrf2 蛋白表达变化 HBO 组及模型组Nrf2 表达量均较假手术组明显增加(P<0.05,图2),而且HBO组细胞核Nrf2表达量明显高于模型组(P<0.05,图2)。这说明脊髓损伤后Nrf2 被激活发生核移位发挥生物学功能,HBO 干预可进一步促进Nrf2核移位。
3 讨论

图1 小鼠脊髓损伤后损伤脊髓组织Nrf2免疫荧光染色情况

图2 高压氧治疗对脊髓损伤小鼠损伤脊髓组织Nrf2表达的影响
脊髓损伤后原发性损伤已不可逆转,积极干预继发性损伤是提高疗效的关键。继发性损伤的机制主要有炎症反应、氧化应激、钙超载、自由基形成等[7]。HBO 治疗减轻神经继发性损伤包含多种机制:抑制白细胞介素-1、肿瘤坏死因子-α、基质金属蛋白酶-2、基质金属蛋白酶-9、核转录因子-κB等炎症因子表达[8],减轻炎症反应;抑制Caspase-3 表达,减少脊髓神经元凋亡[9];促进血管内皮生长因子表达,发挥神经保护作用[10];促进脊髓损伤后轴突再生、损伤区域血管重建、减轻脊髓水肿[11]。
Nrf2是一种细胞保护性转录因子,生理状态下,与细胞骨架相关蛋白keap1结合,存在于细胞浆中,无活性、易降解。当细胞受到自由基、化学性物质刺激时,keap1 被磷酸化或者Nrf2 直接被磷酸化,Nrf2与keap1解离进入细胞核,与抗氧化反应元件(antioxidative response element,ARE)启动子区域结合,调控ARE 下游抗氧化酶及解毒酶表达,发挥抗肿瘤、抗炎、抗氧化、抗凋亡、清除自由基等作用[12]。另外,Nrf2具有抑制炎症反应、减轻膜性结构氧化性损伤、保护血脑屏障、减轻脑水肿等神经保护作用[13]。
本研究结果表明,小鼠脊髓损伤后HBO治疗明显促进后肢运动功能恢复。这与既往文献报道一致[14]。本文免疫荧光染色可见HBO组Nrf2核移位明显增加,免疫印迹法检测发现HBO组细胞核Nrf2蛋白含量明显增高。这与既往文献报道相符[15]。
总之,HBO 治疗显著促进小鼠脊髓损伤后神经功能恢复,机制可能与促进Nrf2表达及核移位有关。
