右位心患者经静脉植入永久心脏起搏器13例分析
2021-02-04顾敏华伟牛红霞陈旭华陈柯萍戴研樊晓寒刘志敏张澍
顾敏,华伟,牛红霞,陈旭华,陈柯萍,戴研,樊晓寒,刘志敏,张澍
右位心是罕见的先天畸形,其妊娠发生率为0.8/10 000[1]。右位心在胚胎发育过程中,心脏大部分位于右侧胸腔,心尖指向右前下方。根据内脏是否转位,右位心可分为:内脏正位右位心(又称单发右位心或者右旋心)和内脏反位右位心(又称镜面右位心)。右位心常常合并其他心脏结构畸形,增加经静脉植入起搏导线的难度。关于在右位心患者植入永久起搏器,目前国内外仅有个案报道[2-8]。本研究入选了在中国医学科学院阜外医院行经静脉永久起搏器植入的右位心患者,分析了单发右位心和镜面右位心患者合并缓慢型心律失常的区别、合并心脏畸形的种类、手术成功率、术后并发症以及术中参数和长期随访参数对比情况。
1 资料与方法
1.1 研究对象及方法
回顾分析了2008年3月到2019年2月13例在中国医学科学院阜外医院接受永久起搏器植入的右位心患者资料。基线资料收集包括病史、临床表现、心电图、X线胸片、超声心动图和CT等检查;起搏器植入资料包括起搏适应证、起搏模式、手术细节、起搏参数和导线的特征等。
1.2 术前检查准备
因大部分右位心患者合并其他心脏结构畸形,故术前所有患者均进行细致的经胸超声心动图检查,部分复杂先天性心脏病患者同时完成心脏增强CT评价上腔静脉和房室连接关系以及静脉心腔结构,为下一步选择起搏导线植入部位提供参考。
1.3 手术过程
常规局麻下,切开皮肤及皮下组织,穿刺锁骨下静脉(或者穿刺腋静脉,分离头静脉),建立静脉通路。所有患者常规在后前位下放置起搏电极,必要时结合右前斜位和左前斜位。根据术者经验和患者特征,可使用主动导线或者被动导线。心室导线先送入右心房,然后将直钢丝交换为预塑形的弯钢丝,以便顺利跨越三尖瓣。操控弯钢丝,将导线送入右心室间隔部位,或者重新交换直钢丝并缓慢回撤电极,将导线放置于右心室心尖部。心房导线常规放置在右心耳位置。对照术前超声心动图及心脏CT,在左前斜位和右前斜位下再次确认导线位置。牵拉导线,确保头端固定可靠。对于镜面右位心而言,也可以将影像切换为左右对调,在放置导线时透视下心影和正常心脏一致。必要时可使用鞘管行心腔造影,获得造影图像,指导放置电极导线。
1.4 术后起搏器程控及随访
13例患者起搏器植入术后3、6个月常规随访行起搏器测试,其后每6个月至1年的常规起搏器程控测试(或者远程监测),同时结合门诊及电话随访等方式,获得起搏参数、起搏并发症及生存资料。
1.5 统计学方法
统计学处理采用IBM(美国)SPSS 25.0软件包。计量资料以均数±标准差()表示,组内比较采用配对t检验进行分析。计数资料以百分数表示。P<0.05为差异有统计学意义。
2 结果
2.1 13例患者的基线资料(表1)
13例患者的年龄8~56(41.0±16.0)岁,其中男性3例(3/13);女性10例(10/13)。镜面右位心7例(7/13),其中病态窦房结综合征4例,房室阻滞2例,双结病变(合并房室交接处起搏或传导功能不全)1例;单发右位心患者6例(6/13),其中病态窦房结综合征2例,房室阻滞4例(图1)。9例(9/13)患者合并其他先天性心脏病,包括:5例合并矫正型大动脉转位,3例永存左上腔静脉,3例室间隔缺损,3例动脉导管未闭,1例法乐四联症,1例先天性肺动脉狭窄以及1例室间隔膜部瘤。9例患者左心功能正常,平均左心室射血分数为(62.3±5.1)%。
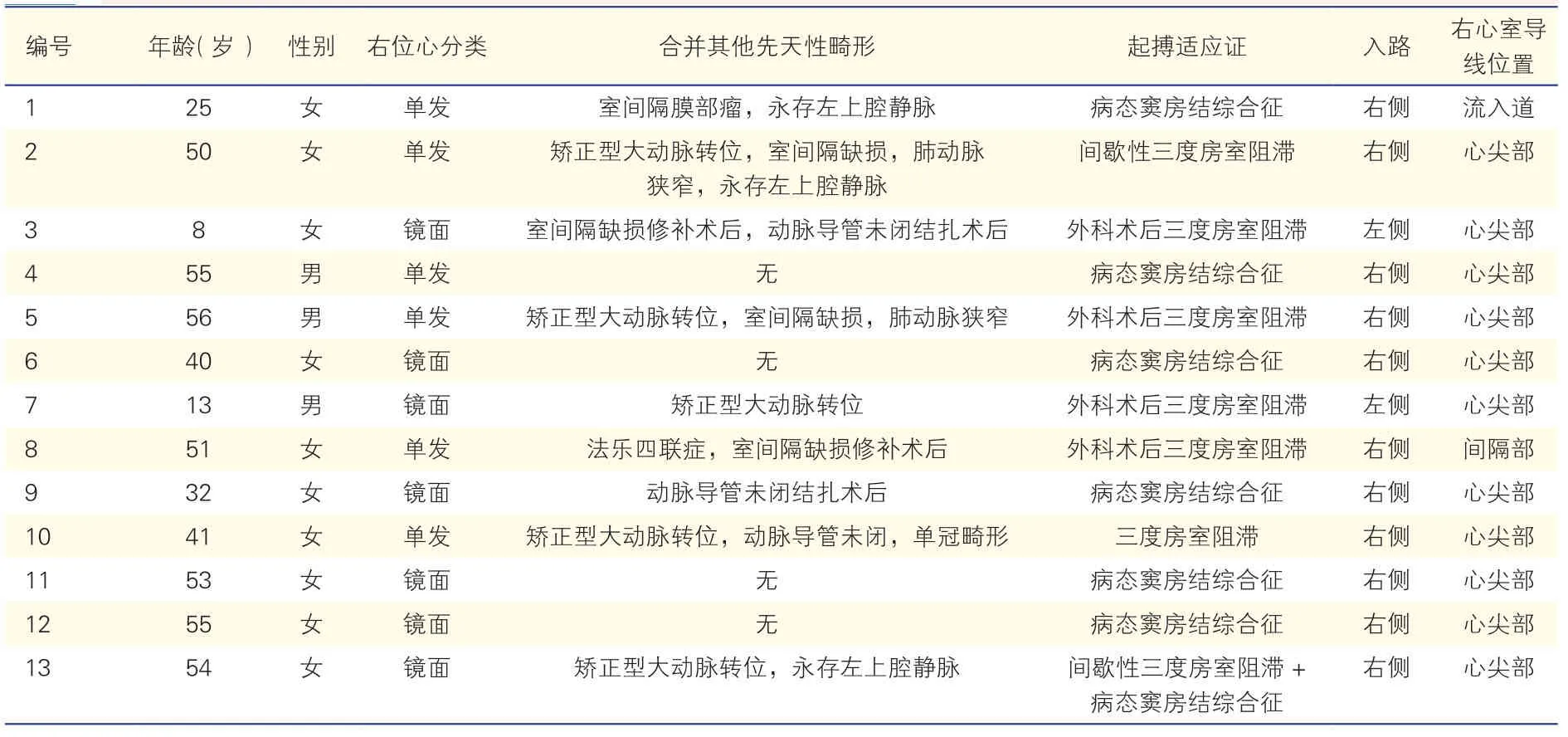
表1 13例经静脉途径植入永久起搏器的右位心患者基线资料

图1 三例镜面右位心和单发右位心患者术后X线胸片所见
2.2 患者手术及并发症情况
患者手术起搏适应证:病态窦房结综合征患者6例(6/13);房室阻滞6例(6/13),其中4例(4/6)为外科术后出现的三度房室阻滞;双结病变1例(1/13)(表1)。所有患者术前均接受详细的超声心动图检查,其中4例(4/13)患者接受术前心脏增强CT检查,评价上腔静脉和房室连接关系以及静脉心腔结构。所有患者均成功完成起搏器植入,其中11例为双腔全自动型(DDD)起搏器,2例为单腔心室抑制型(VVI)起搏器。
患者术中起搏阈值情况(表2):11例心房导线中8例采用被动导线;3例使用主动导线。术中心房起搏阈值为(0.8±0.4)V/0.4 ms,P波(3.3±1.3)mV。13例心室导线中7例采用被动导线;6例采用主动导线。11例心室导线放置于心尖部;2例分别放置于间隔和流入道;心室起搏阈值为(0.6±0.2)V/0.4 ms,R波(11.0±3.8)mV。
患者并发症发生情况:1例患者术后第2 d心房电极脱位,行电极调整术,改原心房被动电极为主动电极。其他患者未出现起搏并发症。
2.3 13例患者随访结果
患者平均随访(4.4±2.6)年(范围1~10年),所有患者均存活,且起搏器参数良好。末次随访心房起搏阈值为(0.9±0.5)V/0.4 ms,P波(3.8±1.4)mV。心室起搏阈值为(0.6±0.4)V/0.4 ms,R波(12.0±4.5)mV,较术中差异无统计学意义(表2)。随访超声心动图左心室射血分数为(58.9±6.3)%,较术前[(62.3±5.1)%]无显著变化。随访期间有2例患者完成起搏器更换。
表2 13例患者术中及末次随访的心房、心室起搏阈值变化()

表2 13例患者术中及末次随访的心房、心室起搏阈值变化()
3 讨论
右位心是一种罕见的先天畸形,其妊娠发生率为0.8/10 000[1]。右位心患者如未合并其他严重的心脏结构异常,多数可以活到成年。然而,随着年龄增长,右位心患者常常出现传导系统的退化,包括房室阻滞和窦房结功能不全。1943年,Leys等[9]报道了1例右位心合并完全性房室阻滞患者。鉴于该患者年轻,无心动过缓症状,考虑为先天性房室阻滞可能性大。此外,外科手术修复心腔内缺损或者瓣膜可损伤房室传导系统,导致房室阻滞。本研究中7例房室阻滞患者中有4例明确在外科术后出现房室阻滞,提示这类患者在进行外科手术时,须仔细操作,避免损伤传导系统。目前关于右位心患者植入起搏器的文献较少,且仅限于个案报道[2-4,10-11]。本研究报告的13例右位心患者植入起搏器是目前较大样本的研究。
因右位心常常同时合并其他心脏结构畸形,可能会给经静脉植入起搏器带来困难[6,12]。据研究报道,96%的单发右位心和 23%~70%的镜面右位心同时合并其他先天性畸形,包括复杂转位、室间隔缺损等[1,13]。本研究提示矫正型大动脉转位是右位心最常合并的先天性畸形,其次为室间隔缺损、左上腔静脉、动脉导管未闭等。1976年,Goyal等[3]首次报道了1例镜面右位心合并病态窦房结综合征患者植入起搏器的病例。因为镜面右位心是正常心脏的镜像改变。使用透视系统的水平翻转功能,可以使右位心透视图像转变为正常心脏透视图像,为导线植入提供帮助[1]。但多数情况下,如未合并其他复杂畸形,镜面右位心患者电极导线植入相对简单。
与镜面右位心不同,单发右位心非正常心脏的镜像改变。单发右位心常常合并其他心脏畸形,如矫正型大动脉转位等,故单发右位心患者植入起搏导线可能更加困难。2014年,Shenthar等[11]报道了3例单发右位心患者植入起搏器的病例。对于单发右位心而言,双侧心房以及与之连接的腔静脉、肺静脉保留正常的连接关系,而心室则转向右侧。这些畸形可能与心室倒转等心脏缺陷有关。在这种情况下,透视下植入电极导线常常存在困难。既往研究提示静脉或者心腔造影可指导右位心患者起搏电极导线植入,造影图像可作为路标指导心房和心室电极导线放置。除此以外,造影还能够显示重要的解剖信息,如:室间隔的方向、心腔的形态,是否存在静脉畸形或者狭窄等[14-15]。尽管术中造影有利于指导电极植入,但术中造影需要另外建立静脉通路,使用造影工具,操作较为复杂,同时可增加手术时间和透视时间。对于解剖结构复杂的患者,术前CT对指导起搏电极植入存在重要价值[6,16]。本研究中对大部分患者均进行详细的超声心动图检查,而对复杂病例进一步行增强心脏CT检查[17-18]。在术前对上腔静脉、右心房、右心室的连接关系和心腔形态、角度进行仔细的评价,从而对起搏导线的放置提供指导。
本研究中1例右位心患者在起搏器术后第2 d出现心房导线脱位,行电极调整时改主动导线,未再发生导线脱位[19],提示在解剖结构异常时主动导线可能有助于选择更好的起搏位置[11]。除此以外,未出现其他起搏器并发症。经过平均(4.4±2.6)年的随访,所有患者均存活,且起搏器导线参数理想,超声心动图随访显示患者未出现明显心功能减低,提示右位心患者植入起搏器后较好的安全性和有效性。
右位心是一种罕见的先天畸形。因解剖结构异常,右位心患者经静脉植入起搏器存在一定的难度。通过术前详细的超声心动图检查结合心脏增强CT评价上腔静脉和房室连接关系、静脉心腔结构和形态,有助于指导起搏导线植入。右位心患者植入起搏器术后中长期起搏参数稳定,预后良好。
利益冲突:所有作者均声明不存在利益冲突
