一株野生羊肚菌的分离鉴定及原种培养基的筛选
2021-02-04李梦玲涂俊铭
吴 金 罗 凯 夏 险 李梦玲 涂俊铭
一株野生羊肚菌的分离鉴定及原种培养基的筛选
吴 金 罗 凯 夏 险 李梦玲 涂俊铭*
(湖北师范大学生命科学学院,食用野生植物保育与利用湖北省重点实验室,特色野菜良种繁育与综合利用技术湖北省工程研究中心,湖北 黄石 435002)
对野外茅草林下采集到的一株野生羊肚菌(菌株命名为Y1)进行分离纯化,通过经典分类方法结合分子生物学方法进行品种鉴定,并基于菌丝生长速度、菌丝密度及菌核数量从9种不同培养基配方中筛选最佳原种培养基。结果为:Y1的子实体菌盖呈黄色,上有凹凸不平的网格,菌柄呈白色、中空,形似羊肚菌;在显微镜下观察,菌丝体呈黄色,菌丝粗壮,菌丝结构明显,与羊肚菌属形态特征相似;ITS序列比对显示Y1与羊肚菌属中的黄色羊肚菌类群同源性高达99%,初步鉴定该野生菌株为羊肚菌Mes-19;筛选出的最优原种培养基配方为麦粒75%、土壤23%、石灰1%、过磷酸钙1%。
羊肚菌;分离纯化;品种鉴定;ITS序列;原种培养基
羊肚菌()隶属子囊菌亚门(Ascomycotinon),盘菌纲(Discomycetes),盘菌目(Pezizales),羊肚菌科(Morchellaceat),羊肚菌属()[1]。又称羊肚菜、包谷菌,因其菌盖表面有许多不规则的凹陷和褶皱,外形似羊肚而得名[2]。羊肚菌食用和药用价值较高[3],子实体肉质鲜美脆嫩,营养丰富,富含氨基酸,含有机锗,具有抗癌作用,对肌瘤细胞有明显抑制作用[4]。
近年来,羊肚菌栽培规模发展迅速[5],本研究通过分离一株野生菌株(图1),运用经典分类鉴定方法,结合ITS序列比对分析、遗传进化分析,最终确定其分类学地位。同时,筛选最优原种培养基配方,为当地食用菌产业发展服务。

图1 野生菌株子实体
1 材料与方法
1.1 实验材料
供试野生子实体于2019年4月9日采自湖北省黄石市阳新县黄颡口镇黄颡口村一片茅草下。
培养基配方,PDA培养基(1 000 mL)为土豆200 g、蔗糖20 g、蛋白胨2 g、磷酸二氢钾3 g、硫酸镁1 g、琼脂25 g;液体培养基(1 000 mL)为土豆200 g、蔗糖20 g、蛋白胨2 g、磷酸二氢钾3 g、硫酸镁1 g。
原种培养基配方设9个,分别为:①麦粒75%、土壤23%、石灰1%、过磷酸钙1%;②全麦粒100%;③棉籽壳80%、麦麸15%、白砂糖3%、石灰2%;④棉籽壳90%、木屑8%、土2%;⑤玉米芯50%、木屑30%、米糠15%、石膏1%、过磷酸钙1%、土3%;⑥小麦80%、棉籽壳19%、石膏粉1%;⑦棉籽壳75%、木屑8%、麦麸12%、石灰1%、腐殖土4%;⑧小麦50%、麦麸5%、棉籽壳43%、石膏1%、石灰1%;⑨木屑65%、小麦20%、土壤10%、石膏1.5%、石灰1.5%、磷酸二氢钾1%、硫酸镁1%。
1.2 实验方法
1.2.1 原种培养基配制
将各配方原料搅拌混合均匀,控制含水量在65%~70%。将混合好的原料装入规格为17 cm×36 cm的聚丙烯袋中,每袋装料量为500 g。套环,盖盖,翻折袋口,置于121 ℃下灭菌38 min,冷却备用。
1.2.2 菌种分离与纯化
菌株分离时,开紫外灯,确保操作区无菌;用经75%酒精溶液浸泡的脱脂棉,对采集到的野生菌子实体进行表面消毒,再在培养皿中用无菌水清洗几次;然后用在酒精灯火焰上灭菌,并经冷却的无菌解剖刀,在菌柄和菌盖交界处切取0.3~0.5 cm2的正方形小方块,接种到PDA固体平板培养基上。用封口膜把平板密封,并写上标签,置于23 ℃下培养。3~5天后,平板培养基长出白色的绒毛状菌丝,每天肉眼观察有无污染情况,将未污染的菌丝转接到试管中保藏。
1.2.3 菌株的鉴定
(1)菌丝DNA提取。将分离得到的菌种命名为Y1,接种到PDA平板培养基中,23 ℃下静置培养7天后,挑取平板边缘的菌丝,加入800 μL CTAB(十六烷基三乙基溴化铵)提取液研磨成浆状,转移至2 mL离心管后置于65 ℃水浴40 min。再加入800 μL体积比为24︰1的氯仿︰异戊醇溶液,摇匀静置15 min后置于离心机12 000 r/min离心10 min;取上清液转移至无菌离心管,加入1 mL 95%冰冻乙醇,用手轻摇2 min;放在-20 ℃冰箱冷冻至少30 min,取出放入离心机12 000 r/min离心10 min;弃上清液,沉淀加入1 mL 70%的乙醇,静置5 min;再次12 000 r/min离心10 min,弃上清液,在洁净工作台中干燥,加入50 μL无菌水溶解,置于-20 ℃冰箱保存备用[6]。
(2)PCR扩增与产物测序。引物采用真菌核糖体基因间隔区通用引物ITS1:5’-TCCGTAGGTGAACCTGCGG-3’和ITS4:5’-TCCTCCGCTTATTGATATGC-3’[7]。PCR反应体系:10×Taq buffer 2.5 μL,dNTPs(10 mmol/L)2 μL,DNA模板约50 ng,ITS1和ITS4(100 μmol/L)各1 μL,TaqDNA聚合酶(5 U/μL)0.25 μL,ddH20补足到25 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,58 ℃ 30 s,72 ℃ 45 s,35个循环。72 ℃末端延伸5 min,4 ℃保温结束。2 uL样品添加2 uL 6×Loading Buffer,取适量样品进行检测。胶浓度为1%,电压120 V,电泳时间为20 min。最后用凝胶成像分析仪进行拍照检测,点样顺序:M,Y1;收集的DNA样品送到武汉天一辉远测序公司测序。
(3)构建系统进化树。将测序后的羊肚菌ITS序列在GenBank进行同源比对,用BLAST进行序列比对,选取相似性较高的序列,采用软件MEGA version 7.0[8]构建系统发育进化树,确定其分类学地位。
1.2.4 原种培养基的筛选
(1)原种菌丝培养。将生长良好的试管母种Y1接种到上述9个配方经灭菌的原种培养基中,控制接种量大小相等,置于22 ℃的培养室中培养,每配方3次重复,每重复5袋。
(2)菌丝生长速度测定。每天观察菌丝,记录菌核数量、菌丝开始生长时间、菌丝密度及颜色变化,测定菌丝生长长度。菌丝生长速度(cm/d)=菌丝生长长度(cm)/生长天数(d)。
2 结果与分析
2.1 野生菌株生境和形态学特征
在野外采到的大型野生羊肚菌子实体生境和形态特征如图1。其外形似羊肚;菌盖呈黄色,上有凹凸不平的网格,菌柄白色,中空;菇体长约10 cm;菌肉脆嫩,呈浅黄色。子实体生长于雨后的茅草林中,空气湿度较大,地处长江中游南岸,东北临长江,地跨东经114°31′~115°30′,北纬29°30′~30°15′,属于亚热带季风气候,四季分明,雨量充沛。
2.2 分离纯化后野生菌株的菌落形态
野生菌株分离纯化后的菌落形态如图2。菌株分离后平板培养至第5天(图2-A、B),菌丝呈白色、粗壮,菌落稠密且规则。菌株分离纯化转管后第6天(图2-C),试管底部有少量的菌核,呈浅黄色;菌丝呈黄色,粗壮,最后进行保种。将纯化后的试管种取一小块转接到液体培养基中摇瓶培养7天(图2-D),菌丝呈圆球形、浅黄色,生物量多,锥形瓶壁上有一层菌皮,菌皮呈黄白色;培养液呈黄色,液体透明。

A为培养皿菌落正面;B为培养皿菌落反面;C为纯化试管培养;D为液体摇瓶培养。
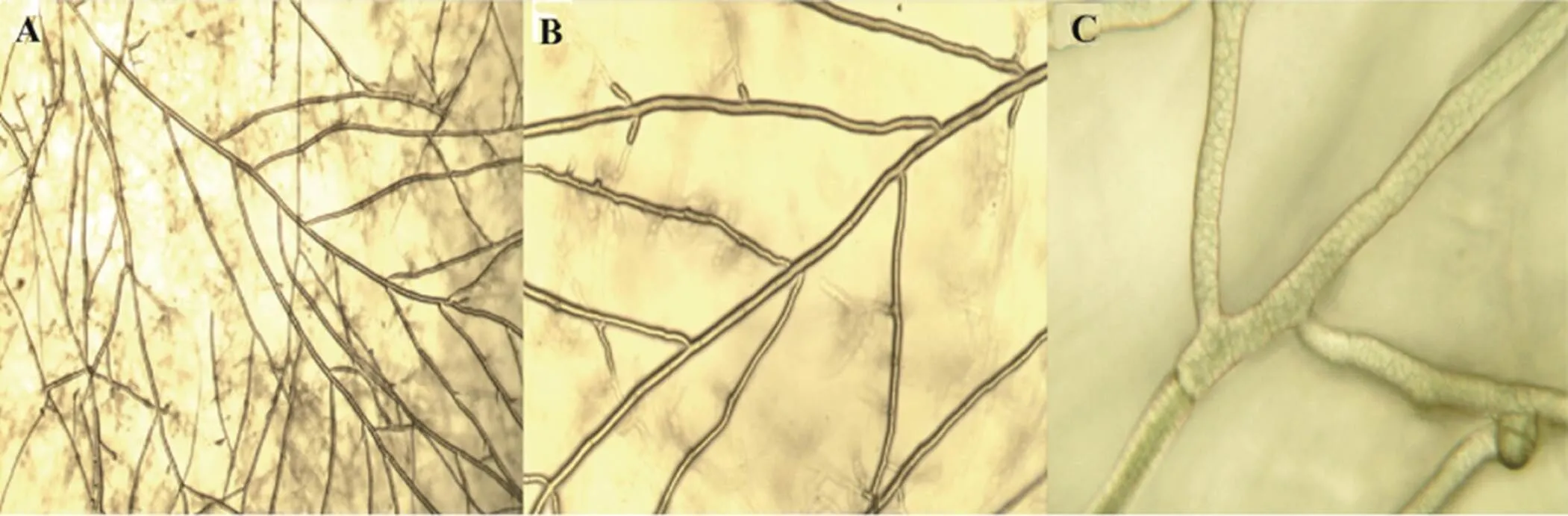
A、B、C是菌丝分离纯化后的Y1在平板上直接放在40×、100×、400×显微镜下看到的菌丝形态。
2.3 野生菌株菌丝的形态学特征
在显微镜下观察分离纯化后的Y1菌丝,可清楚看到菌丝的生长方向和整体结构(图3-A、B),菌丝发生锁状联合,菌丝直径为30~60 μm;菌丝生长结构,主要由一条主菌丝上继续行二级分叉、三级分叉长出新的菌丝,菌丝颜色呈浅黄色。主菌丝比次菌丝要粗一些(图3-C)。主菌丝细胞结构呈网状,且有像竹子一样的“结节”,“结节”之间距离不等;主菌丝长出二级菌丝后,二级菌丝继续长出三级菌丝。图3-C右下角的“突起”,似花蕾,有待验证是否是长出三级菌丝的起点。
2.4 分子鉴定结果
(1)PCR电泳结果与ITS序列分析。PCR扩增产物DNA电泳如图4。泳道1为Marker,泳道2为目标产物Y1的PCR扩增产物。目标产物Y1,DNA条带清晰、较明亮,无明显后拖尾现象,产物很充足,特异性较强,大小在750~1 000 bp。将目标产物的测序结果在NCBI上进行BLAST比对,结果为:菌株Y1与sp.19亲缘关系最接近,同缘性达99%。
(2)进化树分析。将菌株Y1的ITS序列和从GenBank中找出的一些其他具有代表性的真菌序列一并导入MEGA version 7.0系统软件,采用N-J法构建进化树分析(图5),可直观地判断出Y1与sp.19在同一分支上,亲缘关系最近。结合ITS序列分析和野生菌株形态学描述,初步鉴定野生菌株Y1为sp.19

图4 PCR电泳结果
2.5 不同原种培养基Y1菌丝的生长情况
将Y1菌种接入9个不同配方的原种培养基,结果(表2)显示,配方1、2、5、7、8的菌丝从第3天开始萌发定植,其他4个配方是第4天开始萌发。从菌核形成数量看,仅配方1和配方7在菌丝长满菌袋期间出现黄色菌核,其余配方均未发现菌核,推测配方1和配方7的营养组成更有利于菌核的形成。
从菌丝浓密度看,配方3、4、8均稠密且粗壮,生长整齐,在后期菌丝满袋后均呈黄色,表现尤佳,这3个配方的棉籽壳含量较高,推测可能是棉籽壳透气性好,利于Y1菌丝生长。配方1、5、9菌丝较稠密粗壮无杂菌,表现次之。这3个配方的主要原料是麦粒、玉米芯、木屑。配方2为全小麦,菌丝生长较稀疏,气生菌丝肉眼观察短而细,可能是由料内空隙少、透气性不足导致。
从菌丝生长速度看,配方5、6、9最佳,分别为0.971±0.023 cm/d、1.000±0.053 cm/d和0.945± 0.015 cm/d,三者间差异不显著;其后,依次为配方1、7、8、3、2;配方4菌丝生长速度显著慢于其他配方,仅为0.590±0.008 cm/d。
菌丝的生长速度、菌核的有无与很多因素有关。本实验采用9种培养基配方,营养成分、碳氮比、水分、pH和装料的松紧度不同等内部因素,以及培养环境温湿度、实验测量的误差等[9]外部因素,都会对实验结果造成一定影响。综合考虑菌种萌发生长时间、菌核数量、菌丝颜色、菌丝浓密度、菌丝生长速度各因素,确定以配方1(麦粒75%、土壤23%、石灰1%、过磷酸钙1%)作为菌株Y1的最优原种培养基。
图5 系统进化分析

表2 羊肚菌Y1菌株在不同原种培养基中的菌丝生长情况
注:同列不同小写字母表示0.05水平的差异性显著;“-”表示无菌核,“+”越多表示菌核越多。
3 结论与讨论
微生物的分离鉴定用于区分微生物的种类,是微生物学中的一个重要组成部分,是后续实验的基础。其鉴定方法主要包括经典分类鉴定方法和分子水平鉴定方法两种[10]。对于大型真菌,经典分类学方法主要是通过观察菌丝和子实体形态,结合其生活习性和生理生化特征进行。该方法易于观察和比较真菌的形态特征,虽有一定的稳定性,但也有一定的局限性。局限性在于随外界环境不同,子实体的形态和颜色会发生改变,完全根据经典分类学方法得到的结果并不是很准确。随着分子生物学的发展,可以通过真菌的分子水平鉴定方法中的ITS序列对其进行识别[11]分类。经典分类学鉴定方法结合分子生物学鉴定方法,能准确地确定真菌的种属分类关系。
本研究将两种方法结合确定了一株野生黄色羊肚菌菌株的种属关系。通过对子实体形态、分离后的菌丝形态、菌丝纯化后的转管情况、菌丝液体培养情况等的观察,显示其基本特征形态与羊肚菌属相同。通过运用分子水平鉴定方法进行DNA提取、PCR扩增,将扩增得到的产物直接进行测序,再通过BLAST系统比对,利用MAGE version 7.0系统软件绘制系统进化树,最终确定该野生菌株为黄色羊肚菌类群中的19。
本研究还通过分析比较菌株Y1在9种不同原种培养基配方中菌丝的生长速度、密度、颜色变化及菌核数量,筛选适宜的原种培养基。菌丝的生长速度并非是越快越好,生长速度与培养箱里的空气湿度、原种培养料的密度、透气透水性、配方中的碳氮比等诸多因素有关[12, 13]。而优质菌种应菌丝粗壮,菌核致密、较硬[14],综合考虑各因素,认为本实验原种养基配方以配方1(麦粒75%、土壤23%、石灰1%、过磷酸钙1%)最优。
本研究在湖北黄石地区首次分离鉴定出黄色羊肚菌19,丰富了当地的野生真菌资源,并为我国黄色羊肚菌类群的进一步开发利用提供了科学依据。
[1] Hibbett D, Binder M, Bischoff JF, el al. A higher-level phylogenetic classification of the Fungi [J]. Elsevier Ltd., 2007, 111(5): 509-547.
[2] 熊川, 李小林, 李强, 等. 羊肚菌生活史周期、人工栽培及功效研究进展[J]. 中国食用菌, 2015, 34(01): 7-12.
[3] 李卫东. 羊肚菌生物活性成分及药理作用的研究进展综述[J]. 食药用菌, 2018, 26 (03): 157-160.
[4] 葛士顺, 张海信, 李涛, 等. 谈羊肚菌对人体的生理学功效及其在运动保健中的作用[J]. 科技信息, 2011 (16): 424-427.
[5] 赵永昌, 柴红梅, 陈卫民. 理性认识羊肚菌产业发展诸多问题[J]. 食药用菌, 2018, 26 (03): 121-127.
[6] 易思华, 张媱, 孙燕飞, 等. 新疆天山山脉地区野生羊肚菌ITS分析鉴定[J]. 中国食用菌, 2019, 38(11): 47-51, 56.
[7] 沈洪, 陈明杰, 赵永昌, 等. 云南羊肚菌rDNA的ITS序列与亲缘关系分析[J]. 食用菌学报, 2007, 14(02): 15-18, 91.
[8] Kumar S, Stecher G, and Tamura K. MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology and Evolution, 2016, 33: 1870-1874.
[9] 崔艳艳. 羊肚菌菌种营养及生长环境条件研究[D]. 河北: 河北农业大学, 2018.
[10] 曾东方. 腐生与共生食用菌菌丝体分离、培养及其DNA鉴定研究[D]. 湖北: 华中农业大学, 2000.
[11] 李玉. 野生食用菌菌种分离与鉴定[D]. 福建: 福建农林大学, 2008.
[12] 索好飞. 不同培养料对白灵菇生长发育、产量及品质的影响[D]. 兰州: 甘肃农业大学, 2007.
[13] Zadrazil F. The ecology and industrial production of,,and[J]. Mushroom Science, 1974 (9): 621-652.
[14] 王震, 王春弘, 魏银初, 等. 适宜中原浅山丘陵地区的羊肚菌高产栽培技术 [J]. 食用菌, 2015, 37(04): 39-41.
Isolation and identification of a wildstrain and its spawn medium screening
Wu Jin Luo Kai Xia Xian Li Mengling Tu Junming*
(Hubei Key Laboratory of Edible Wild Plants Conservation & Utilization; Hubei Engineering Research Center of Characteristic Wild Vegetable Breeding and Comprehensive Utilization Technology; College of Life Sciences, Hubei Normal University, Huangshi, 435002, China)
A wild edible fungus strain Y1 was found under a thatched forest during field investigation. The strain was purified and identified by classical classification and molecular biology methods. At the same time, through the analysis of the mycelial growth speed, mycelial density and the number of sclerotia ofamong 9 different kinds of medium formula, the spawn medium ofwas screened. The results showed that Y1 fruiting body is yellow in cap, white and hollow in stipe which was similar toin shape. Moreover, the mycelium was yellow, the mycelium was thick, obvious mycelium structure, under the microscope, which was similar toin morphological characteristics. The ITS sequence of the strain shared 99% homology with the yellowspecies ingenus. It was identified assp.19The optimum spawn medium formulation was 75% wheat grain, 23% soil, 1% lime and 1% superphosphate.
; isolation and identification; ITS sequence; original culture medium
Q93-3,S646
B
2095-0934(2021)01-050-06
食用野生植物保育与利用湖北省重点实验室开放基金资助(EWPL201907);湖北师范大学创新团队项目(T201907)
吴金,女,在读硕士研究生,主要研究食用菌资源开发与利用。E-mail:873028748@qq.com。
涂俊铭(1972—),男,博士,教授,主要从事微生物学方面研究。E-mail:627162862@qq.com。
