基于网络药理学探讨斑蝥素致肾毒性的分子机制*
2021-02-04何天目陈启洪杨沙张建永李晓飞
何天目,陈启洪,杨沙,张建永,李晓飞,3
(1.遵义医科大学基础医学院,遵义 563000;2.遵义医科大学药学院,遵义 563000;3.遵义医科大学贵州省普通高等学校特色药物肿瘤防治重点实验室,遵义 563000)
斑蝥味辛,性温,有大毒,是我国首先发现的一种具有抗肿瘤作用的中药。入药始载于《神农本草经》,具有破血逐瘀、散结消癥、攻毒蚀疮之功[1],2015年版《中华人民共和国药典》将其归为大毒中药[2]。其中斑蝥素(cantharidin)是斑蝥中主要活性成分,对肝癌、胃癌等多种肿瘤具有较强的杀伤和抑制作用[3],且被开发成上市药物,同时围绕其开发的衍生药物效果也较好。但目前临床对斑蝥的用法用量、毒性等掌握不够,加之药物管理不严,常因多服、误服产生胃肠道反应及肝肾毒性,严重者可致肾衰竭,甚至死亡[4]。其毒性物质基础多认为是斑蝥素。有研究发现小鼠腹腔注射斑蝥素后,肾小球和肾小管出现充血,并伴有肾小球囊异常[5]。还有研究通过动物和细胞实验发现斑蝥素可引起严重肾毒性,并伴有血清肌酐、尿蛋白及尿素氮水平显著升高,且光镜下可见肾小球簇状回缩、小管混浊肿胀,电镜下可见典型的凋亡形态学改变[6]。目前斑蝥素致肾毒性机制尚不清楚,相关分子机制亟需厘清,从而破除其临床应用限制,更好地发挥抗肿瘤的作用和价值。
网络药理学最初由英国药理学家HOPKINS[7]于2007年率先提出,其基于系统生物学和多向药理学等多个学科,运用各种组学、高通量筛选、网络可视化及网络分析等技术,阐释“药物-靶点-疾病”之间复杂的网络关系,从多维度视角理解疾病的分子基础,预测药物干预后的作用机制,并通过实验验证、评估药物的有效性、作用机制及不良反应,从而发现高效、低毒的药物[8]。有研究基于网络药理学的方法预测附子毒性成分与心脏毒性的关系,发现其分子机制可能与SCN5A、GJA1及GJA5靶点有关[9]。也有研究发现,二至丸对肾脏的保护作用机制与ESR1、ESR2、GCK、MMP3等靶点及 PI3K-Akt信号通路、雌激素信号通路、嘌呤代谢过程等信号通路有关[10]。然而,目前采用网络药理学研究药物肾毒性的方法尚不完善。因此,本研究首先获取肾毒性相关靶点,构建网络,基于网络药理学的方法对斑蝥素致肾毒性的分子机制进行研究,以期为斑蝥素的深入开发及临床安全应用提供新的思路,并为网络药理学在肾毒性预测方面提供参考。
1 方法
1.1斑蝥素作用蛋白靶点预测及网络构建 通过TCMSP(http://lsp.nwu.edu.cn/tcmsp.php)、CTD(https://ctdbase.org)、Pubchem(https://pubchem.ncbi.nlm.nih.gov)等数据库检索斑蝥素的潜在作用靶点(检索式cantharidin),通过Uniprot(https://www.uniprot.org)数据库进行校正和转化,整合获取斑蝥素作用的蛋白靶点(人源)。
1.2肾毒性相关靶点网络及构建 基于“1.1”项方法,通过国内外文献检索及Digsee(https://210.107.182.71/geneSearch/)、Genecards(https://www.gene-cards.org)、CTD等数据库检索肾毒性相关的靶点(检索式nephrotoxicity),并通过Omcishare(http://www.omicshare.com/tools/Home/Soft/venn)在线分析平台对与斑蝥素作用靶点进行互作可视化。
1.3靶点-疾病互作网络 将“1.2”项得到斑蝥素与肾毒性共同靶点,作为斑蝥素肾毒性靶点,导入CTD数据库进行肾毒性相关疾病的分析。采用Cytoscape 3.7.0版软件,构建“靶点-疾病”互作网络,进一步以Network analysis插件对网络特征指标度(Degree)和介数(Betweenness)进行分析。
1.4蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络的构建 将筛选得到的斑蝥素肾毒性靶点导入STRING(https://string-db.org)获取蛋白质相互作用关系,该软件可自动对每一个蛋白质相互作用信息进行打分,分值越高表明蛋白质的相互作用置信度越高。为保证数据的可靠性,本研究选取打分值高于0.7的高置信度的数据,构建由导入靶点组成的PPI网络,并采用Cytoscape3.7.0版软件对网络进行可视化处理和分析。
1.5靶点蛋白的基因功能和通路分析 采用在线分析数据库DAVID(https://david.ncifcrf.gov)对斑蝥素肾毒性靶点进行GO基因功能分析及KEGG通路富集分析,设定阈值P<0.05,获取靶点参与的主要信号通路。并通过Cytoscape 3.7.0版软件构建“靶点-通路”网络图及Omicshare在线分析平台对富集分析结果进行可视化,解析斑蝥素肾毒性的主要信号通路,揭示其导致肾毒性的分子机制。
1.6分子对接验证 选择斑蝥素肾毒性作用的关键靶点,采用Systems Dock Web Site(http://system-sdock.unit.oist.j p/iddp/home/index)在线对接网站,将靶点与斑蝥素一一进行分子对接,以其Docking Score评价斑蝥素和靶点的结合活性。一般认为得到的Docking Score值越大,配体与受体的结合越稳定。当Docking Score>4.25,认为分子与靶点结合具有一定活性;当Docking Score>5.0,说明分子与靶点的结合具有较好活性。
2 结果
2.1斑蝥素作用的靶点网络 通过检索收集到斑蝥素的潜在作用靶点共41个,肾毒性潜在作用靶点共5619个,网络见图1所示,对斑蝥素肾毒性的潜在作用靶点进行整合,同时删除重复的作用靶点,总共得到斑蝥素的肾毒性的32个靶点,具体见表1,图2。
2.2靶点-疾病网络分析 将32个斑蝥素肾毒性靶点蛋白导入CTD 数据库中进行相关疾病的分析,查询靶点相关联的疾病,共得到354种疾病,导入Cytoscape 3.7.0版软件,构建“靶点-疾病”网络,见图3。在网络中,一个节点的度(degree)表示和节点相连的路线的条数,其度值越大,说明该节点在网络中发挥比较重要的作用。其中,排名前5的靶点分别为PTGS2(degree=105)、TP53(degree=84)、AHR(degree=52)、BCL-2(degree=51)、AKT1(degree=30),介数(betweeness)也相对较高,表明上述靶点在网络中的重要性;其中肾毒性相关的疾病有Kidney neoplasms (肾肿瘤,degree=5)、Carcinoma,renal cell(肾癌,degree=4)、Kidney diseases(肾脏疾病,degree=2)、Acute kidney injury(急性肾损伤,degree=2)、Kidney failure,chronic(慢性肾衰竭,degree=1);其他度较高的疾病有Prostatic neoplasms(前列腺肿瘤,degree=13)、Breast neoplasms (乳腺肿瘤,degree=13)、Stomach neoplasms(胃肿瘤,degree=9)、Carcinoma,hepatocellular(肝癌,degree=8)、Colorectal neoplasms(结直肠肿瘤,degree=8)等。

图1 “肾毒性-靶点”网络图
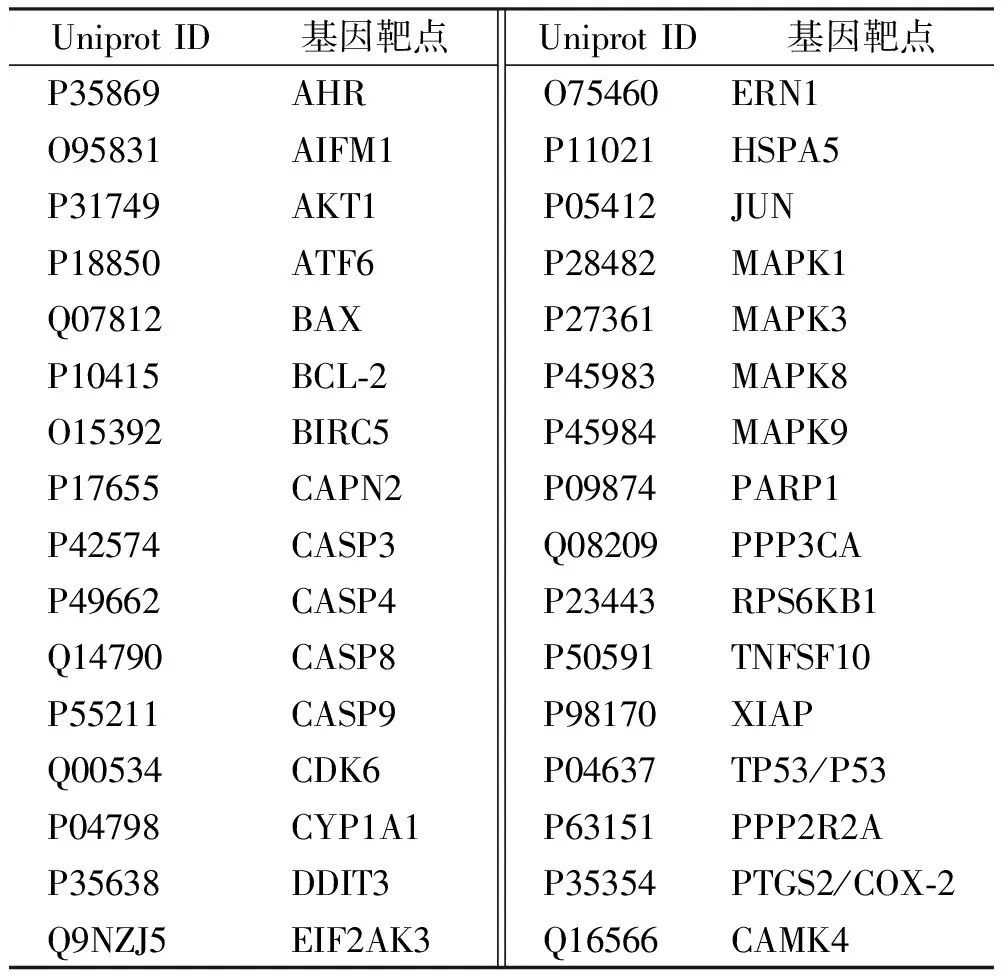
表1 斑蝥素致肾毒性的靶点信息
2.3斑蝥素肾毒性靶点PPI网络构建与分析 将斑蝥素肾毒性中32个靶点蛋白导入STRING数据库中,限定物种为人源,获取这32个靶点的相互作用关系,将置信度设置为>0.7,筛选得到31个靶点蛋白(除CAMK4,置信度<0.7),随后将结果导入Cytoscape 3.7.0软件构建PPI网络,见图4。PPI网络共包括31个节点,120条边,每一个节点表示一个靶点,颜色变化及节点大小对应其degree值大小,边表示靶点之间的关联。根据网络拓扑学性质,获得degree值排前10的关键蛋白分别为CASP3(degree=19)、TP53(degree=18)、AKT1(degree=15)、MAPK1(degree=14)、MAPK8(degree=14)、CASP8(degree=14)、MAPK3(degree=13)、CASP9(degree=13)、JUN(degree=12)、BCL-2(degree=11),表明这些靶点在PPI网络图中的中心度较高,能与多个靶点发生相互作用,提示其可能是斑蝥素致肾毒性的重要靶点。
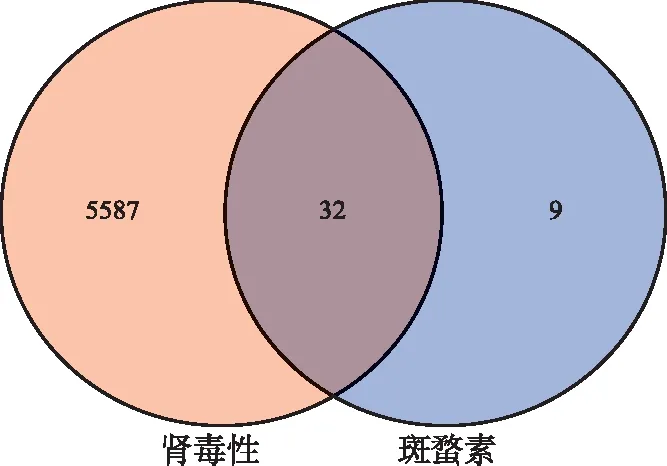
图2 斑蝥素靶点与肾毒性靶点维恩图

图3 斑蝥素致肾毒性“靶点-疾病”网络图
2.4GO生物进程分析 将斑蝥素肾毒性筛选后的31个关键靶点经cytoscape 3.7.0 ClueGO分析,得到369个生物进程,其中排名前10的生物进程,见表2。主要涉及平滑肌细胞增殖正调控、细胞对寒冷的应答、蛋白质定位对细胞核的正调控作用、花生四烯酸代谢及成纤维细胞增殖调控等方面;经Omicshare平台进行动态GO分析,见图5,6。肾毒性靶点还涉及到生物调控、信号转导、细胞对机械刺激的反应、代谢过程及免疫应答等方面。这些生物过程多与细胞凋亡、免疫炎症等发展密不可分,提示斑蝥素可能通过调控以上生物进程等引起肾毒性。

图4 蛋白质-蛋白质相互作用网络图

表2 斑蝥素致肾毒性靶点的生物进程分析结果
2.5KEGG通路富集分析 采用DAVID在线分析平台对斑蝥素肾毒性筛选后的31个关键靶点进行 KEGG 通路富集分析,将排名前30的通路导入Cytoscape 3.7.0版软件作“靶点-通路”网络图,见图7,并通过Omicshare平台对通路数据可视化,见图8,以影响因子(rich factor,RF)、P值以及调控通路上的基因个数来衡量 KEGG 的富集程度,其中RF指差异表达的基因中位于该通路条目的基因数目与所有注释基因中位于该通路条目的目的基因总数的比值,且富集的程度与RF值成正比。研究结果发现靶点主要富集于Colorectal cancer(结直肠肿瘤)、Pathway in cancer(肿瘤途径)、Apoptosis(细胞凋亡)、Hepatitis B(乙型肝炎)、TNF(肿瘤坏死因子)及MAPK(MAPK信号转导)等通路。

图5 靶点的GO生物进程层级关系

图6 前20个GO生物进程富集结果
2.6分子对接结果 为验证斑蝥素肾毒性共同预测靶点的准确性,本研究采用Systems Dock Web Site进行分子对接。首先通过Chemdraw 14.0版软件绘制斑蝥素,并保存为sdf格式,见图9,再将斑蝥素和31个关键靶点进行分子对接,根据默认参数对其中有蛋白晶体结构的11个靶点进行对接,见图10。结果发现,Docking Score<5.0有2个(18.2%),>5.0的有9个(81.8%),对接结果良好,提示其具有良好的相互作用,验证了本研究预测的可靠性,同时为进一步阐述斑蝥素致肾毒性的分子机制提供依据。
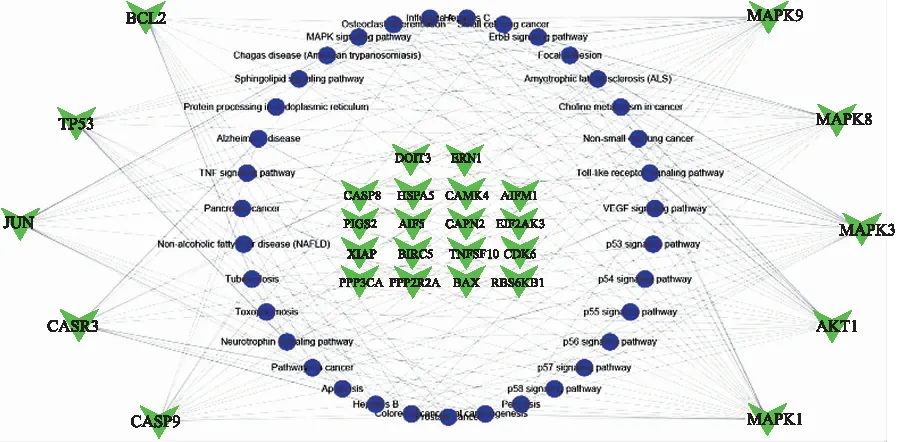
图7 “靶点-通路”网络图

图8 前20个KEGG通路富集气泡图(P≤0.05)
3 讨论
近年来,中药安全性问题一直备受关注,其中肾毒性不容忽视。目前研究发现中药引起肾毒性机制主要有诱导肾脏细胞凋亡[11]、激活肾脏免疫炎症反应[12]、引发溶血反应[13]、导致氧化损伤[14]及诱发肾缺血[15]等,但对于中药引起肾毒性的过程及深入分子机制尚不明确。斑蝥素是传统抗肿瘤中药斑蝥的主要活性成分,可抑制多种肿瘤细胞,且已投入临床使用,但因其严重的不良反应已成为限制斑蝥素广泛应用的主要因素。《中华人民共和国药典》2015年版明确规定,斑蝥的常用量为0.03~0.06 g,炮制后多入丸散用;外用适量,研末或浸酒醋,或制油膏涂敷患处,不宜大面积用[2]。此外,研究发现斑蝥素0.14 μg即可诱发皮肤起泡,10 mg就可发生严重中毒反应甚至致死[16]。其严重不良反应已引起社会的广泛关注,亟需引入新的减毒策略,但其分子机制尚不清楚。因此,本研究基于网络药理学的方法,探讨斑蝥素致肾毒性的分子机制,以期为斑蝥素的安全使用及临床应用提供参考。

图9 斑蝥素结构式
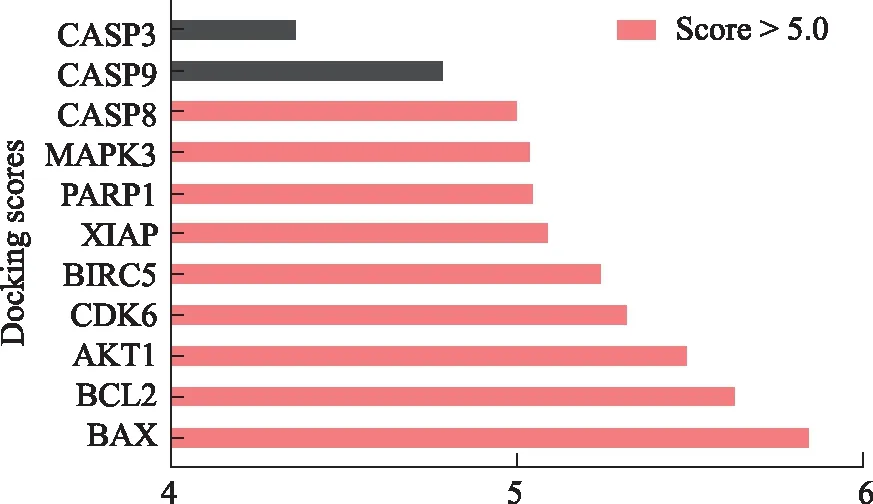
图10 斑蝥素与11个靶点的分子对接得分
本研究综合“靶点-疾病”、PPI及“靶点-通路”网络发现,斑蝥素致肾毒性共32个靶点,经置信度>0.7筛选后得到31个核心靶点,主要包括PTGS2/COX-2(前列腺素内环氧化物合成酶2)、TP53/p53(肿瘤蛋白p53)、BCL-2(B淋巴细胞瘤-2基因)、AKT1(蛋白激酶)、CASP3(Caspase-3,半胱氨酸蛋白酶-3)等靶点。其中PTGS2/COX-2主要参与炎症调节和抗氧化反应,有研究发现PTGS2/COX-2表达上调参与斑蝥素引起大鼠急性膀胱炎的过程;此外也有研究发现PTGS2/COX-2表达下调与黄芩发挥抗炎作用减轻斑蝥素毒性有关[17]。还有研究发现PTGS2/COX-2蛋白mRNA水平参与GTS-21减轻顺铂引起肾毒性的过程[18],上述研究提示斑蝥的肾毒性与PTGS2/COX-2有关,值得深入研究。TP53/p53具有调节细胞生长和增殖的作用,有研究发现p53、BCL-2、BAX蛋白水平改变参与斑蝥素抑制舌鳞状癌细胞的过程[19];还有研究发现TP53、CASP3表达上调及BCL-2水平下降可能与庆大霉素对肾脏细胞的毒性作用有关[20]。BCL-2是抑制凋亡基因,有研究发现BCL-2表达水平降低、BAX表达上调参与斑蝥素抑制人肺癌细胞的过程,但对肾脏正常细胞笔者还未见报道[21]。此外,CASP3是促凋亡基因,有研究发现CASP3、BCL-2、BAX蛋白水平在斑蝥素治疗人非小细胞肺癌中发生改变,且与自噬、细胞凋亡密切相关[22];还有研究发现CASP3、BAX表达水平降低及BCL-2表达水平上调参与小檗碱减轻甲氨蝶呤引起肾毒性的过程[23]。AKT1活化后可以调节细胞凋亡和葡萄糖代谢,但AKT1参与斑蝥素致肾毒性目前还未见报道,综上可知,上述靶点在斑蝥素肾毒性中的作用值得进一步探索。对斑蝥素的41个作用靶点分析发现,HAMP(铁调素基因)可能是斑蝥素致肾毒性的作用靶点,如有研究表明HAMP与慢性肾衰竭、肾肿瘤有关[24-25]。然而,HAMP蛋白并不在5619个肾毒性潜在靶点中,因此,该潜在靶点也有待进一步探索。综上可知,斑蝥素致肾毒性的分子机制是多靶点共同作用,可在后期实验研究中,选取合适的靶点及相关通路进行分析,更有效地揭示分子机制。
结合GO生物进程分析,斑蝥素肾毒性主要涉及平滑肌细胞增殖、花生四烯酸代谢、成纤维细胞增殖、代谢过程及免疫应答等方面。如有研究发现,血管平滑肌细胞与成纤维细胞增殖能被斑蝥素抑制和迁移[26-27],同时,平滑肌细胞caveolae参与大鼠肾动脉收缩功能调控机制,提示以上过程可能与斑蝥素引起肾毒性有关[28];此外,花生四烯酸代谢通路主要参与炎症反应和氧化应激,可能是引起肾毒性的潜在途径[29];能量代谢、氨基酸代谢及肠道微生物代谢可能与苦参碱对小鼠的肾毒性有关[30];免疫应答可能与马兜铃酸类中药激活大鼠巨噬细胞和T细胞引起肾炎样病变有关[31]。因此,斑蝥素致肾毒性分子机制可能与细胞增殖、免疫应答、能量代谢及肠道菌群微生物调节等有关。
本研究采用在线分析系统DAVID进行KEGG通路富集分析,发现网络中核心靶点主要富集在细胞凋亡、炎症反应、MAPK信号转导通路及肿瘤途径等信号通路。如有研究发现人骨肉瘤细胞凋亡与斑蝥素作用的线粒体途径有关,伴有Bax、PARP表达上调与BCL-2、p-Akt、p-Cdc2水平下降,且呈剂量依赖性[32]。还有研究发现炎症反应可能与斑蝥素抑制血管平滑肌细胞增殖有关,其炎症相关因子IL-6、TNF-α水平明显下调[33]。细胞凋亡、炎症反应也参与灯盏乙素减轻顺铂肾毒性的过程[34]。提示凋亡与炎症过程可能是斑蝥素致肾毒性的重要机制之一。还有研究发现,抑制结直肠肿瘤细胞的侵袭与转移可能与斑蝥素影响RhoA蛋白的表达有关,斑蝥素在抑制肿瘤细胞的同时也引起严重的肾损伤,且呈量毒关系[35]。此外,MAPK信号通路是核心信号转导通路,广泛参与细胞增殖分化、生长发育、代谢和免疫调节[36]。如有研究发现,MAPK通路是斑蝥素治疗乳腺癌细胞和肺癌细胞的重要途径[37-38]。同时,MAPK 信号通路也参与大叶兰酚减轻小鼠高葡萄糖诱导肾毒性的过程[39],提示其可能是斑蝥素致肾毒性的潜在通路。
综上所述,本研究基于网络药理学研究方法,通过筛选斑蝥素肾毒性共同靶点、构建“靶点-疾病”、PPI、“靶点-通路”网络,结合GO生物进程分析与KEGG通路富集分析等一系列网络分析,从系统层面揭示斑蝥素致肾毒性多靶点、多途径的分子作用机制。然而,目前斑蝥素致肾毒性分子机制的研究尚不清楚,该研究结果仍需进一步实验验证,可结合分子生物学、代谢组学等技术进行深入分子机制分析,从而为后续研究斑蝥素致肾毒性的分子机制及斑蝥素的安全评价提供思路与线索,进一步为扩大斑蝥素的临床应用提供参考。
