葛根素改善动脉粥样硬化大鼠血脂异常及炎症反应的作用机制*
2021-02-04胡彦武杨温欣包小雪于帅武子敬李瑞丽
胡彦武,杨温欣,包小雪,于帅,武子敬,李瑞丽
(1.通化师范学院医药学院,通化 134002;2.长春中医药大学研究生院,长春 130117)
动脉粥样硬化(atherosclerosis,AS)是一种以动脉血管壁炎症改变为主的慢性进行性疾病,炎症反应出现在AS形成的各个阶段[1]。该病的发病机制尚未完全清楚,有学者认为血脂代谢异常可引发炎症反应,进而刺激内皮细胞分泌炎性因子,诱导单核细胞黏附、迁移至动脉管壁内膜形成AS斑块[2]。因此,控制炎症反应已成为治疗AS的新思路。
葛根素是从中药葛根中提取一种异黄酮类化合物,化学名为4,7-二羟基-8-β-D-吡喃葡萄糖醛基异黄酮,分子式为C21H20O9,相对分子质量416.37。近年来,对葛根素的研究一直都比较活跃,发现葛根素具有明显的心血管保护活性。研究显示,葛根素可显著降低ApoE-/-小鼠[3]、家兔AS模型粥样斑块炎症因子[4]的表达,并可通过调控NF-κB信号通路改善实验动物血脂异常、抑制AS时血管壁慢性炎症反应,但是否调控与NF-κB信号通路级联的丝裂原活化激酶(mitogen-activated kinase,MAPK)信号通路及深入机制,笔者尚未见报道。本研究旨在探讨葛根素对AS大鼠血脂代谢及血清肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-6、IL-1β等炎性因子水平的影响,并通过检测MAPK信号通路相关信号蛋白磷酸化情况,进而明确葛根素抗AS的作用及可能机制,为其临床应用提供实验依据。
1 材料与方法
1.1实验动物 无特定病原体(SPF)级Wistar雄性大鼠,体质量180~200 g,吉林大学实验动物中心,实验动物生产许可证号:SCXK(吉)2007-0003。适应性喂养7 d,饲养温度(20±2)℃,相对湿度(50±10)%,实验前动物禁食12 h,自由饮水。
1.2药品与试剂 葛根素(四川维克奇生物技术有限公司,批号:181112,含量:98.0%),辛伐他汀片(杭州默沙东制药有限公司,批号:M018303),胆固醇(百奥生物科技有限公司,批号:180621),胆酸钠(美国Gibco公司,批号:8118241),丙基硫氧嘧啶(上海朝晖药业有限公司,批号:180617),维生素D3注射液(VD3,上海通用药业股份有限公司,批号:180905),高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、三酰甘油(TG)、总胆固醇(TC)试剂盒(南京建成生物工程研究所,批号分别为20180805,20180812,20180823,20180901);TNF-α、IL-6、IL-1β 酶联免疫吸附测定(ELISA)检测试剂盒(上海远慕生物科技有限公司提供,批号分别为180712,180705,180714),细胞外信号调节激酶(extracellular signal regulated kinase,ERK)1/2、p38、c-Jun氨基端激酶(c-Jun Nterminal kinase,JNK)、p-ERK1/2、p-p38、p-JNK抗体(北京中杉金桥生物技术有限公司,批号分别为ZB-0426,ZB-0527,ZB-0621,ZB-0601,ZB-0514,ZB-0512),BCA蛋白测定试剂盒(美国Thermo公司,批号:ZM02N0016),电致化学发光(ECL)发光液和硝酸纤维素膜(美国Millipoer公司)。
1.3仪器与设备 倒置显微镜(日本Olympus公司),URIT-660酶标仪(桂林优利特集团有限公司),超低温冰箱(美国Thermo公司),H1650台式低温离心机(湖南湘仪离心机仪器有限公司),FA1004电子天平(上海精科天平仪器厂,感量:0.1 mg)。
1.4动物造模 采用高脂饲料诱导建立大鼠AS模型[5]。将60只大鼠按随机数字表法分为2组,分别为正常对照组15只和AS模型组45只。两组大鼠均自由饮水,正常对照组大鼠给予普通饲料,模型组大鼠给予高脂饲料(基础饲料80.8%+猪油10%+白糖5%+胆固醇3.5%+胆酸钠0.5%+丙基硫氧嘧啶0.2%),并于造模开始时,模型组各鼠腹腔注射VD370 U·kg-1,每天1次,连续3 d。造模9周后,从两组大鼠中各随机选出5只,禁食(不禁水)12 h后,10%水合氯醛0.35 mL·(100 g)-1麻醉,腹主动脉取血后,剪取胸主动脉,进行TG、TC、LDL-C、HDL-C等血脂成分检测及病理学检查,以判断造模是否成功。
1.5动物分组及给药 AS模型复制成功后,将模型组剩余40只大鼠按随机数字表法分为4组,即模型对照组、辛伐他汀组(4 mg·kg-1·d-1)、葛根素大剂量组(60 mg·kg-1·d-1)、葛根素小剂量组(30 mg·kg-1·d-1)[5],每组10只。辛伐他汀组和葛根素大、小剂量组分别灌胃给药,模型对照组和正常对照组剩余10只大鼠灌胃等量0.9%氯化钠溶液,每天1次,连续给药4周。
1.6标本取材与制备 各组大鼠用10%水合氯醛0.35 mL·(100 g)-1麻醉,腹主动脉取血,分离血清,-80 ℃冰箱保存,用于检测TG、TC、LDL-C、HDL-C及TNF-α、IL-6、IL-1β等指标;分离整根主动脉,剪取主动脉弓段血管组织,切取薄片厚度2~3 mm,4%多聚甲醛固定24 h,梯度乙醇脱水、石蜡包埋、制成切片厚度4 μm,用于苏木精-伊红(HE)染色,另一部主动脉组织剥离外部脂肪组织,液氮保存,用于检测ERK1/2、p38、JNK及其磷酸化蛋白表达情况。
1.7观测指标
1.7.1检测大鼠血脂水平 采用COD-PAP酶法测定各组大鼠血清TC水平,GPO-PAP酶法测定TG水平,采用直接法测定LDL-C、HDL-C水平。
1.7.2检测大鼠血清炎性因子水平 采用ELISA法检测各组大鼠血清炎性因子TNF-α、IL-6、IL-1β水平。严格按照ELISA试剂盒说明书进行操作,用酶标仪在波长490 nm处测定各样品吸光度值,计算血清中TNF-α、IL-6、IL-1β水平。
1.7.3检测大鼠胸主动脉组织MAPK信号通路蛋白磷酸化情况 采用Western blotting法检测各组大鼠胸主动脉组织中ERK1/2、p38、JNK及其磷酸化蛋白表达情况,具体方法如下:液氮中研磨胸主动脉组织,加入组织裂解液裂解,BCA法进行蛋白定量,加5×上样缓冲液煮沸10 min,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE),电泳结束后经聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜转膜,5%脱脂奶粉封闭过夜,ERK1/2、p38、JNK、p-ERK1/2、p-p38及p-JNK一抗(1:1000)稀释液,室温孵育2 h,继以辣根酶标记的二抗(1:5000)稀释液室温孵育1 h,按照ECL试剂盒说明书进行操作,将发光液均匀地滴在PVDF膜上,反应1 min,最后将膜放入暗室压片成像。结果用目的蛋白的灰度值与非磷酸化蛋白的灰度值的比值表示,用Quantity One 软件对显影条带进行分析。
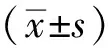
2 结果
2.1大鼠胸主动脉组织病理变化 正常对照组胸主动脉组织内膜、中膜、外膜分界明显,内皮细胞结构完整且排列有序,中膜可见梭形平滑肌细胞,弹力纤维层结构完整无破裂,外膜为疏松结缔组织;模型对照组内膜增厚不光滑、内皮细胞脱落结构不完整,中膜内可见炎性细胞浸润、泡沫样细胞,弹力纤维变性、断裂和崩解,偶见散在钙化灶;辛伐他汀组,葛根素大、小剂量组内膜增厚程度较轻,内皮细胞较为完整,中膜内炎细胞浸润少见、泡沫样细胞少见(图1)。
2.2大鼠血脂水平变化 见表1。与正常对照组比较,模型对照组大鼠TC、TG、LDL-C等均显著升高(均P<0.05),HDL-C水平显著降低(P<0.05),与模型对照组比较,辛伐他汀组及葛根素大、小剂量组TC、TG、LDL-C水平均显著降低(P<0.05),HDL-C水平均显著提升(P<0.05),但均未达到正常水平;与辛伐他汀组比较,葛根素大、小剂量组TC、TG、LDL-C、HDL-C水平差异均无统计学意义(P>0.05),且葛根素大、小剂量组间上述指标水平差异亦无统计学意义(P>0.05)。
2.3大鼠血清TNF-α、IL-6和 IL-1β水平变化 见表2。与正常对照组比较,模型对照组大鼠血清TNF-α、IL-6和IL-1β水平均显著升高(P<0.05);与模型对照组比较,辛伐他汀组,葛根素大、小剂量组TNF-α、IL-6和 IL-1β水平均显著降低(P<0.05);与辛伐他汀组比较,葛根素大、小剂量组TNF-α、IL-6和IL-1β水平差异均无统计学意义(P>0.05),且葛根素大、小剂量组间上述指标水平亦差异无统计学意义(P>0.05)。
2.4大鼠胸主动脉组织MAPKs磷酸化情况 Western blotting实验结果显示,各组大鼠胸主动脉组织ERK1/2、p38及JNK 3种蛋白表达情况均较为相似,组间比较差异无统计学意义(P>0.05),但其相应磷酸化蛋白p-ERK1/2、p-p38及p-JNK在各组间的表达均差异较大。与正常对照组比较,模型对照组p-ERK1/2、p-p38及p-JNK蛋白表达水平显著升高;与模型对照组比较,辛伐他汀组和葛根素大、小剂量组p-ERK1/2、p-p38、p-JNK蛋白表达水平均显著降低,差异有统计学意义(P<0.05);辛伐他汀组与葛根素大、小剂量组差异无统计学意义(P>0.05),且葛根素大、小剂量组间上述指标水平亦差异无统计学意义(P>0.05)。见图2。
3 讨论
AS是导致冠心病、心肌梗死、缺血性脑卒中等心脑血管疾病的主要病理基础,严重威胁人类健康,是引起全世界死亡率高的主要原因[6]。众多研究认为[7-8],AS的形成与脂质代谢紊乱密切相关,高脂血症是AS发病的重要危险因素。高脂血症可致内皮细胞损伤,进而促进沉积于内膜下LDL-C被氧化修饰成ox-LDL,巨噬细胞吞噬ox-LDL形成泡沫细胞,并伴随血管炎症、平滑肌细胞增殖、血管钙化及斑块形成[9]。为了更好地应用于临床,本研究采用腹腔注射VD3联合高脂饲料诱导大鼠AS模型,结果显示,模型对照组大鼠血清TC、TG、LDL-C、HDL-C等血脂指标水平显著异于正常对照组;HE染色结果显示,模型对照组大鼠胸主动脉内膜增厚、内皮细胞受损,中膜内炎性细胞浸润、泡沫样细胞多见,弹力纤维变性、断裂和崩解,偶见散在钙化灶。以上结果与文献[10-11]报道一致,表明大鼠AS模型复制成功。

A.正常对照组;B.模型对照组;C.辛伐他汀组;D.葛根素小剂量组;E.葛根素大剂量组。
表1 5组大鼠血清血脂水平比较
Tab.1 Comparison of serum lipid levels among five groups of rats

表1 5组大鼠血清血脂水平比较
组别TCTG正常对照组1.55±0.080.96±0.09模型对照组6.52±0.44①5.23±0.11①辛伐他汀组4.24±0.13②4.33±0.20②葛根素 小剂量组4.30±0.15②4.33±0.15② 大剂量组4.27±0.12②4.31±0.16②组别LDL-CHDL-C正常对照组0.74±0.120.65±0.06模型对照组4.34±0.26①0.32±0.04①辛伐他汀组3.15±0.15②0.45±0.05②葛根素 小剂量组3.20±0.23②0.42±0.04② 大剂量组3.19±0.22②0.43±0.04②
①与正常对照组比较,t=7.022~9.365,P<0.05;②与模型对照组比较,t=7.694~11.215,P<0.05。
①Compared with normal control group,t=7.022-9.365,P<0.05;②compared with model control group,t=7.694-11.215,P<0.05.
他汀类药物是目前广泛应用于临床及动物实验的基础降脂药,其可降低TC、TG、LDL-C水平、升高HDL-C水平,并可改善血管内皮功能,减轻炎症反应,降低粥样斑块内胆固醇及ox-LDL水平、减轻血栓形成等[5,12]。辛伐他汀是他汀类药物中经典药物,故本研究以其作为阳性对照药,观察葛根素对AS大鼠血脂代谢的影响。本研究结果显示,辛伐他汀、葛根素均可显著降低AS大鼠血清TC、TG、LDL-C水平,显著提升血清HDL-C水平,且葛根素调节血脂作用与辛伐他汀显著不明显。
表2 5组大鼠血清TNF-α、IL-6和IL-1β水平比较
Tab.2 Comparison of the serum levels of TNF-α,IL-6 and IL-1β among five groups of rats
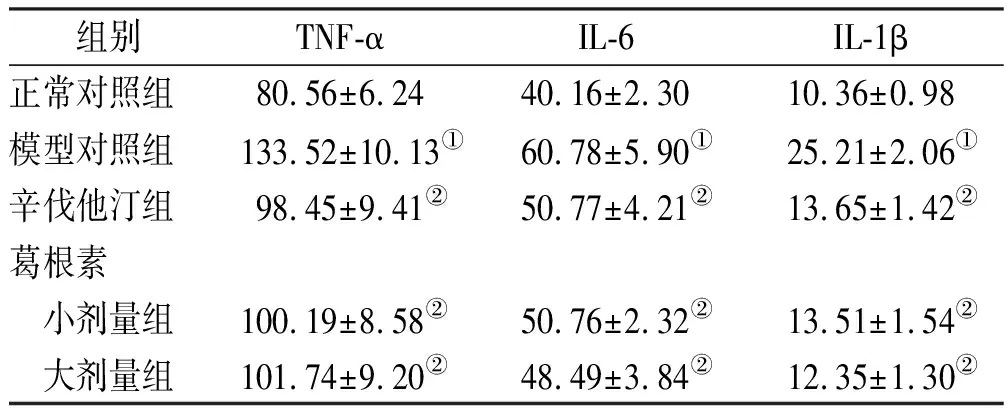
表2 5组大鼠血清TNF-α、IL-6和IL-1β水平比较
组别TNF-αIL-6 IL-1β正常对照组80.56±6.2440.16±2.3010.36±0.98模型对照组133.52±10.13①60.78±5.90①25.21±2.06①辛伐他汀组98.45±9.41②50.77±4.21②13.65±1.42②葛根素 小剂量组100.19±8.58②50.76±2.32②13.51±1.54② 大剂量组101.74±9.20②48.49±3.84②12.35±1.30②
①与正常对照组比较,t=7.502~11.381,P<0.05;②与模型对照组比较,t=6.308~13.213,P<0.05。
①compared with normal control group,t=7.502-11.381,P<0.05;②compared with model control group,t=6.308-13.213,P<0.05.
越来越多的研究表明[13],炎症参与AS的发生与发展,炎性因子和免疫细胞参与了AS的病理生理过程。AS斑块处的T淋巴细胞和单核巨噬细胞可过度分泌IL-6、TNF-α及IL-1β等炎性细胞因子,作为炎症和免疫反应的重要递质,上述炎性细胞因子可增强炎症反应、损伤血管内皮细胞,诱导内皮细胞黏附分子表达和释放,增加内皮细胞通透性[5,14],并可促进平滑肌细胞增殖、迁移及血栓形成,最终导致AS形成和斑块不稳定[15-16]。本研究结果发现,AS模型大鼠血清TNF-α、IL-6和IL-1β水平均显著升高,使用葛根素干预处理后,各组大鼠血清TNF-α、IL-6和IL-1β水平均显著降低。
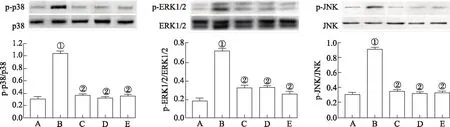
A.正常对照组;B.模型对照组;C.辛伐他汀组;D.葛根素小剂量组;E.葛根素大剂量组;①与正常对照组比较,t=8.011~13.214,P<0.05;②与模型对照组比较,t=7.562~12.383,P<0.05。
MAPKs是哺乳动物细胞内广泛存在的一类丝氨酸/苏氨酸蛋白激酶,分为ERK、JNK和p38 MAPK三类,是将细胞外信号转导到细胞内引起细胞生物学反应(如细胞增殖、分化、转化及凋亡等)所需的一类重要信号系统,在多种心血管系统疾病的发展过程中发挥重要的调控作用[16]。MAPK信号通路在未受刺激时,处于静止状态,受到炎性刺激时,p38、ERK1/2和JNK可经上下游激酶刺激,发生级联磷酸化而激活,参与细胞的增殖、分化、转化及凋亡等细胞过程的调控[17-18]。因此,检测组织细胞p-p38、p-ERK1/2、p-JNK蛋白表达水平,可反映MAPK信号通路激活情况。本研究采用Western blotting法检测大鼠胸主动脉中p38、ERK1/2和JNK等蛋白磷酸化情况,结果显示,AS大鼠胸主动脉组织p-ERK1/2、p-p38、p-JNK蛋白表达均显著增加,表明AS病理进程中涉及到MAPK信号通路的激活;而葛根素可显著抑制MAPK信号通路中上述相关蛋白磷酸化,且其效果与辛伐他汀相似。提示葛根素抗AS作用机制可能与抑制MAPK信号通路激活有关。
综上所述,大鼠AS病理状态下,血脂代谢异常,血清TNF-α、IL-6等炎性因子水平升高。葛根素可有效调节TC、TG、LDL-C、HDL-C等异常变化的血脂指标水平,降低AS大鼠血清TNF-α、IL-6及IL-1β水平,并可抑制AS大鼠胸主动脉组织MAPK信号通路中上述相关蛋白磷酸化,抑制p-ERK1/2、p-p38、p-JNK蛋白表达。以上结果说明,葛根素能够通过调节血脂、降低血清TNF-α、IL-6及IL-1β水平来发挥抗AS作用,而机制可能与抑制MAPK信号通路激活有关。而上述作用机制可能仅仅是一方面,有关葛根素对AS大鼠治疗作用的深入机制尚需进一步研究。
