英夫利西单抗对炎症性肠病患者肠道菌群分布及血清IL-6、IL-17、TNF-α水平的影响
2021-02-03常书振耿献辉王智峰冯海龙
常书振,耿献辉,王智峰,冯海龙
郑州市解放军联勤保障部队第九八八医院消化内科,河南 郑州 450042
炎症性肠病(inflammatory bowel disease,IBD)是一组病因未明的自身免疫性疾病,其发生发展与机体免疫功能紊乱有密切关联[1-2]。IBD为自身免疫性疾病,在肠道菌群失衡、免疫失调后,抗原经受损黏膜进入组织与血液激发肠道炎症免疫状态,损伤性免疫因子大量释放,引发持续性炎症反应,有研究[3]发现,IBD患者存在益生菌含量减少,有害菌含量增加现象,可能与促炎因子白介素-6(IL-6)、白介素-17(IL-17)、肿瘤坏死因子-α(TNF-α)过表达有关,因此,改善IBD患者肠道菌群及炎症因子水平是治疗关键。目前内科主要采用美沙拉嗪、激素、免疫抑制剂、生物制剂对其进行治疗,近年来对IBD的治疗倾向于“降阶梯”策略,即对部分被评为高复发与疾病活动风险的患者优先考虑采用生物制剂治疗[4-5]。英夫利西单抗为鼠-人嵌合体TNF的单克隆IgG1抗体生物制剂[6],为IBD的治疗提供了新策略。本文主要分析IBD患者采用英夫利西单抗的疗效及对其肠道菌群分布和血清IL-6、IL-17、TNF-α水平等的影响,现将结果报道如下。
1 资料与方法
1.1 一般资料选取2018年2月至2020年2月我院收治的IBD患者120例。纳入标准:(1)均符合IBD诊断标准[7],其中诊断为溃疡性结肠炎62例,克罗恩病58例;(2)入院时病情处于活动期,Harvey-Bradshaw指数(HBI)评分≥7分,病情中-重度无需急救措施;(3)患者均对本研究内容知情,且签署知情同意书。排除标准:(1)近2周内有感染史;(2)近1周内使用过胃肠动力药、抗生素、微生态制剂及其他可能影响肠道菌群的制剂者;(3)肠结核、寄生虫感染等引起的感染性结肠炎;(4)合并严重肠梗阻、穿孔、结直肠癌等并发症或有严重的原发性疾病史。采用随机数字表法将其分为观察组、对照组各60例,两组一般资料比较,差异无统计学意义(P>0.05,见表1),具有可比性。
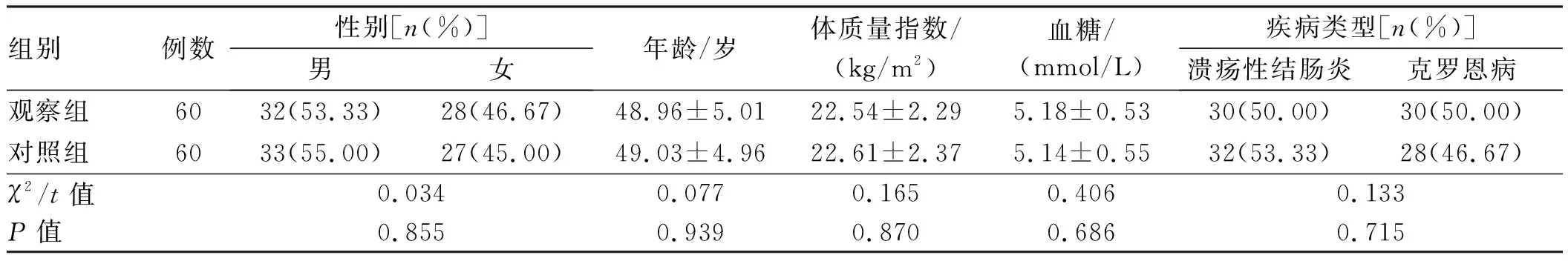
表1 两组一般资料比较Tab 1 Comparison of general data between the two groups
1.2 方法对照组予以常规治疗,包括卧床休息、抗感染,维持电解质平衡,营养支持(补充钾、蛋白质)等,并口服柳氮磺吡啶片(国药准字H31020450,上海中西三维药业有限公司,规格:0.5 g×6片)2片/次,4次/d,4周为1个疗程,连续治疗3个疗程(12周)。观察组在对照组基础上予以注射用英夫利西单抗(商品名:类克,注册证号S20120012,瑞士Janssen BiologicsB.V.公司,规格:100 mg/支) 治疗,5 mg/kg,溶于250 ml 0.9%氯化钠注射液中静脉滴注,于治疗开始第1周、2周、6周进行诱导治疗,1次/d,每次注射时间>2 h,诱导期治疗后8周,以相同剂量及时间行维持期(巩固期)治疗4周,治疗期间谨遵医嘱,用药剂量依据患者症状缓解、耐受程度酌情进行调整,禁酒、禁烟,忌食辛辣食物、牛奶、海鲜等。
1.3 观察指标(1)比较两组临床疗效,显效:临床症状基本消失,瘘道渗液量减少至少50%或瘘道闭合,血沉、血红蛋白指标复常,HBI评分下降80%~100%;有效:临床症状有所改善,瘘道渗液量减少25%~50%,血沉、血红蛋白指标正常,HBI评分下降50%~79%;无效:临床症状无改善甚至恶化,且出现严重并发症,HBI评分下降<50%。有效率=(显效+有效)/总例数×100%;(2)采用HBI评分分析两组治疗前、治疗4周、8周、12周疾病活动度,HBI评分包括全身情况、有无腹痛、稀便次数、有无腹部肿块、有无关节肠外并发症5项,凡计分在3~7分为病变缓解,≥7分为病变活动;(3)取两组治疗前、治疗结束后3 d新鲜粪便5~15 g,按10倍系列稀释法稀释后,置于肠道菌群琼脂培养基进行培养,采用半自动微生物鉴定系统(法国梅里埃公司)进行细菌鉴定,结果取菌落培养对数值lgN,单位为CFU/g,观察菌群(肠球菌、大肠埃希菌、乳杆菌、双歧杆菌、酵母菌、消化球菌)数量变化;(4)取两组治疗前、治疗结束后3 d空腹静脉血3 ml,4 ℃、3 000 r/min离心15 min,取上层血清,采用酶联免疫吸附试验测定血清IL-6、IL-17、TNF-α水平;(5)记录两组不良反应发生情况,包括头痛头晕、皮肤瘙痒、白细胞减少症、呼吸道感染等。
2 结果
2.1 两组临床疗效比较观察组治疗有效率(90.00%)高于对照组(75.00%),差异有统计学意义(P<0.05,见表2)。
2.2 两组HBI评分比较治疗后两组HBI评分均下降,且观察组治疗4周、8周、12周HBI评分低于对照组,差异有统计学意义(P<0.05,见表3)。

表2 两组临床疗效比较 [例数(%)]Tab 2 Comparison of curative effect between the two groups [n(%)]

表3 两组HBI评分比较分)Tab 3 Comparison of HBI scores between the two groups score)
2.3 两组肠道菌群变化比较观察组治疗后肠球菌、大肠埃希菌数量低于对照组,而乳杆菌、双歧杆菌数量较对照组高(P<0.05),两组酵母菌、消化球菌数量比较,差异无统计学意义(P>0.05,见表4)。
2.4 两组血清炎症因子水平比较两组治疗后血清IL-6、IL-17、TNF-α水平均低于治疗前,差异有统计学意义(P<0.05)。观察组治疗后血清IL-6、IL-17、TNF-α水平均低于对照组,差异有统计学意义(P<0.05,见表5)。

表4 两组肠道菌群变化比较Tab 4 Comparison of gut microbiota between the two groups lgN/g)

表5 两组血清炎症因子水平比较Tab 5 Comparison of serum levels of inflammatory factor between the two groups
2.5 两组不良反应发生率比较观察组治疗期间,头痛3例,头晕2例,皮肤瘙痒、白细胞减少症、呼吸道感染各1例,不良反应发生率为13.33%;对照组头痛2例,头晕1例,皮肤瘙痒2例,不良反应发生率为8.33%,两组比较,差异无统计学意义(χ2=0.776,P>0.05)。均予以对症治疗后复常,未发现英夫利西单抗输液反应,脱髓鞘病变及神经毒性,心肝肾功能损伤等不良反应。
3 讨论
IBD为一种病因不明确的慢性非特异性肠道炎症性疾病,包括溃疡性结肠炎、克罗恩病,均可引起腹痛、腹泻、血便、贫血等临床表现[8]。最新研究[9-10]表明,IBD发病与免疫、肠道菌群结构改变有密切关系。IL-6可激活转录因子,诱导抗凋亡因子生成,并促进纤维蛋白原启动凝血因子,在肠道黏膜中异常堆积,使炎症反应加重,IL-17为由CD4+T细胞分泌的白细胞介素,可诱导上皮细胞、内皮细胞、成纤维细胞合成分泌IL-6等细胞因子,TNF-α在受损的肠黏膜中大量表达,可反映病变范围及程度[11]。冯媛等[12]发现,在溃疡性结肠炎患者中,其炎性细胞因子(IL-1、IL-6、TNF-α)含量升高,且肠道菌群变化也是其发病的重要机制,因而改善IBD患者炎性因子水平是治疗重点。英夫利西单抗为一种杂交嵌合IgG1单克隆抗体,可特异性结合TNF-α而抑制TNF-α引发的免疫及炎性反应,该药在促进IBD患者黏膜愈合,改善其预后方面有一定价值[13]。
本研究显示,观察组在常规治疗基础上予以英夫利西单抗治疗12周后,其治疗有效率达90.00%,明显高于对照组的75.00%,表明英夫利西单抗治疗IBD有较好疗效,英夫利西单抗可快速有效中和TNF-α并与吞噬细胞及T细胞表面表达的TNF-α高亲和力结合,经抗体依赖性细胞介导的细胞毒作用及补体依赖性细胞毒作用机制发挥药理作用,可有效促进患者免疫功能恢复,缩短症状改善所需时间,减少疾病活动度[14],这也是本研究观察组治疗4周、8周、12周HBI评分低于对照组的原因。
正常人体含大量细胞,且种类与数量繁多,主要集中于结肠与小肠末端,肠道菌群按一定比例组合,各菌群间相互依存、互相制约,在数量与质量上形成一个总体生态平衡,当机体免疫功能下降,发生炎症反应时,肠道菌群发生改变[15]。本研究显示,观察组治疗后肠球菌、大肠埃希菌数量低于对照组,而乳杆菌、双歧杆菌数量较对照组高,与陈香等[16]报道的英夫利西单抗治疗IBD患者后,其肠道菌群结构明显改善的结果一致,表明英夫利西单抗治疗IBD可有效促进其肠道菌群恢复平衡。英夫利西单抗可诱导T细胞凋亡,降低黏膜组织Th17细胞浸润,抑制免疫反应与炎症过程,改善患者肠道菌群构成,促进其恢复平衡。夏冰清等[17]的Meta分析结果也表明,英夫利西单抗对IBD患者黏膜愈合有较好的促进作用。
TNF-α为炎症启动因子,在炎症发生发展过程中必不可少。炎性因子有调节细胞免疫功能,维持生理平衡作用;IL-6为一种促炎细胞因子,可介导炎性反应,且有多重免疫调节功能,在维持机体生理平衡方面有重要作用;IL-17则是由Th17细胞分泌得到的促炎因子,对肠黏膜炎性损伤有直接介导作用[18]。本研究观察组治疗后血清IL-6、IL-17、TNF-α水平低于对照组,证实英夫利西单抗治疗IBD可有效改善患者炎性因子水平。英夫利西单抗为一种人工合成的抗TNF-α单克隆抗体免疫抑制剂,使用英夫利西单抗可减少抗体产生,降低免疫源性以提高英夫利西单抗浓度,发挥抗炎作用,改善患者免疫功能,随其免疫应答失调状态得到纠正,肠道菌群结构也可进一步恢复平衡,这一过程伴随着肠道通透性下降,也可明显降低肠道黏膜损伤风险,如此形成良性循环,使IBD得到根治[19-20]。
应用英夫利西单抗也存在一定的不良反应,如孙杨等[21]发现,英夫利西单抗治疗IBD后出现的不良反应有白细胞减少症、呼吸道感染。本研究两组不良反应以头痛头晕、皮肤瘙痒为主,观察组也出现了白细胞减少症、呼吸道感染各1例,但不良反应发生率与对照组比较,差异无统计学意义,且两组不良反应均在予以对症治疗后复常,未发现英夫利西单抗输液反应,脱髓鞘病变及神经毒性,心肝肾功能损伤等不良反应,表明应用英夫利西单抗不会明显增加不良反应,其安全性是可靠的[22]。
综上所述,采用英夫利西单抗治疗IBD可提高临床疗效,促进患者肠道菌群恢复,并下调血清IL-6、IL-17、TNF-α水平,减少疾病活动度,不会明显增加不良反应,值得在临床推广实践。
