肠源反应性关节炎中HLA-B27表达情况及其与肠道细菌相互作用机制研究
2021-02-03王进海时志斌沙素梅史海涛
李 路,王进海,时志斌,秦 斌,沙素梅,史海涛
西安交通大学第二附属医院 1.消化内科; 2.骨科,陕西 西安 710004
脊柱关节炎(spondylo arhritis,SpA),既往也称脊柱关节病(spondyloarthropathy),因为病程中显著、持续的炎症反应,现在普遍认可命名为“脊柱关节炎”。SpA是一组临床特征表相与发病机制互相关联的疾病,包括强直性脊柱炎(ankylosing spondylitis,AS)、反应性关节炎(reactive arthritis,ReA)、炎症性肠病相关关节炎、银屑病关节炎、幼年脊柱关节炎、未分化脊柱关节炎(undifferentiated spondyloarthropathy,uSpA)[1]。其中ReA是由胃肠道或泌尿生殖道的感染引起的。致病菌通常是沙门氏菌、耶尔森氏菌、志贺氏菌、弯曲杆菌、衣原体,它们会在黏膜区域引起感染。据报道,高达80%的ReA患者为HLA-B27阳性[2]。尽管人们已经知道HLA-B27与SpA之间的紧密联系已有20多年了,但尚未充分阐明HLA-B27如何影响SpA的发病机理[3]。
触发ReA的细菌具有一些特征,例如,它们最初会影响黏膜组织区域,并且其外膜多具有脂多糖(LPS)。在ReA患者中发现了对触发ReA的微生物的免疫反应延长。与具有相同感染的非关节炎患者相比,ReA患者的血清抗体应答(尤其是IgA和IgG应答)通常是强而持久的[4]。关节炎患者中较高比例的IgA-耶尔森氏菌抗体是分泌型IgA2[5],这表明在肠黏膜中存在强而连续的抗原刺激。沙门氏菌或耶尔森氏菌感染后,致病细菌的成分已显示在ReA患者的外周血细胞中得以维持[6]。越来越多的证据表明,一些细菌和寄生虫(如沙门氏菌和利什曼原虫)通过制定各种策略逃避宿主防御,甚至在巨噬细胞吞噬体[7]内复制。吞噬体通常通过宿主细胞内吞途径进行一系列生化修饰。大量的内吞途径的生物标志物被用来识别这个过程中[8]的变化。生物标志物如溶酶体糖蛋白(LAMP1和LAMP2)和溶酶体酸性磷酸酶(LAP)通过与甘糖6-磷酸受体(M6PR)无关的机制传递到液泡中。相反,在单核细胞[9]中,含有热杀死生物体的吞噬体似乎是沿着降解途径进行处理的。因此对于含沙门氏菌吞噬体的细胞内运输模式的探讨将有助于我们了解微生物如何以及为何在看似敌对的宿主环境中生存,以及HLA-B27是否可以通过调节细胞内的运输途径影响细胞内细菌的清除。因此,了解HLA-B27如何影响ReA的进展及其机制具有重大意义。本研究通过对ReA患者体内HLA-B27表达水平的检测及HLA-B27与细胞内消灭、肠杆菌复制的相关性与转染HLA-B27的单核细胞内肠杆菌的胞内转运途径的探讨进一步了解ReA的发病机制,为其预防及治疗提供依据。
1 资料与方法
1.1 临床样本及细胞
1.1.1 ReA病例样本:本研究采用前瞻性研究,选取2018年1月至2019年10月我院收治的30例ReA患者为研究对象,男17例,女13例,年龄23~67岁。根据中华医学会风湿病学分会制定的《反应性关节炎诊断及治疗指南》[10],由我院两名专家确诊后纳入为病例组。同时筛选同期骨折及其他关节性疾病患者30例作为对照组,男15例,女15例,年龄27~65岁。两组在年龄及性别上差异均无统计学意义(P>0.05),具有可比性。本研究方案通过我院伦理委员会批准(批准号:2018012),所有纳入患者均签署知情同意书。
1.1.2 血液样本及人单核细胞采集:从19名健康捐献者中抽取外周血120 ml,男13名,女6名,年龄(39.16±8.32)岁。抽血时,所有捐献者均未服用药物。在13名HLA-B27阳性供体中,其中6名具有ReA病史,但目前无临床表现(HLA-B27+/ReA+),而其他7名无ReA史(HLA-B27+/ReA-)。用Ficoll Pague(Amersham Pharmacia Biotech AB,瑞典)分离单核细胞,并根据先前的研究培养单核细胞[11]。单核细胞通过重组人粒细胞-巨噬细胞集落刺激因子(GM-CSF)成熟为单核细胞衍生的巨噬细胞,同先前报道[11],巨噬细胞的成熟通过形态变化和某些标记在细胞膜上的表达来验证。
1.1.3 人单核细胞系(U937)细胞:U937细胞系购自美国典藏细胞库(ATCC,美国)。
1.2 研究方法
1.2.1 U937细胞转染:通过电穿孔转染pUC9载体中的全长6 kb HLA-B2705基因组DNA(B27g)(过表达序列为5′-ACACCCTCCAGAGCTGACGGCT-3′)和对照基因HLA-A2之后培养在含质量浓度为100 g/L胎牛血清(FBS,Gibco,美国),3% L-谷氨酰胺和50 g/ml庆大霉素的RPMI-1640中于体积分数为37%的CO2的细胞培养箱中。使用来自Gene Pulser(0.25 kV,960 F,Bio-Rad,美国)的单个脉冲对HLA构建体和pSV2neo载体进行共转染。模拟组中的U937细胞仅用pSV2neo质粒转染。
1.2.2 肠炎感染:绿色荧光蛋白(GFP)pACYC载体被用于转化从ReA患者的粪便样本采集后迅速接种到含有29 g/ml氯霉素的分离培养基中的肠炎链球菌,使用与上述相同的电穿孔方法。将S.enteritidis在Luria-Bertani(LB)培养基中培养,在600 nm处测试生长曲线,直到吸光度(OD)值达到0.5。细菌被放在冰上,用10%冰冷的甘油清洗3次。然后将细菌悬浮在10%的冰冷甘油(1∶200)中进行进一步实验。在含有29 g/ml氯霉素的LB培养基中,培养37 h。选择耐氯霉素的克隆,将500 μl的肠炎链球菌移入含20 g/ml氯霉素的10 ml LB培养基中,孵育5 h,使其达到对数生长。
通过在组织培养瓶中与10 ng/ml佛波醇12-肉豆蔻酸酯13-醋酸酯(PMA,Sigma-Aldrich,美国)孵育,使U937细胞成熟为巨噬细胞样细胞。5×105个细胞/孔,持续24 h。感染前2 h,用含质量浓度为100 g/L的胎牛血清的RPMI-1640代替中间膜。然后将细胞与肠炎沙门氏菌孵育1 h[感染复数(MOI)为30∶1~50∶1]。在用含质量浓度为100 g/L的胎牛血清,3% L-谷氨酰胺和50 μg/ml庆大霉素的RPMI-1640代替培养基(Biological Industries,Beit HaEmek,以色列)之前,将细胞用汉克斯平衡盐洗涤3次。
1.2.3 激光共聚焦显微镜:共聚焦显微镜(STELLARIS 5,徕卡,德国)用于评估GFP-S的共定位。肠炎和制膜蛋白。相应地计算细胞内肠炎链球菌的量。
使用共聚焦显微镜通过溶酶体标志物(HLA-B27、LAMP1、LAMP2、NRAMP1)和肠炎链球菌的共定位来确定吞噬体-溶酶体融合事件和NRAMP1定位。将10 mm玻璃盖玻片放在24孔板(Greiner Labortechnik,Frickenhausen,德国)的底部,将约5×105HLA-B27转染的U937细胞加入每个孔并用PMA刺激24 h。在感染后的每个指示时间点,将盖玻片洗涤2次,用3.7%甲醛固定10 min,用0.1%皂苷透化10 min,并用含质量浓度为20 g/L牛血清白蛋白(BSA)封闭10 min。
免疫荧光法中使用的主要抗体包括抗人HLA-B27(mAb)、抗人LAMP1/2抗体、多克隆兔抗人NRAMP1抗体。然后使用Leica TCS SP激光共聚焦显微镜(488 nm激发光,德国)进行拍照。通过在每个指示时间点分析来自3个随机场的50个吞噬体,可以计算出与给定标记共定位的含细菌吞噬体的百分比。
1.2.4 含沙门氏菌吞噬体的内吞运输检测:如前所述,使用荧光素化的葡聚糖和转铁蛋白在PBS中研究了含沙门氏菌吞噬体与吞噬细胞的相互作用[11]。感染后,于PBS中将200 μl罗丹明缀合的转铁蛋白(12.5 g/ml)与细胞在37 ℃孵育0.5 h,然后进行共聚焦荧光显微镜检查。将200 μl得克萨斯红葡聚糖(MW 70 000)或四甲基罗丹明(10 000)(10 g/ml)与细胞在37 ℃孵育0.5 h,以准备进行共聚焦显微镜检查。
1.2.5 细胞内细菌的菌落形成单位(CFU):在每个指示时间点收集细胞(单核细胞分别为1 h、4 h、24 h、72 h、7 d,巨噬细胞为1 h、4 h、8 h、24 h、72 h)以确定细胞内的数量菌。简而言之,使用500 μl,1% Triton-X 100(Sigma-Aldrich,美国)裂解细胞5 min,然后用力吸移以释放细胞内细菌。之后,将20 μl在1 ml PBS中稀释10倍。将200 μl等分试样加入96孔微量滴定板中,并将20 μl稀释液加入含20 μg/ml氯霉素的LB板中。如上所述制备盖玻片,使用入射光荧光显微镜(Leitz,Wetzlar,德国)测量细胞内细菌。从每个盖玻片总共计算出100个细胞。将内部具有至少1个GFP细菌的细胞计数为含细菌的细胞。
1.2.6 流式细胞仪检测细胞内细菌:为了确定细胞内的GFP细菌及其复制,在感染后的不同时间使用细胞刮将细胞从瓶子上刮下来。收集细胞并以4 000 r/min离心5 min。将5×105个细胞/管添加到FACs管中,用溶液I(PBS中的0.01% NaN3和2% FCS)洗涤1次,并用Immufuge高速离心1.5 min。除去上清液并沉淀沉淀物。将400 μl固定溶液(PBS中1%甲醛)添加到每个试管中,置于流式细胞仪(CytoFLEX,贝克曼,德国)进行检测。未感染的细胞为阴性对照。根据FL1处的荧光强度分离含有GFP-沙门氏菌的细胞。FITC强度超过100的细胞被认为是高荧光强度(HFI)细胞,并且被认为是细菌复制高的细胞。
1.2.7 酶联免疫吸附(ELISA)法检测TNF-α和IL-10的水平:在每个指示时间点,收集培养基用于细胞因子测量。使用ELISA检测无细胞上清液中的细胞因子TNF-α和IL-10水平。具体步骤按照试剂盒说明书操作后在405 nm处测量OD值。
1.2.8 实时荧光定量PCR(qRT-PCR)法检测HLA-B27表达情况:提取0.5 ml静脉全血DNA,按照人类HLA-B27基因检测试剂盒说明书进行荧光定量PCR检测(苏州天隆,中国),检测病例中HLA-B27表达水平。
1.3 统计学分析采用SPSS 22.0软件进行统计学分析,HLA-B27阳性和阴性细胞之间CFU和细胞因子浓度的统计比较采用t检验和单因素方差分析(ANOVA),两两比较采用SNK法。应用Spearman相关性分析计算相关性。检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 HLA-B27在ReA患者中的表达情况通过基因检测后发现,与对照组比较,病例组HLA-B27表达明显升高,差异有统计学意义(P<0.05)(见图1)。

注:与对照组比较,*P<0.05。
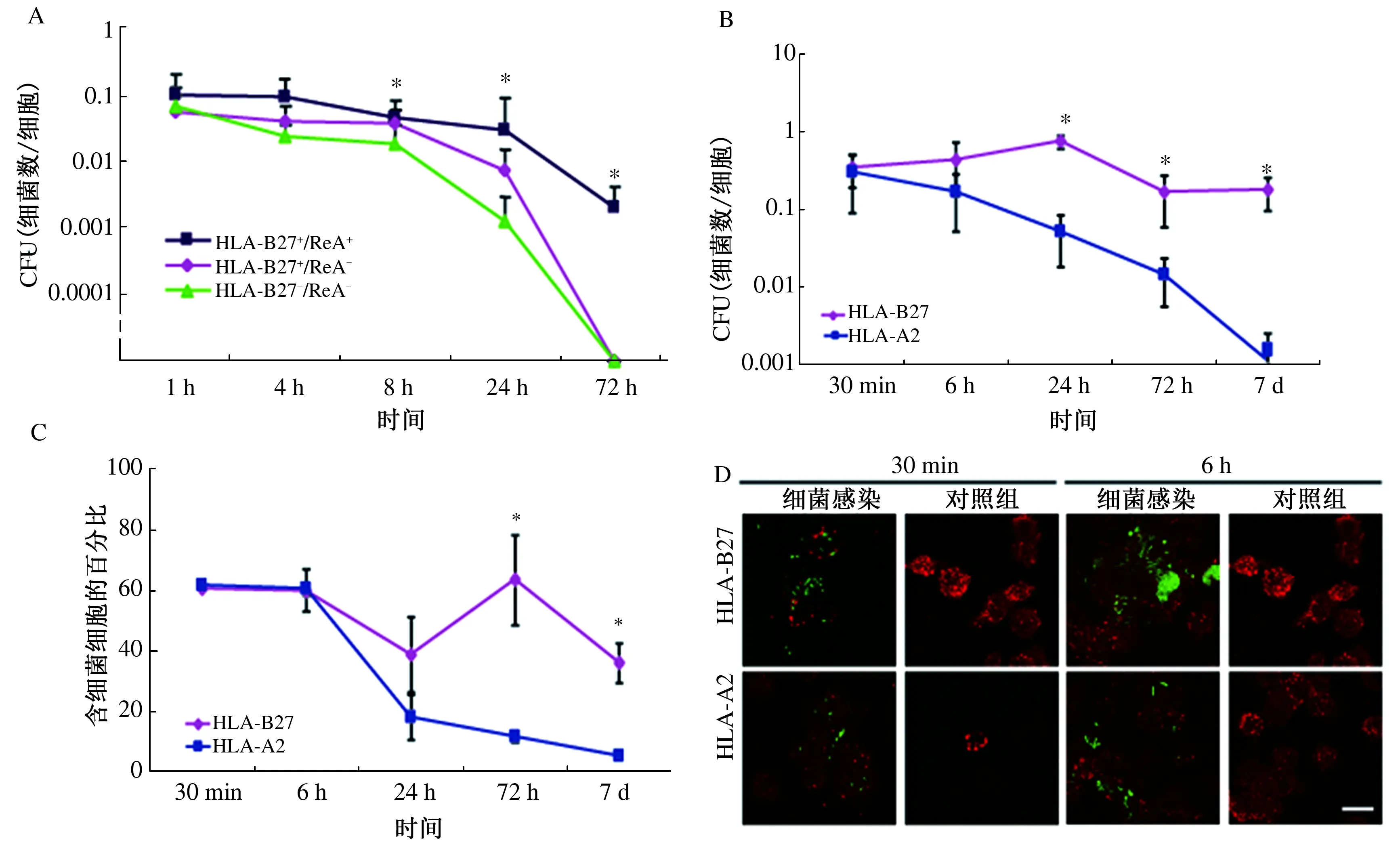
2.2 U937细胞对胞内肠杆菌的清除情况U937受到GFP标记的肠炎链球菌的感染后1 h被认为是细菌摄取的开始。HLA-B27+/ReA+处理的细胞中细菌数量多于HLA-B27-/ReA-细胞。与HLA-B27-/ReA-细胞相比,HLA-B27+/ReA+细胞清除细胞内细菌较少(分别在4 h、24 h、72 h时,P<0.05)(见图2A)。
在感染后24 h、72 h、7 d,HLA-B27细胞中感染肠炎链球菌的细胞比HLA-A2细胞中明显增多,差异有统计学意义(P<0.05)(见图2B~2C)。两种方法在不同时间点细胞内细菌的存活率略有不同,这表示细菌在HLA-A2细胞中的复制受到相对抑制作用。此外通过荧光显微镜标记我们可以看出,经HLA-B27处理的细胞细菌存活数量明显高于其他组(见图2D)。
2.3 肠炎感染后不同处理组炎症因子表达情况通过ELISA法检测肠炎感染后不同组的TNF-α和IL-10的表达情况发现,与HLA-B27-/ReA-细胞比较,HLA-B27+/ReA+细胞TNF-α的含量在24 h后明显升高,差异有统计学意义(P<0.05)(见图3A);而IL-10表达情况同样在24 h后出现明显下降,差异有统计学意义(P<0.05)(见图3B)。
注:*P<0.05。
2.4 不同处理组菌落数与炎症因子表达相关性检测
如图4所示,我们进行了相关性分析后发现,TNF-α的含量与CFU菌落形成数虽呈负相关但差异无统计学意义(r=-0.515,P=0.06),而IL-10与CFU菌落形成数呈负相关(r=-0.669,P=0.006)。
2.5 含有肠杆菌的吞噬体在细胞内的运输情况检测
本研究用溶酶体标记LAMP1和LAMP2研究了U937细胞中含有细菌的吞噬体的运输模式。通过共聚焦显微镜将溶酶体标记和GFP-S的共定位鉴定了含有吞噬体的肠杆菌。结果表明,GFP-S同时出现在HLA-B27细胞和HLA-A2细胞中且含有吞噬体的肠内菌体均可表达LAMP1和LAMP2。在感染后30 min~24 h内,60%以上的含有GFP-S的吞噬体中检测到LAMP1和LAMP2(见图5A)。

注:与HLA-B27-/ReA-细胞比较,*P<0.05,**P<0.01。
在感染后30 min和24 h,我们在HLA-B27和HLA-A2细胞中仅检测到12%~17%的细胞含有肠杆菌素的液泡中的转铁蛋白。低于20%的HLA-B27阳性转染细胞和30 min、24 h的对照细胞中发现了含有细菌的吞噬体和内吞标志物的共区化(见图5B)。因此本研究表明,HLA-B27并不调节感染细胞中含菌吞噬体与宿主内吞流量之间的相互作用。

图4 各炎症因子与菌落形成数相关性分析Fig 4 Correlation analysis between inflammatory factors and the number of colonies formed

图5 吞噬体在细胞内运输情况检测Fig 5 Detection of phagosome transport in the cell
3 讨论
有研究显示,HLA-B27转染单核细胞和成纤维细胞[11]中肠杆菌的消除受损。本研究发现,在肠杆菌感染后,HLA-B27+/ReA+患者的单核/巨噬细胞比HLA-B27-/ReA+患者分泌更多的TNF-α,而IL-10含量下降。HLA-B27本身可影响胞内肠杆菌的清除,在HLA-B27+人单核细胞内可充分复制,但在HLA-A2细胞内不能复制。提示HLA-B27可能影响单核细胞内肠杆菌的清除。
尽管目前仍有大量关于ReA中单核/巨噬细胞TNF-α和IL-10分泌异常的机制差异的争论,但TNF-α和IL-10在单核/巨噬细胞的胞内肠杆菌中的作用已经得到很好的阐明。Th1细胞因子,包括TNF-α,可诱导细胞介导免疫,产生多种重要的促炎性因子[12]。IL-10属于Th2细胞因子家族,对免疫和炎症反应具有重要的调节功能[13]。此外,有报道称,几种胞内细菌,如肠杆菌、分歧杆菌、单核增生李斯特菌等,可以通过在细胞内灭活[14]而利用IL-10在小鼠巨噬细胞内存活。在最近的研究中,检测了急性和慢性ReA患者外周血中TNF-α和IL-10的水平[14]。TNF-α在ReA患者中的表达低于类风湿关节炎(rheumatoid arthritis,RA)患者和健康人。这与本研究的结果一致。如前所述,与无关节炎[15]的肠道感染患者相比,来自于肠道感染链球菌的PBMCs提高了细胞因子的分泌表达,其中包括TNF-α和IL-10。同样,转染HLA-B27的U937细胞中,TNF-α和IL-10水平在肠杆菌感染[16]时也显示出升高。利用HLA-B27+健康人外周血单核细胞(有或无ReA病史),我们发现,细胞内微生物清除障碍与细胞因子的正常表达有关。单核细胞来源的巨噬细胞产生的TNF-α和IL-10与细胞内细菌清除有关。综上所述,单核/巨噬细胞胞内细菌的清除可能是维持细菌感染后TNF-α和IL-10合成平衡的关键。
长期以来,人们普遍认为HLA-B27在ReA的发病机制中起着重要的作用。HLA-B27具有肽结合特异性,对自身反应性CD8+T淋巴细胞(CTL)表现出自肽模拟病原体衍生的表位[17]。但未发现HLA-B27+单核细胞和巨噬细胞胞内细菌清除功能受损是由于抗原递呈功能受损所致,提示HLA-B27可能存在其他未被明确描述的功能。转染HLA-B27的人U937单核细胞无效地清除了enteritidis和Yersinia,并在enteritidis LPS[18]刺激下激活NF-κB通路。提示HLA-B27在ReA的发生发展中起着非抗原呈递的作用。后续研究表明,HLA-B27干扰了单核细胞与肠杆菌的相互作用。此外,HLA-B27细胞的胞内细菌数量高于模拟细胞。通过HLA-B27对细胞内信号传导通路的调节,可以抑制含菌噬菌体-溶酶体融合事件,并表达NRAMP1等天然抗感染因子[18]。简单地说,HLA-B27的重链易发生蛋白错折和内质网(endoplasmic reticulum,ER)超载,从而导致胞内信号传导通路的调节。
细菌的运输与其在宿主细胞内的复制密切相关,因此我们进一步进行了细胞内运输研究,以评估HLA-B27和HLA-A2细胞内细菌的细胞内运输模式。感染后30 min,有60%的含肠炎沙门氏菌的液泡(SCV)与溶酶体标记LAMP1和LAMP2共定位,但进入的转铁蛋白和右旋糖酐可接触到不到12%的SCV。我们的结果与之前的几项研究一致[11]。例如,上皮细胞中含有鼠伤寒沙门氏菌的液泡与含有溶酶体膜糖蛋白LAMP1和LAMP2的区室融合,但使用独特的途径避免某些溶酶体酶,例如组织蛋白酶D[15]。SCV不与内吞途径相交,在溶酶体生物发生中绕过了中间细胞器[11]。这种异常的细胞内靶向途径也已在分歧杆菌中得到证实[16]。连同这些发现,我们的研究结果再次证实,细胞内的病原体可以选择某种类型的溶酶体,形成高度特化的吞噬体生存和复制。此外,我们的共聚焦显微镜结果显示,大多数具有大量细菌数的SCV对LAMP1和LAMP2均为阴性,这表明了SCV在巨噬细胞内的异质性。
LAMP1可保护内体免于驻留水解酶消化。这些隔室中LAMP1的水平即使部分降低,也可能对其进行修饰,以促进细胞内细菌的存活和生长[16]。结果显示,奈瑟氏菌的致病性奈瑟氏菌2型IgA1蛋白酶可提高LAMP1降解的速率,最终促进细菌存活。因此,肠炎链球菌可能通过裂解LAMP1在人类巨噬细胞中存活。具有大量复制细菌的SCV在其吞噬体膜上显示阴性或非常少量的LAMP1,表明这些SCV中细菌的有效复制参与其中。因此,我们推测细胞内细菌的消除受到损害可能是由于HLA-B27对细菌复制的抑制作用减弱,可能是通过影响含细菌的吞噬体的成熟造成的。
吞噬体成熟的改变是允许细胞内病原体在巨噬细胞中寄生和复制的主要机制之一,这可能受到宿主细胞因子产生的限制。据报道,细胞因子会影响分歧杆菌吞噬体的成熟[17]。例如,已证明IFN-γ可增强正常小鼠巨噬细胞中分歧杆菌吞噬体的酸化,但不能增强IL-10转基因小鼠巨噬细胞中的分歧杆菌吞噬体。HLA-B27可能通过调节细胞因子的产生来影响细菌区室的成熟,然后影响细胞内复制和入侵病原体的消除[18]。
综上所述,在具有ReA病史的人群中,HLA-B27调节单核细胞和单核细胞衍生的巨噬细胞中肠炎链球菌的细胞内存活。HLA-B27导致肠炎链球菌感染后单核细胞/巨噬细胞异常产生TNF-α和IL-10,表明其与ReA的发病机理有关。SCV可以逃脱宿主细胞中正常的降解途径,并使细菌充分复制。
