帕金森病与阿尔茨海默病患者肠道菌群及炎症因子分析
2021-02-03邓爱萍陈雪平
邓爱萍,刘 焦,杨 静,陈雪平
1.四川大学华西医院神经内科门诊部/四川大学华西护理学院,四川 成都 610041; 2.四川大学华西临床医学院; 3.四川大学华西医院神经内科
肠道微生物在包括大脑在内的许多器官的功能中起着至关重要的作用。随着高通量组学技术的进步,我们对肠道内各种生态系统的组成和代谢以及由肠-脑轴组成的网络的了解正在加强。最近的研究表明,肠道微生物群可能与神经退行性疾病和痴呆的发展或进展有关[1],而帕金森病(Parkinson’s disease,PD)与阿尔茨海默病(Alzheimer’s disease,PD)是常见的神经退行性疾病及痴呆类型,因此,我们希望对我地区PD与AD患者肠道菌群的分析对比,为定向益生菌及微生物移植来控制肠道微生物群的治疗方案提供理论基础。
1 资料与方法
1.1 研究对象选取2017年1月至2020年1月就诊于四川大学华西医院神经内科的98例PD与AD患者为研究对象,随机分为对照组、观察组,每组49例。对照组为PD患者,男26例,女23例,年龄(58.36±11.47)岁(60~70岁)。观察组为AD患者,男32例,女17例,年龄(56.36±9.72)岁(60~70岁)。
1.2 诊断标准参考《2016中国帕金森病诊断标准》[2],2018中国痴呆与认知障碍诊治指南[3]。纳入标准:(1)经评定符合PD及AD的患者;(2)确诊前未服用治疗相关疾病的药物;(3)采样前3个月内未服用酸奶、皮质醇、益生菌、免疫抑制剂;(4)饮食习惯正常,非单一性饮食习惯。
1.3 排除标准(1)近2个月内接受抗生素治疗;(2)近期感染;(3)有消化系统疾病;(4)糖尿病、肥胖等代谢性疾病者;(5)患有心脏、肝等脏器功能异常或内分泌系统疾病,或结缔组织疾病,血液疾病;(6)合并其他退行性疾病。
患者自愿参与本次试验,本人及家属签署知情同意书,基线资料由同一人员收集,且本试验已通过医院伦理委员会审批(批号:2017040172)。
1.4 研究方法
1.4.1 临床基本资料及样品:记录患者基线临床资料,包括性别、年龄、BMI、高血压、高脂血症、糖尿病史等。将98例患者粪便样品(>3 g)收集于采集管后,立即保存于-80 ℃冰箱。将采集后的粪便按照说明书进行提取DNA,由沈阳万类生物科技公司完成文库的构建和测序。采用Illumina Miseq平台对细菌16S rRNA V3~V4区运用生物信息学的方法进行计算汇总。
1.4.2 生物信息分析:将原始数据去掉低质量的序列,并且将接头剔除,将剩下的高质量数据运用fasytqc软件评估。将每个序列统计后,使用uclust进行聚类分析,优化分类相似度>97%归为一个操作分类单元(operational taxonomic units,OTU)。利用Greengenes数据库(201305版本)并根据分类学分析结果,分析样品在各分类水平上的物种组成比例情况[4]。
1.4.3 炎性因子测定:抽取患者空腹静脉血3 ml,采用酶联免疫吸附法(ELISA),严格按照试剂盒步骤进行血清炎性因子测定,包括:血清IL-1、IL-6、IL-8、TNF-α的含量。
2 结果
2.1 两组患者基线资料分析对两组患者入院基线资料进行分析后发现,性别、年龄、BMI、高脂血、糖尿病、病理类型、手术方式方面比较,差异均无统计学意义(P>0.05)。
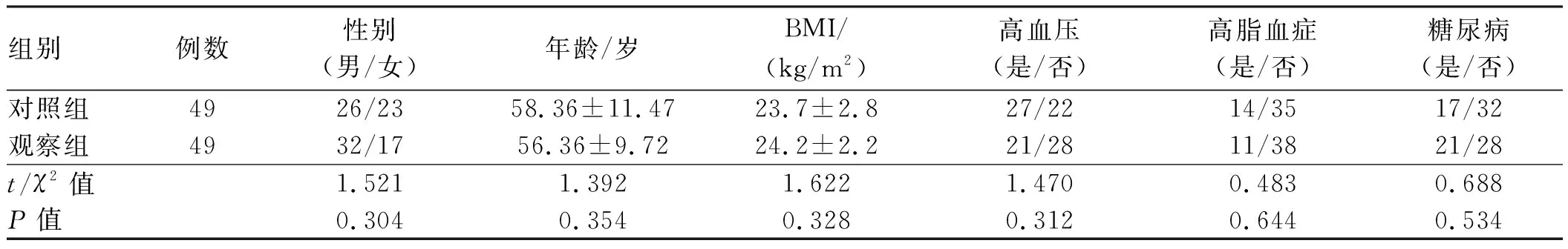
表1 两组患者基线临床资料比较 Tab 1 Comparison of baseline clinical data between two groups
2.2 OTU聚类及Rank-abundance曲线绘制通过对高变区域序列两组患者序列对比,98例样品属于15个门,28个纲,70个科,202个属,221个种,1 223个OTU(相似度>97%归为1个OTU)。通过R软件绘制Rank-abundance曲线(见图1)。
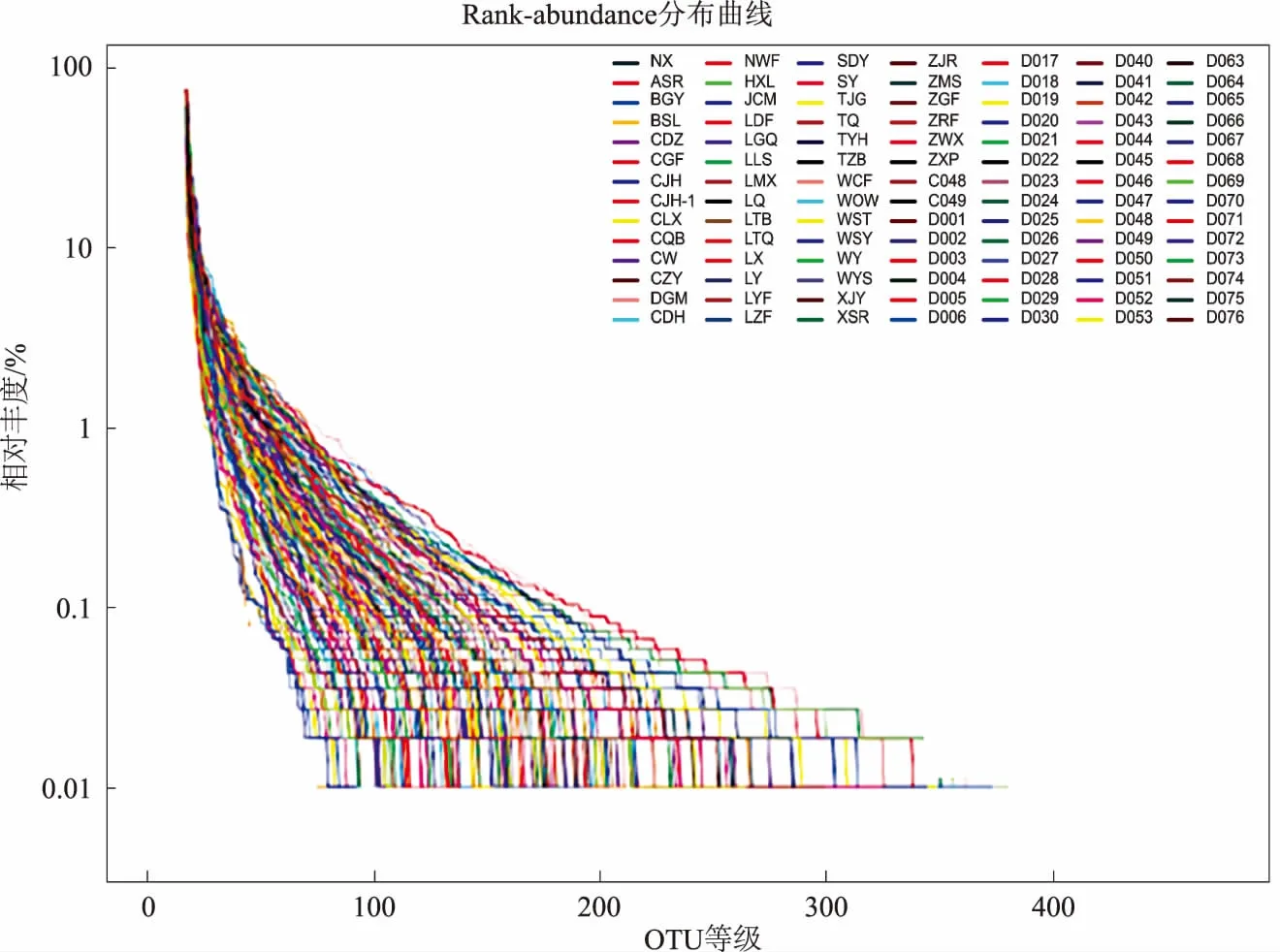
图1 可见Rank-abundance曲线平缓,样品物种分布均匀,且丰富程度正常Fig 1 Rank-abundance curve was smooth, the species distribution was uniform and the richness was normal
2.3 肠道菌群alpha分析经分析可得,与对照组相比,观察组中Chao、Ace、Shannon值降低,Simpson值升高,差异均有统计学意义(P<0.05)(见表2、图2)。

表2 肠道菌群alpha分析Tab 2 The alpha analysis of intestinal flora

注:与对照组比较,*P<0.05,**P<0.01。
2.4 肠道菌群组成分析
2.4.1 门、属种类分析:将对照组与观察组在OTU分类上进行整合,求均值,得到菌落组成柱状图。分析肠道菌群组成结构,有拟杆菌门、蓝细菌门、厚壁菌门、疣微菌门、变形菌门、梭杆菌门、软壁菌门、互养菌门、螺旋体门、酸杆菌门、浮霉菌门、黏胶球形菌门、黏胶球形菌门、脱铁杆菌门、放线菌门。在门的水平上包括变形杆菌门、拟杆菌门、放线菌门、厚壁菌门,与对照组相比,观察组中变形杆菌门(12%vs6%)、厚壁菌门(32%vs26%)降低,拟杆菌门(30%vs35%)、放线菌门(10%vs14%)升高。在属的分析结果中,与对照组相比,拟杆菌属、梭杆菌属占比下降(见图3)。
2.4.2 分析差异细菌:对变形杆菌门、拟杆菌门、放线菌门、厚壁菌门进行差异分析,与对照组相比,拟杆菌门比例上升,且差异有统计学意义(t=2.816,P=0.032),放线菌门比例有上升趋势(t=3.214,P=0.116)。变形菌门比例下降(t=2.227,P=0.042),厚壁菌门比例下降(t=2.234,P=0.045),差异有统计学意义(P<0.05)(见图4)。由于属水平研究数目过多,我们对属水平相对丰富度大于0.1%的细菌进行分析发现,与对照组相比,布劳特氏菌属、梭杆菌属上升(t=1.859,P=0.016),双歧杆菌属及乳酸杆菌属下降,差异有统计学意义(P<0.05)(见图5)。
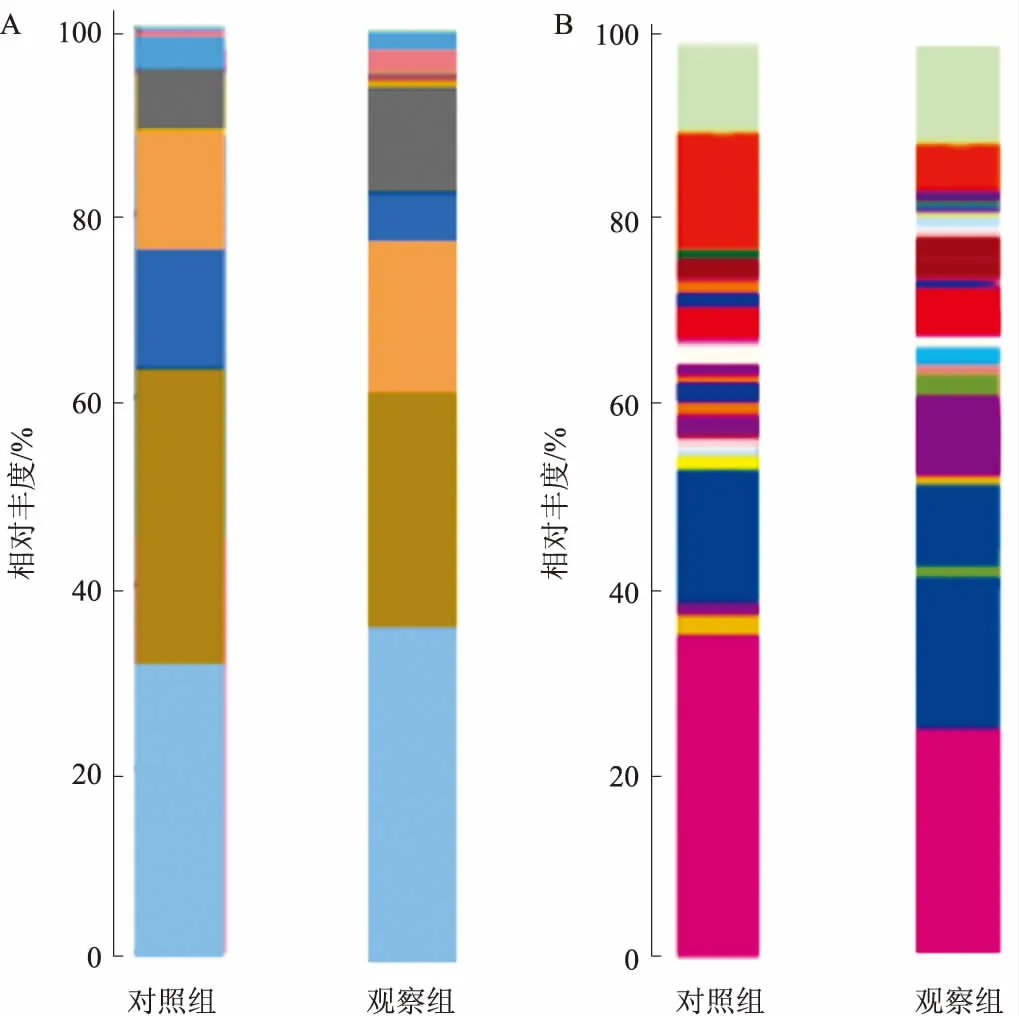

注:A:门水平分析;B:属水平分析。

注:与对照组比较,*P<0.05。

注:与对照组比较,*P<0.05。
2.4.3 两组患者炎性因子水平比较:与对照组相比,观察组患者IL-1、IL-6、IL-10、TNF-α的含量均升高,差异均有统计学意义(P<0.05)(见表3)。

表3 两组患者治疗前后炎性因子比较Tab 3 Comparison of inflammatory factors between two groups before and after the treatment
3 讨论
3.1 肠道菌群与脑人类微生物群由多种微生物组成,包括细菌、古菌、病毒、真菌、原生动物,它们与宿主建立了共存关系。我们都知道肠道聚集大量微生物,肠道菌群的失调及肠道通透性改变导致细菌的漏出,常常导致炎症性肠病和其他与免疫相关的肠道疾病和肠外疾病的发生[5]。在胃肠道之外,微生物群也在包括大脑在内的其他器官系统的功能中发挥作用。在动物及人体解剖已经发现了脑中来自肠道的细菌,他们可以通过血脑屏障,并且降低血脑屏障的通透性[6-7]。
3.2 肠道菌群与神经退行性疾病神经退行性疾病的特点是导致运动功能退化及痴呆,不仅对患者心理带来负面影响,最重要的是造成患者残疾或死亡。PD是常见的退行性疾病,目前研究较多的是PD与致病性α-突触核苷(αSyn)蛋白的产生相关,αSyn在胃肠道的积累,导致αSyn的病理形式从肠神经元到迷走神经的跨突触传递,以及沿迷走神经向脑干的逆行轴突传递[8-9]。淀粉样蛋白-β蛋白可诱导脑微血管屏障激活和紧密连接重构,细胞损伤和丢失可导致认知功能障碍,增加淀粉样蛋白-β沉积,并导致TAU病理改变,最终导致AD的发生[10]。所以,肠道的微生物菌群对于血脑屏障、脑微血管屏障的完整性影响巨大,当肠道菌群紊乱可影响αSyn及淀粉样蛋白-β蛋白数量及路径,与中枢神经系统(central nervous system,CNS)疾病的发生息息相关。
3.3 PD患者与AD患者肠道菌群多样性研究本研究初步分析了AD与PD这两个神经退行性疾病患者的肠道菌群情况。我们主要通过对门、属分类水平下检测到的菌群进行分析,结果显示,PD患者与AD患者肠道菌群Alpha多样性指数有显著差异,提示PD患者与AD患者肠道菌群中的多样性程度及丰富度是不相同的。
在门分类水平,共检测到有拟杆菌门、蓝细菌门、厚壁菌门、疣微菌门、变形菌门、梭杆菌门、软壁菌门、互养菌门、螺旋体门、酸杆菌门、浮霉菌门、黏胶球形菌门、黏胶球形菌门、脱铁杆菌门、放线菌门15种不同的菌门,两组均主要由厚壁菌门、变形菌门、门拟杆菌门和放线菌门,这与先前人类主要菌群门水平研究一致[11]。且AD患者的布劳特氏菌属、梭杆菌属上升,双歧杆菌属及乳酸杆菌属下降,布劳特氏菌属及双歧杆菌属属于厚壁菌门,而我们对门水平的进行差异分析可以看出,厚壁菌门处于下降趋势。
3.4 肠道菌群与炎症因子肠道菌群的平衡与黏膜屏障的完整性密切相关,肠黏膜屏障的组成包括由肠道优势菌群与肠黏膜上皮细胞结合所形成的生物屏障以及肠黏膜上皮细胞间紧密连接所形成的机械屏障[12]。因此我们通过对比PD患者及AD患者肠道菌群变化及炎症因子的水平对比,进一步探究差异菌群与炎症因子水平的关系。
3.5 PD患者与AD患者肠道菌群与炎性因子变化研究在炎性因子研究中发现AD患者中IL-6、TNF等炎性因子较PD患者高。促炎性细胞因子IL-6、TNF、IL-1的分泌增加,会增加大脑中的巨噬细胞反应,且激活小胶质细胞,而肠道菌群失调可以促进以TNF、IL-6、IL-1升高为特征的慢性全身炎症状态,通过增加脑微血管屏障的通透性而破坏血脑屏障[13-14],淀粉样蛋白-β蛋白会破坏血脑屏障进一步使得AD患者认知功能下降。此外,寄生于肠道菌群的细菌可释放大量的淀粉和脂多糖,可能参与了与AD发病机制相关的信号通路的调节和促炎细胞因子的产生[15]。TNF的升高驱动果蝇肠道细菌感染加重AD模型的脑病理[16],两者相互作用。
3.6 PD患者与AD患者肠道乳酸杆菌的新探索本研究中我们发现,与正常人肠道乳酸杆菌值相比,AD与PD患者均下降,且PD较AD下降比例更多。相比PD患者,我们推测AD患者肠道菌群主要以乳酸杆菌下降导致,并且与炎症因子相互作用,与患者发病相关,而临床表现更多以认知功能障碍为突出点。目前,我们了解到国外采用乳酸杆菌疗法改善PD患者运动症状,而双歧杆菌疗法在小鼠和大鼠AD模型改善记忆和学习测试,减少氧化应激,减少大脑中的组织TAU蛋白沉积[17-19]。基于以上的实验结果,随后我们可以进一步推进对伴有痴呆的PD患者肠道菌群的对比研究。
综上,肠道菌群与神经、免疫及脑-肠轴相互作用,肠道微生物的改变影响PD及AD的发生、发展,我们希望更多的研究投入定向益生菌及微生物移植,进一步控制肠道微生物群,为改善患者病情做出贡献。
