肠道菌群与肝细胞癌关系的研究进展
2021-02-03刘熙称童曼曼李凌巍秦俊杰
刘熙称,童曼曼,李凌巍,秦俊杰
吉林大学第一医院肝胆胰内科,吉林 长春 130021
肝细胞癌(hepatocellular carcinoma,HCC)几乎完全是在慢性肝病患者中发展,这是由通常长达数十年的肝脏损伤,炎症和再生的恶性循环驱动的。肠道和肝脏在解剖学和生理学上是相连的,两者之间的这种关系被称为“肠-肝轴”。肠道菌群由通常在人类肠道中共存的各种微生物组成,并具有维持宿主体内稳态的作用。然而,一旦体内稳态受到干扰,来自肠道菌群的代谢物和成分就会转移到肝脏,并在肝脏中诱发病理作用。越来越多的证据表明,细菌微生物组在促进肝病的进展和肝癌的发展中起着关键作用[1-3]。慢性肝病(chronic liver disease,CLD)中肠道屏障功能的衰竭和肠道菌群的改变会导致慢性炎症和肝病的进展,从而增加HCC的发生风险。我们对肠道微生物群在CLD中的改变及其促进HCC发生的机制作一概述,重点是肠道渗漏及营养不良。在临床前研究积累的基础上,通过靶向肠道菌群-肝轴作为同时预防晚期肝病患者病情进展和HCC发生的靶标。回顾中断这种促进疾病的信号传导轴的治疗机会,重点关注最有前途的药物和临床环境以测试这些治疗策略,以期开发出新的、创新性的肝病预防和治疗策略。
1 肠道菌群致癌机制
1.1 通过肠道渗漏和MAMP-TLR轴促进HCC过量摄入破坏组织的食物[如酒精和/或高脂饮食(high-fat diet,HFD)]会削弱肠道屏障功能,导致大量肠道微生物成分,即微生物相关分子模式(microbe-associated molecular patterns,MAMPs)和细菌代谢物甚至肠道菌群本身很容易转移到肝脏,这会促进严重的肝脏疾病,如肝炎、肝纤维化、HCC[3-4]。一方面,革兰氏阴性菌的外膜成分脂多糖(lipopolysaccharide,LPS)和革兰氏阳性菌的细胞壁成分脂蛋白酸(lipoteichoic acid,LTA)分别与Toll样受体(Toll-like receptors,TLR)4和TLR2相互作用,并通过先天性免疫反应诱导炎症反应,根据生理环境促进肝纤维化和HCC[5-6]。肥胖引起的LTA的肝易位通过创建促进肿瘤的微环境来促进HCC的发展。LTA与肥胖诱导的肠道微生物代谢产物脱氧胆酸(deoxycholic acid,DCA)协同增强肝星状细胞(hepatic stellate cell,HSC)的衰老相关分泌表型(senescence-associated secretory phenotype,SASP),以通过TLR2上调SASP因子和环氧合酶2(cyclooxygenase-2,COX2)的表达。而COX2介导的前列腺素E2(prostaglandin E2,PGE2)的产生通过PTGER4受体抑制了抗肿瘤免疫力,从而促进HCC的发展[6](见图1)。
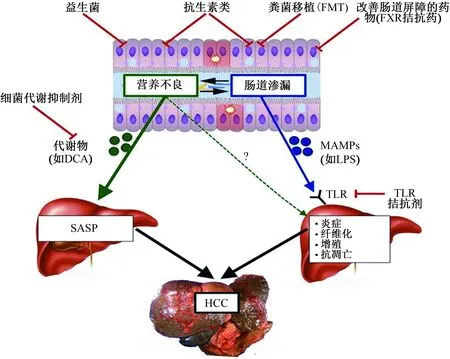
图1 多种因素致HCC发生的机制
另一方面,胆汁酸(bile acids, BAs)通过核受体转录因子作为配体来维持肝脏的稳态,从而调节肝细胞或肠上皮细胞中的代谢途径[7]。但肠道菌群产生的过量次生BAs,如DCA和石胆酸(lithocholic acid,LCA),会引起肝损伤并诱发应激反应信号,从而促使HCC患者过量摄入HFD会增加血液DCA水平,血清DCA升高可促进肥胖相关的肝癌[6,8],同时HFD会促进肠上皮细胞紧密连接的破坏[9]。这些作用促进肠道渗漏,从而使肠道中的微生物成分和代谢物更容易被吸收[2](见图1)。Ohtani等[10]的研究证实,几乎所有喂养HFD并在新生儿期用DMBA[7,12-二甲基苯(a)蒽,一种导致Ras突变的化学致癌物]治疗的小鼠均会发展为HCC。在该系统中,熊去氧胆酸促进BAs的排泄,减少了HCC的发生。在小鼠模型中,LPS的肝易位显示对肝硬化和HCC的发展至关重要,研究证实,持续暴露于低浓度的LPS会促进HCC发生。同时LPS诱导的来自TLR4的连续信号促进肝硬化,即LPS-TLR4途径通过增加驻留细胞中肝细胞生长因子和上调蛋白的增殖和抗凋亡信号促进HCC[5]。
1.2 通过营养不良、细菌代谢产物、免疫抑制促进HCC元基因组学研究表明,在CLD范围内及肝硬化患者中,肠道菌群的组成发生了重大变化(见表1)。患有晚期肝病和肝硬化患者的肠道微生物组的特征在于潜在致病菌的增加,以及具有有益特性的细菌数量的减少[11-12]。除细菌组成发生变化外,还有研究[5]发现上消化道细菌过度生长,这又与循环LPS水平升高有关。由于小肠与肝脏的解剖联系,上消化道中的细菌移位与肝病的发展有关。利用共寄宿和FMT进行的功能研究提供了证据,表明营养不良是肝病进展的可传播驱动因素[13]。尽管尚缺乏表明不良生物群可传播HCC风险的研究,但一些功能性研究指出了不良生物的作用。一个最典型的例子是短链脂肪酸(short-chain fatty acid,SCFA)的产生,SCFA是肠上皮细胞的主要能源,可在营养不良和肠屏障改变之间造成联系,从而导致肠道渗漏和HCC风险增加[14]。
2 靶向肠道菌群治疗HCC的策略
目前,除了治疗潜在疾病外,无其他预防HCC的治疗方案。考虑肠道菌群在CLD进展和肝癌发生的重要作用,肠道菌群-肝轴成为预防方法中最有希望的靶标。这些促癌信号通路可在多个途径处中断:使用益生菌和FMT恢复肠道菌群;使用抗生素消除引起疾病的细菌,并减少从肠道中释放出MAMP和代谢物;使用药物改善肠壁屏障;使用细菌代谢抑制剂来减少肠道菌群产生的促癌代谢产物(见图1)。
2.1 抗生素由于抗生素可以靶向肠道微生物群促进HCC发育的几种途径,因此它们可能代表了中断CLD中促进肿瘤的肠道菌群-肝轴的最有效策略之一(见图1)。口服抗生素混合物(氨苄青霉素、新霉素、甲硝唑、万古霉素)进行肠道内清洁,有效地减少了二乙基亚硝胺(diethylnitrosamine,DEN)+CCl4或DMBA+HFD诱导的小鼠肝癌的数量和大小[5,8,19]。此外,这种抗生素混合物还减少了肝纤维化,这代表了CLD中HCC发展的危险因素也可以针对[20]。值得注意的是,当已经存在微观肿瘤时,在致癌作用的晚期阶段使用抗生素比早期阶段能更有效地降低小鼠HCC的患病率,故即使在晚期肝硬化和HCC的高风险患者中,也可以通过抗生素治疗、预防HCC。

表1 CLD患者中肠道菌群的改变Tab 1 Changes of gut microbiota in CLD patients
目前,两种抗生素(诺氟沙星和利福昔明)已显示出对CLD患者或鼠类HCC模型有益的疗效。诺氟沙星是一种吸收不良的喹诺酮类。晚期肝硬化患者的临床试验表明,长期口服诺氟沙星可有效地减少患者的小肠细菌过度生长和细菌易位,但由于诺氟沙星耐药性的增加,使得它可能适合持续数周至数月的治疗,但不适用于长期或终身应用。利福昔明是一种不可吸收的抗生素,具有广谱抗菌活性,并且具有出色的安全性,它可以减少肝硬化自发性腹膜炎的发展,同时改善门静脉高压症,这表明它可以有效靶向晚期肝病的肠-肝轴[21]。利福昔明可以降低DEN-CCl4模型中HCC的发生,尽管其效率比上述四联抗生素低。虽然有大量接受利福昔明预防肝性脑病的患者,但利福昔明对肝癌发展的影响仍然未知。因此,迫切需要确定长期使用利福昔明治疗对肝癌发展的影响的研究。而且对利福昔明耐药的临床相关研究尚未见报道,这表明它非常适合长期甚至终身治疗。
2.2 益生菌已有学者提出益生菌作为通过恢复有益细菌来重新平衡CLD中肠道菌群的一种手段(见图1)。许多天然饮食产品具有预防肝病的能力[22-24],它们显示出改善肠道黏膜完整性,调节微生物群组成,减少肝脏中有毒代谢物的产生和降低细菌移位的潜力[25-27](见图1)。在发酵食品中常见的天然有益细菌,如植物乳杆菌,可以作为益生菌改善肝脏疾病[28]。益生菌(双歧杆菌+嗜酸乳杆菌+活蜡状芽孢杆菌)的组合可抑制高蔗糖和HFD喂养的大鼠的非酒精性脂肪性肝病进展[29]。备受关注的是,这种益生菌补充剂可能通过LPS/TLR4信号通路改善肠道菌群失调,恢复肠屏障完整性,减少血清炎性细胞因子,减弱血清肝酶和糖代谢生物标志物升高及改善肝脏病理的能力。
在DEN诱导的肝癌发生的大鼠模型中,使用VSL#3(包含嗜热链球菌、短双歧杆菌、长双歧杆菌、婴儿双歧杆菌、嗜酸乳杆菌、植物乳杆菌、副干酪乳杆菌、乳状乳酸杆菌、芽孢杆菌)[19,21]可发现肠道炎症和肝肿瘤生长减少和多样性降低。迄今为止,仅在鼠类肝癌模型中对益生菌进行了研究,尚缺乏临床数据。因此需要进一步的研究来确认这些数据,扩展人类研究并研究其作用机制。
2.3 FMTFMT已成功用于艰难梭菌感染的患者,优于标准抗生素治疗的临床改善[30]。目前,正在对FMT进行临床试验中的多种其他疾病的评估,包括非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)和肝硬化。然而,因反复艰难梭菌感染而接受FMT的患者通常经历了多个疗程的抗生素治疗,并且微生物多样性显著降低。正如Vrieze等[31]的试验所见,尽管如此,FMT也可以恢复CLD患者的肠道菌群失调,可能会减少或延迟肝癌的发展。但目前尚无支持该前提的数据。目前尚不清楚肝硬化中胃肠道生态系统的严重改变是否能够通过FMT永久恢复微生物群,影响有可能是短暂的,微生物群落最终将恢复为FMT之前的状态。此外,病毒感染和其他病原体可能通过FMT传播,由于其免疫抑制作用,这对晚期肝病患者尤其有害。或许将来粪便可能会被替代为特定的培养细菌混合物,这些混合物类似于通过FMT移植的人类微生物群,并具有相同的有益效果。这种方法不仅可以减轻对致病病原体通过FMT的无意传播的担忧,而且也使肠道菌群治疗更为患者和医师所接受。一旦达到这一目标,晚期肝病患者应被视为研究疾病进展和肝癌发展的潜在候选者(见图1)。
2.4 TLR拮抗剂及改善肠屏障药物研究表明,TLR4途径在CLD和肝癌发生中的肠-肝轴促进疾病的作用中起着关键作用。基于这些发现,阻断TLR4途径可能代表了另一种预防HCC的途径(见图1)。借助有关LPS激活TLR4机制的详细知识,已开发出多种TLR4拮抗剂[2],它们分别为:结合和螯合LPS的化合物,如多粘菌素B;拮抗LBP和CD14-LPS相互作用的化合物;针对LPS-MD-2或LPS-MD-2-TLR4相互作用的化合物,如E5531和E5564;直接靶向TLR4的化合物,如TAK-242;以及抑制TLR4活性的分子,如沙利度胺。遗憾的是,迄今为止,这些药物均未在CLD或HCC患者的临床试验中进行过测试。肠道渗漏作为肝脏疾病进展和HCC发生的主要驱动因素(见图1),靶向肠屏障似乎成为一种有吸引力的治疗方法,同时还可以避免靶向微生物群的某些并发症(如耐药性的产生和/或微生物多样性的降低)或介导渗漏性肠道疾病促进作用的受体(如TLR4拮抗作用导致的免疫抑制)。
BAs是肠屏障的重要调节剂。法尼醇-X受体(farnesoid-X receptor, FXR)是BAs的受体,介导其对肠上皮屏障的作用及对肝脏的多种作用,如抑制BAs合成,抑制肝脏炎症,促进肝脏再生和抑制肿瘤[32]。FXR活化的许多肝效应是由肠道FXR受体介导的,导致FGF19的释放,然后作用于肝脏中的靶标。缺乏FXR的小鼠表现出肠道完整性受损,在胆管结扎之后进一步恶化,并且HCC的发生率很高[33]。而激动剂GW4064或奥贝胆酸(obeticholic acid,OCA)对FXR的激活可以减弱小鼠和大鼠的黏膜损伤,回肠屏障通透性,细菌过度生长和细菌易位[34-35]。由于OCA的不良反应少,它成为HCC预防疗法的最有希望的候选者,尤其是通过纠正肠-肝轴上的多种异常而发挥作用,而这些异常会促进肝硬化患者的慢性炎症和HCC的发展。
3 未来展望
在过去的30年中,大量的研究证实肠道菌群在肝病进展的多个方面起到重要作用。肠道菌群促进肝脏疾病和HCC发生的机制包括微生物失调(导致细菌代谢产物改变,例如促癌的DCA)及渗漏的肠道(通过MAMP-TLR轴促进慢性肝炎介导的信号)。通过了解有关肠道菌群影响CLD和HCC发展的关键途径的详细知识,可以开发出广泛的或精准的治疗方法,从而阻断促进疾病发展的肠道-肝脏信号传导轴。此外,我们目前对肠道菌群作用的理解主要基于动物模型和患者粪便菌群样品。由于肠-肝轴的许多关键变化均发生在小肠,也可能发生在黏膜粘附的微生物群中,因此需要对不同解剖部位的人类微生物组成进行更好的分析。对此,我们应投入更多的精力将目前关于肠-肝轴对肝癌促进作用的知识转化为精心设计的试验应用在患者中。通过不可吸收的抗生素(如利福昔明)控制微生物群,可以潜在地改善营养不良或“再生物”。在具有多重耐药性的细菌时代,迫切需要在不借助广谱抗生素的情况下改变微生物群的疗法。可以通过益生菌治疗或最终以FMT形式进行完整的微生物菌群移植来实现无需药物直接控制微生物菌群的操作,更迫切需要在这一领域进行大规模、高质量的研究,以评估实现“菌群再生”的最有效方法。
