金属-有机框架材料去除水中重金属Cr(Ⅵ)的研究进展
2021-02-03徐丽繁廖伟名
徐丽繁,廖伟名
(1. 佛山市环境监测中心站,广东 佛山 528000;2. 广东工业大学 轻工化工学院,广东 广州 510006)
Cr(Ⅵ)因其致癌特性而被公认为环境重点污染物之一。它在水溶液中的存在形式会随着pH的改变而不同,包括H2CrO4(pH<2)、HCrO4-(pH<9)、(pH>6)[1]。Cr(Ⅵ)即使在低浓度下也具有较高的毒性,因此,WHO规定饮用水中的Cr(Ⅵ)浓度必须低于0.05 mg/L。目前,Cr(Ⅵ)依然被广泛应用于印染、冶金、皮革鞣制等领域,含Cr(Ⅵ)废水的排放将对环境水体造成严重污染。因此,研究去除水中的Cr(Ⅵ)对解决重金属污染问题有着极其重要的意义。金属-有机框架材料(MOFs)[2]是一种由金属离子或团簇与有机配体通过配位键自组装形成的多孔配位聚合物。其结构高度有序、稳定性高,化学可修饰性好,尤其是可通过有机配体的功能设计来实现孔结构的调控,使得MOFs在环保领域发挥了重要作用[3-4]。MOFs的多孔性、良好吸附能力和催化活性使其在Cr(Ⅵ)吸附和转化方面具有明显优势[5-6]。
本文综述了MOFs应用于去除水中Cr(Ⅵ)的最新研究进展,从吸附和氧化还原两个方面对比了不同MOFs去除Cr(Ⅵ)的效率、影响因素和作用机理,并阐述了MOFs在去除Cr(Ⅵ)领域的应用前景。
1 除Cr(Ⅵ)方法简介
目前,水体系中除Cr(Ⅵ)的方法主要包括:絮凝沉淀、膜分离、生物处理、吸附、氧化还原等方法。
1.1 絮凝沉淀法
絮凝沉淀法包括絮凝法和沉淀法两种[7]。絮凝法是指通过向金属废水中添加无机、有机或生物质絮凝剂,或外界电、磁刺激效应,实现重金属的絮凝分离和去除。沉淀法与絮凝法不同的是,沉淀法中除加入沉淀剂外往往还会加入助凝剂,以使固体颗粒快速凝聚变大而沉淀出来。
1.2 膜分离法
膜分离法[8]是基于离子交换膜的选择透过性,利用膜两侧的化学电势差,将溶剂和溶质进行分离或浓缩的方法。其理论基础是离子在离子交换膜两侧达到Donnan平衡。该技术方法主要分为电渗析法、反渗透膜、纳滤分离技术、超滤分离技术等。
1.3 生物处理法
生物处理法是指利用生物体及其局部结构的吸收、修复、富集、还原等作用降低被污染水体中重金属含量的技术,主要发生在植物代谢、微生物絮凝和细胞吸附等过程[9-10]。
1.4 吸附法
吸附法是指利用具有大比表面积、多孔结构的合成材料,通过与重金属离子之间形成的物理或化学作用力而相互吸引,从而达到去除重金属的目的。吸附剂材料通常包括无机材料(硅藻土、沸石、多孔碳等)、有机高分子聚合物和MOFs等[11]。
1.5 氧化还原法
氧化还原法是指在含Cr(Ⅵ)废水中加入还原剂发生氧化还原反应,还原剂被氧化的同时,Cr(Ⅵ)被还原成低毒的Cr(Ⅲ)。常见的还原剂包括金属单质[12]和金属盐(Fe、Au、FeSO4、Na2SO3等)、乙醇、水、有机Fenton试剂等[13]。
1.6 小结
笔者总结了利用以上方法去除水中Cr(Ⅵ)的一些研究工作,详见表1。由表1可见:最佳的pH范围在2~9之间;各种方法的去除率均超过65%,而氧化还原法的去除率最高,可达95%以上;在吸附法中,MOFs(如Fe-GA(D))表现出良好的Cr(Ⅵ)吸附性能。为此,本文将重点讨论MOFs中采用吸附法和氧化还原法去除Cr(Ⅵ)的相关研究进展。
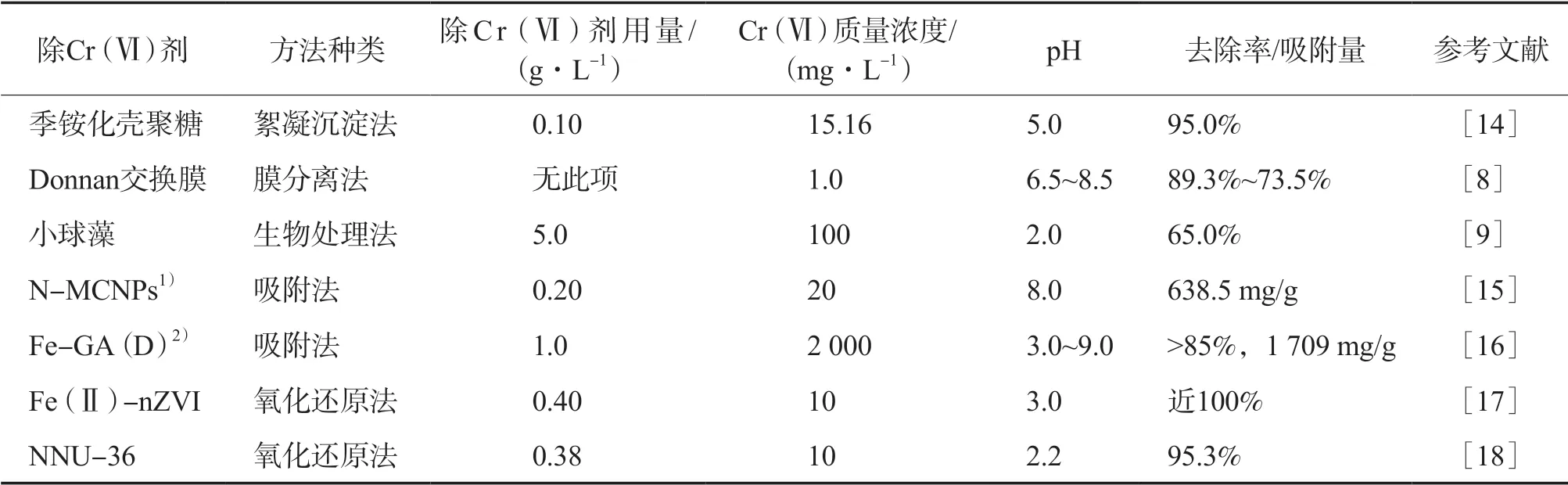
表1 各种方法去除Cr(Ⅵ)的效果和实验条件
2 MOFs吸附除Cr(Ⅵ)
通过吸附质的扩散以及吸附剂与吸附质之间的范德瓦耳斯力、静电作用等可以实现吸附除Cr(Ⅵ)。饱和吸附量是目前常用于评判吸附材料除Cr(Ⅵ)性能的重要参数。已有研究中,MOFs用于吸附除Cr(Ⅵ)时的吸附能力相差较大,饱和吸附量处在0.15~1709.2 mg/g之间[16]。
2.1 吸附动力学和吸附等温线
吸附动力学对确定吸附的平衡时间、预测吸附过程的最佳条件非常重要。通过将实验数据拟合到动力学模型中,可以预测吸附作用(物理或化学吸附)、吸附和脱附过程以及速率控制步骤。重金属吸附的吸附动力学主要包括准一级、准二级、粒子扩散和叶洛维奇模型[19]。而其中最常见的是准一级和准二级动力学模型。
吸附等温线用于分析吸附材料的表面性质和吸附能力,其中以Freundlich和Langmuir等温线模型最为常用。Freundlich等温线对应重金属离子在吸附剂表面进行的多层和非均质吸附[20];而Langmuir等温线则对应单层吸附[21]。
MOFs可通过静电作用、扩散和范德瓦耳斯力实现对Cr(Ⅵ)的吸附[5]。已报道的MOFs吸附Cr(Ⅵ)的过程主要属于准二级动力学和Langmuir模型[22],少部分属于准二级动力学和Freundlich模型[23]以及准一级动力学模型[24]。
2.2 Zr-MOFs吸附除Cr(Ⅵ)
基于吸附剂所必须具备的水稳定性和耐用性,已报道的MOFs吸附剂大多数是基于锆离子(Zr4+)与多元羧酸构筑的三维多孔框架材料。这是因为,根据软硬酸碱理论,硬酸中的Zr4+与硬碱通过配位作用结合可以形成稳定性高的Zr—O键,利于制备在水中稳定,甚至耐酸、耐碱的MOFs[25]。利用氢键作用、静电作用、离子交换、pH调控等,可有效提升Zr-MOFs的除Cr(Ⅵ)效果。
2.2.1 氢键作用
2.2.2 静电作用
Cr2和带有较多的负电荷,与正电性基团有很强的亲和力。通常,水溶液中会同时共存多种阴、阳离子,因此,开发高选择性的MOFs吸附材料是除Cr(Ⅵ)的重要研究内容之一。HE等[26]发现,当Cl-、Br-、存在时,BUT-39对的吸附几乎没有影响,表现出良好的吸附选择性。这是因为具有较高的电荷密度(与相比),而且还可与MOFs的框架发和生特定的相互作用。
然而,当水溶液中存在其他竞争性阴离子或带大量负电荷的阴离子时,则可能对吸附造成干扰。SATHVIKA等[27]利用亚硝化单胞菌对Zr-MOFs进行改性,合成了新型吸附剂微生物-MOFs。他们选择了Ni2+、Mn2+、Cu2+、Hg2+、Fe2+、Pb2+、Co2+等阳离子和等阴离子作为Cr(Ⅵ)去除过程中的干扰物质。研究发现,氯络合物与氢铬酸盐离子的竞争会降低对的吸附效率。另外,Mn2+和Fe2+对具有还原性,也会降低吸附效率。在另一项研究中,YANG等[23]研究了Mn掺杂的UiO-66(Mn-UiO-66)MOFs对的吸附性能,发现负电荷更多的阴离子与MOFs的相互作用更强从而在MOFs吸附时与产生强烈竞争。
2.2.3 离子交换
RAPTI等[28]合成了一种基于UiO-66的氨基功能化阳离子MOFs,MOR-1。它表现出对的较高吸附容量(286 mg/g,即对Cr(Ⅵ)138 mg/g),这归因于MOFs中的Cl-与溶液中的发生离子交换。当溶液pH在2~8之间改变时不会影响MOFs的吸附能力,并且对的吸附效果不受其他阴离子的影响,即使过量10倍也是如此。
RAPTI等[29]利用氨基吡啶修饰的对苯二甲酸配体(H2PATP)合成了一种氨基内悬挂的MOFs(H16[Zr6O16(H2PATP)4]Cl8),命名为MOR-2。MOR-2与之间有很强的相互作用,1 min内可以吸附194 mg/g Cr(Ⅵ)。在体系中加入常见竞争离子(包括和,对的去除几乎没有影响。和MOR-2之间的强相互作用、微孔结构、吡啶基官能团以及孔中不稳定或易于交换的Cl-的存在均可促进该MOFs对的吸附。
ZHANG等[30]合成了一种甲基修饰UiO-67类MOFs,ZJU-101。它具有较快的Cr(Ⅵ)吸附速率和较高的Cr(Ⅵ)去除率(10 min内去除率可达96%),同时表现出优秀的吸附选择性,这归因于—N+CH3基团与之间的强静电吸引以及孔洞内NO3-与溶液中发生离子交换。
2.2.4 pH调控
2.2.5 其他
为了得到Cr(Ⅵ)吸附能力强、选择性高的Zr-MOFs,研究人员还通过将不同官能团引入配体的方法对MOFs进行修饰。如已报道的氨基化的NH2-UiO-66[33]、异烟酸功能化的TMU-66[32]、吡啶基修饰的MOR-2[29],这些材料均具有良好的Cr(Ⅵ)吸附性能。
2.3 其他金属MOFs吸附除Cr(Ⅵ)
除Zr外,其他金属MOFs通常在水溶液尤其是酸(或碱)溶液中不稳定,所以仅有少数基于Fe3+,Co2+,Ni2+,Cu2+,Zn2+,Ag+,Eu3+[34-38]金属离子的MOFs被应用于吸附除Cr(Ⅵ)研究。
将特定官能团引入MOFs框架中可以提高其对目标污染物的去除效率。LÜ等[39]报道了一个含氨基的对苯二甲酸配体与Zn2+构筑的三维MOFs,NH2-Zn-MOF。该MOFs可以选择性地吸附和离子,这是因为其分子中的氨基和羧基氧能螯合上述离子中的Cr(Ⅵ)。此外,与Zr-MOFs的策略类似,在MOFs中加入纳米纤维[35]、Fe3O4颗粒[40]、矿化剂[24]等形成复合物,也能有效提高MOFs对Cr(Ⅵ)的吸附性能。
正电性有利于提高MOFs对Cr(Ⅵ)的吸附能力。ABOUTORABI等[41]报道了一个基于异烟酸氮-氧化物配体的三维MOFs,TMU-30。研究发现,TMU-30在pH为2~9范围内对H和有很好的吸附性能,Cr(Ⅵ)吸附量可达145 mg/g。这是因为配体基团带正电荷,能与Cr(Ⅵ)离子产生静电相互作用。此外,YANG等[40]将Fe3O4包埋于MIL-100(Fe)中也能实现对的较好吸附,这得益于该MOFs存在的大孔结构和Fe金属簇的正电性。进一步的研究发现,该MOFs包埋矿化剂Na2CO3也可有效提高对的吸附[24]。
为了有效比较不同类型MOFs对Cr(Ⅵ)的吸附性能,LIN等[42]对6种水稳定MOFs进行了除Cr(Ⅵ)研究,包括HKUST-1、ZIF-8、MIL-100(Fe)、UiO-66、UiO-67和NU-1000。根据吸附数据,与市售的活性炭相比,NU-1000在pH为3~6范围内对具有最高的吸附率(98%)。吸附动力学表明,在仅5 s和1 min内NU-1000即可快速除去82%和92%的这应与Zr6—O簇存在的大量空位点有关。同时,NU-1000也表现出较高的吸附选择性。
3 基于MOFs的Cr(Ⅵ)催化还原
3.1 光催化还原
由于有机配体在紫外/可见光的照射下可以发生到金属—氧簇中心的电荷转移而具有类半导体特征[43]。光诱导MOFs出现光生电子和空穴的分离,电子具有还原性,而空穴具有氧化性,可用于还原高价氧化态重金属离子污染物[44]。MOFs具有较大的比表面积和可调孔径,可以较好地吸附重金属离子,同时具有良好的电子导电性能[45],利于氧化还原过程的电子传递,是去除重金属离子的潜在光催化材料。
MOFs光催化还原Cr(Ⅵ)主要包括3个重要阶段:1)光诱导光生电子和空穴分离;2)电子迁移、输送至孔内壁或材料表面;3)电子参与还原反应使Cr(Ⅵ)生成低价的Cr(Ⅲ)。由此,研究者通过多种策略提高MOFs的光催化性能,如设计功能化有机配体[18,46-48](调节配体电子能级和能带结构),调控金属—氧簇种类[49](提高配体与金属中心的能级匹配和电子传输效率),孔结构设计[18](促进重金属离子和底物的扩散、吸附、脱附、转移),耦合其他催化剂[50-52](捕获空穴、稳定电子态)等。
3.1.1 提高配体吸光能力
SHEN等[46]利用氨基对苯二甲酸与Zr离子构筑了UiO-66(NH2)多孔MOFs,并研究了它与甲醇耦合还原Cr(Ⅵ)的性能。氨基功能化的UiO-66(NH2)具有良好的半导体性能,光照下发生电子和空穴的有效分离,在80 min内可使Cr(Ⅵ)的还原率达到97%以上,并能保持良好的稳定性。光催化机理的研究表明,其可能的反应历程如下:
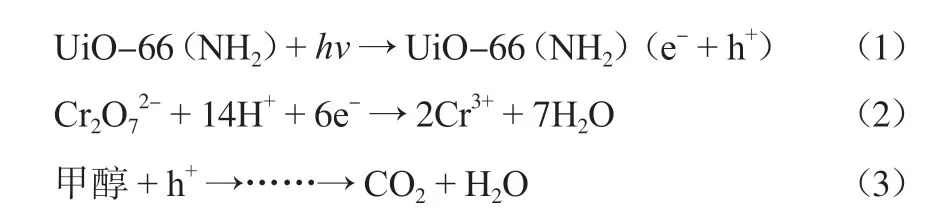
3.1.2 金属中心簇设计
一些变价金属的MOFs由于具有良好的光活性也被研究用于光还原除Cr(Ⅵ),如Fe-MOFs、Ti-MOFs、Zn-MOFs[48-52]等。例如,SHI等[53]报道了一种具有双通道还原Cr(Ⅵ)的Fe-MOFs,NH2-MIL-88(Fe)。一方面,Fe—O簇能在可见光照射下直接激发产生光电子从而还原Cr(Ⅵ);另一方面,配体受可见光激发发生配体到Fe—O簇的电子转移,—NH2基团可以加速电子传递和减少电子-空穴对的复合。
3.1.3 基于MOFs的复合催化剂
将导体(如Ag、Au、Pd、Pt等)、半导体(还原氧化石墨烯、金属硫化物、C3N4、ZnO等)与MOFs复合,能有效捕获空穴和稳定还原电子,降低电子-空穴复合率,从而提高光还原Cr(Ⅵ)效率[44]。
3.2 甲酸辅助还原
有研究者发现,甲酸可作为还原Cr(Ⅵ)的辅助剂,即甲酸先在催化剂作用下分解为氢气和二氧化碳,随后具有还原性的氢气将Cr(Ⅵ)还原为Cr(Ⅲ)[54]。形成金属-甲酸中间体可能是甲酸辅助还原的关键步骤,目前已报道的催化剂以Pt、Pd、Au、Rh等贵金属的MOFs为主[55]。
4 结论与展望
探索水稳定MOFs用于去除Cr(Ⅵ)已成为Cr(Ⅵ)治理领域越来越流行的研究热点。MOFs具有对Cr(Ⅵ)良好的吸附容量、广泛的酸碱适用范围以及快速吸附的特征。此外,MOFs还可在可见光驱动下催化还原Cr(Ⅵ)为低毒的Cr(Ⅲ)。这些都体现了MOFs在去除水中重金属污染领域潜在的广阔应用前景。但是,要将MOFs应用于实际水处理,仍然存在较大挑战。
a)大多数MOFs是通过溶剂热法在有机溶剂中合成的,对环境有一定影响,应开发环境友好的水相合成、无溶剂合成技术。同时,溶剂热法难以对MOFs实现量产,电化学、微波、超声、机械研磨等方法将有望解决此类问题。
b)已报道的MOFs局限于UiO-66、Fe—O簇等较少种类网络结构,孔径也局限于微孔范围内,这会阻碍孔内大体积金属离子的迁移。为此,应丰富孔可调的MOFs结构,优化吸附和催化还原活性位点。
c)尽管已有不少吸附和催化还原Cr(Ⅵ)方面的研究,但通过确切单晶结构表征吸附和催化过程的报道尚少,不足以全面深入揭示吸附动力学和催化机制。
综上,要利用水稳定MOFs去除重金属Cr(Ⅵ)污染,需进一步提高其应用潜力,如通过后修饰方法开发高孔隙率和丰富活性位点的绿色MOFs,设计合成MOFs-MOFs、MOFs-半导体等混合多组分功能复合材料,开发稳定、高效、高选择性、廉价的MOFs等。
