双荧光素酶报告基因系统验证hsa-miR-1291对ARHGAP29基因的调控作用
2021-02-03刘麒薇吕承晓
徐 倩 汪 沙 刘麒薇 吕承晓 甘 露 柳 鑫
(首都医科大学附属北京妇产医院妇科微创中心,北京 100006)
微小RNA (microRNA, miR)是重要的内源性短链非编码RNA分子,通过对其相应靶基因的负性调节,下调靶基因的表达,从而影响靶基因相关的各种生物学调控机制[1-2]。Rho家族小GTP酶(RhoGTP酶)是细胞表面受体同肌动蛋白细胞骨架的信号桥梁,而Rho GTP酶活化蛋白29 (Rho GTPase activating protein 29,ArhGAP29)可以调节RhoGTP酶活性,影响细胞黏附、细胞-细胞外基质黏附以及肌动蛋白重排[3-5]。研究[5]显示,hsa-miR-1291在宫腔粘连内膜组织中出现异常上调,通过构建差异microRNA与负相关基因的调控网络模式图,预测ARHGAP29为其潜在靶基因。ARHGAP29基因定位于人类染色体1p22.1,基因转录本长度为8 952 bp,编码蛋白大小为1 261个氨基酸。本研究拟采用双荧光素酶报告基因系统,进一步验证hsa-miR-1291能否对预测靶基因ARHGAP29产生靶向调控作用。
1 材料与方法
1.1 实验材料
ARHGAP29目的基因序列及突变序列由广州市锐博生物科技有限公司合成,293T细胞系购自中国科学院典型培养物保藏委员会细胞库,蛋白胨、酵母提取物(英国OXOID公司),限制性内切酶(XhoI, NotI)、连接反应液、DNA聚合酶(美国Thermo公司),质粒小提试剂盒、DNA纯化回收试剂盒、DH5α感受态细胞(北京天根生化科技有限公司),2×Kofu Mix(广州市锐博生物科技有限公司),氨苄西林(美国Sigma公司),DMEM培养基、胰酶(美国GIBCO公司),Lipo6000TM转染试剂(碧云天公司),pmiR-RB-ReportTMh-ARHGAP29(NM_004815.43′UTR: 61-945)-WT(h-ARHGAP29-WT)、pmiR-RB-ReportTMh-ARHGAP29(NM_004815.43′UTR: 61-945)-MUT(81-87: CAGGGCC>GTCCCGG)(h-ARHGAP29-MUT)、micrON®hsa-miR-1291mimic and micrON®miRNA mimic NC(广州市锐博生物科技有限公司)、Dual-Glo®荧光素酶检测系统(美国Promega公司)、LUMITRACTM200 96孔白色细胞培养板、GLOMAX 96 分光光度计(美国Promega公司),PCR仪(美国Bio-RAD公司),离心机(湖南湘仪实验仪器开发有限公司),恒温振荡器(上海精宏实验设备有限公司),培养箱(上海一恒科技有限公司),生物洁净工作台(苏净安泰空气技术有限公司)。
1.2 实验方法
1.2.1 生物学位点预测
利用生物学靶基因预测软件Targetscan(www. targetscan.org)对 hsa-miR-1291与预测靶基因ARHGAP29的3′非编码区(3′ untranslated region,3′UTR)位点进行分析,得到分析结合位点。
1.2.2 双荧光素酶报告基因载体的构建
序列合成:分别化学合成ARHGAP29基因野生型序列及突变型序列,并在序列两端添加XhoI、NotI酶切位点。PCR扩增及纯化:合成序列克隆至pmiR-RB-ReportTM载体骨架中,PCR扩增产物进行1.5%琼脂糖电泳分析,引物序列见表1。纯化PCR产物。酶切:用XhoI、NotI对纯化产物和载体进行双酶切,回收纯化酶切产物。连接:连接目的片段与pmiR-RB-ReportTM载体骨架。转化:取连接产物加到100 μL DH5α感受态细胞中混匀,冰浴30 min,42 ℃水浴90 s,取出后立即置于冰浴中放置2~3 min,向其中加入900 μL 37 ℃预热的LB(不含抗生素)培养基,150 r/min、37 ℃振荡培养45 min。吸走上清液,100 μL 混匀菌液,加到含Amp抗生素LB固体琼脂培养基上(抗生素浓度100 μg/mL),将平板倒置,37 ℃培养12~16 h。 菌落鉴定及测序:挑取上述平板上的单菌落,溶到3 μL水中,取0.5 μL做模板,进行PCR。提取质粒,阳性克隆进行测序鉴定。
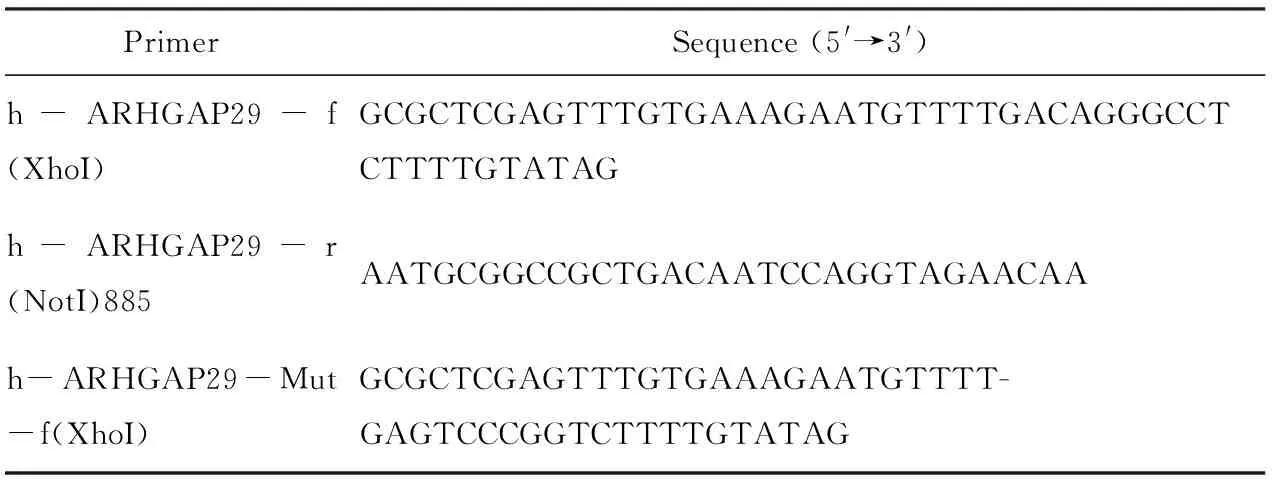
表1 双荧光素酶报告基因载体引物序列Tab.1 Primer sequence of the Dual Luciferase Reporter
1.2.3 细胞转染
接种:取对数生长期的293T细胞,接种于96孔板中,每孔1.5×104个细胞,每孔总体积100 μL,于37 ℃ 培养箱中培养24 h。 混合:采用OPTI-MEM培养基分别稀释hsa-miR-1291 mimic及NC、野生型载体ARHGAP29-WT 3′UTR pmiR-RB-Report及突变型载体ARHGAP29-MUT 3′UTR pmiR-RB-Report、LipofectamineTM2000试剂,静置20 min。转染:取50 μL混合液分别共转染于含50 μL培养基的293T细胞中,共分为4组:h-ARHGAP29-WT+hsa-miR-1291组、h-ARHGAP29-WT+NC组、h-ARHGAP29-MUT+hsa-miR-1291组、h-ARHGAP29-MUT+阴性对照(non-target control,NC)组,每组设3个复孔(n=3),最终每孔总体积100 μL。6 h后再加100 μL新鲜培养基。
1.2.4 荧光素酶活性测定
转染48 h后吸出培养基, 以35 μL/孔加入1× PBS,每孔加入35 μL Luciferase底物与Luciferase buffer混合液,振荡10 min,转移至LUMITRACTM200 96孔白色细胞培养板中,分光光度计测定荧光值。加入30 μL中止液,振荡10 min,分光光度计测定荧光值。
1.3 统计学方法
2 结果
2.1 载体骨架的构建
选择海肾荧光素酶基因(hRluc)为报告荧光,萤火虫荧光素酶基因(hluc)为校正荧光,构建3′UTR双荧光素酶载体骨架,骨架大小为6.3 kb,详见图1。
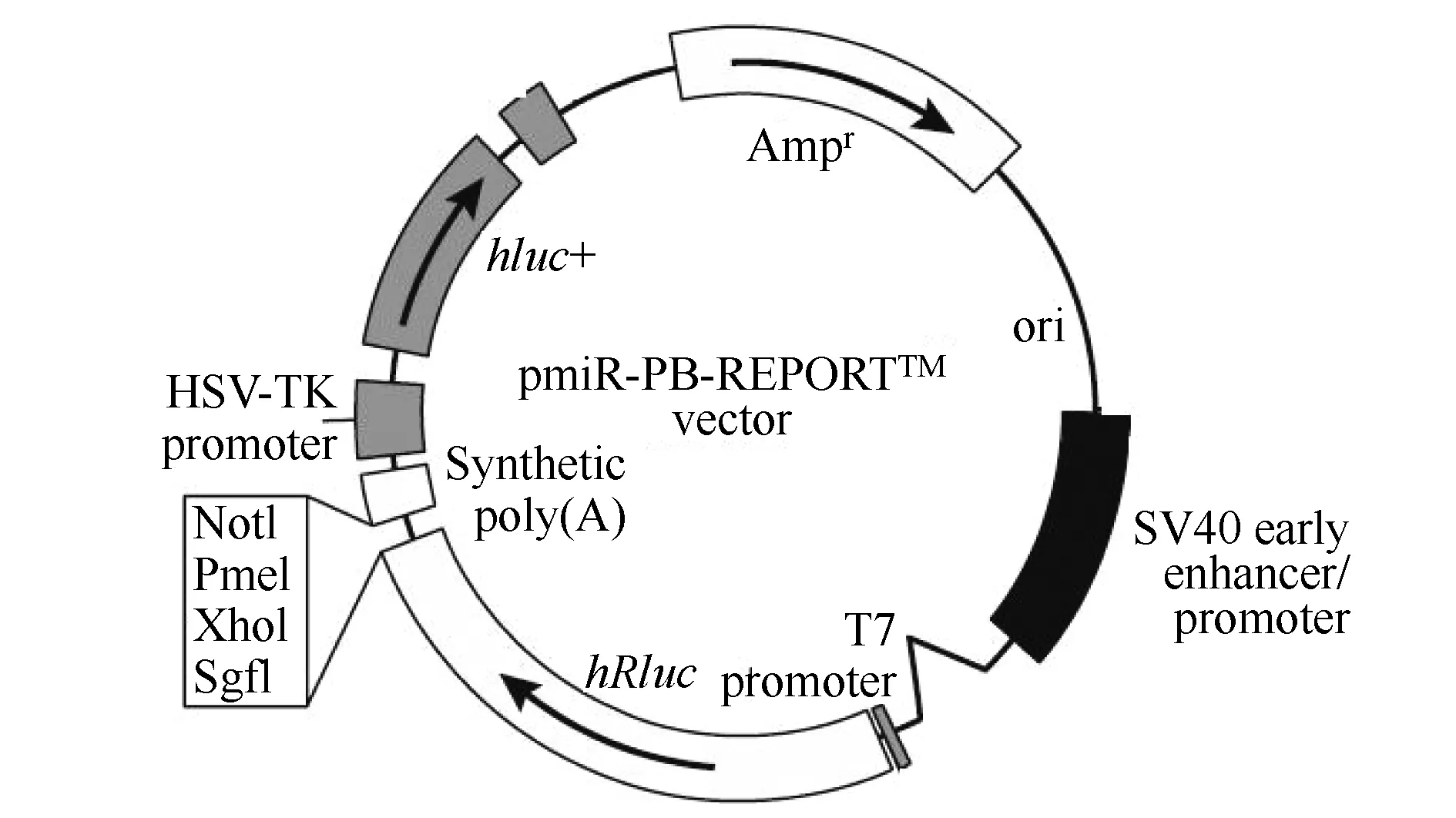
图1 双荧光素酶载体骨架(pmiR-RB-ReportTM)Fig.1 Vector frame of dual luciferase reporter system (pmiR-RB-ReportTM)hRluc:renilla luciferase; hluc: firefly luciferase.
2.2 测序分析
对含有has-miR-1291基因结合位点的野生型序列及缺失has-miR-1291基因结合位点的突变型序列进行克隆测序,h-ARHGAP29(NM_004815.4 3′UTR: 61-945)-WT野生型包含:(81-87) CAGGGCC;h-ARHGAP29(NM_004815.4 3′UTR: 61-945)-MUT(81-87 CAGGGCC>GTCCCGG),野生型载体及突变型载体均构建成功,可用于后续靶点验证实验(图2、3)。
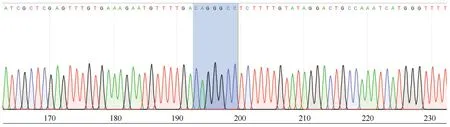
图2 荧光素酶报告载体 h-ARHGAP29-WT测序图Fig.2 Sequence diagram of luciferase reporter vector h-ARHGAP29-WT
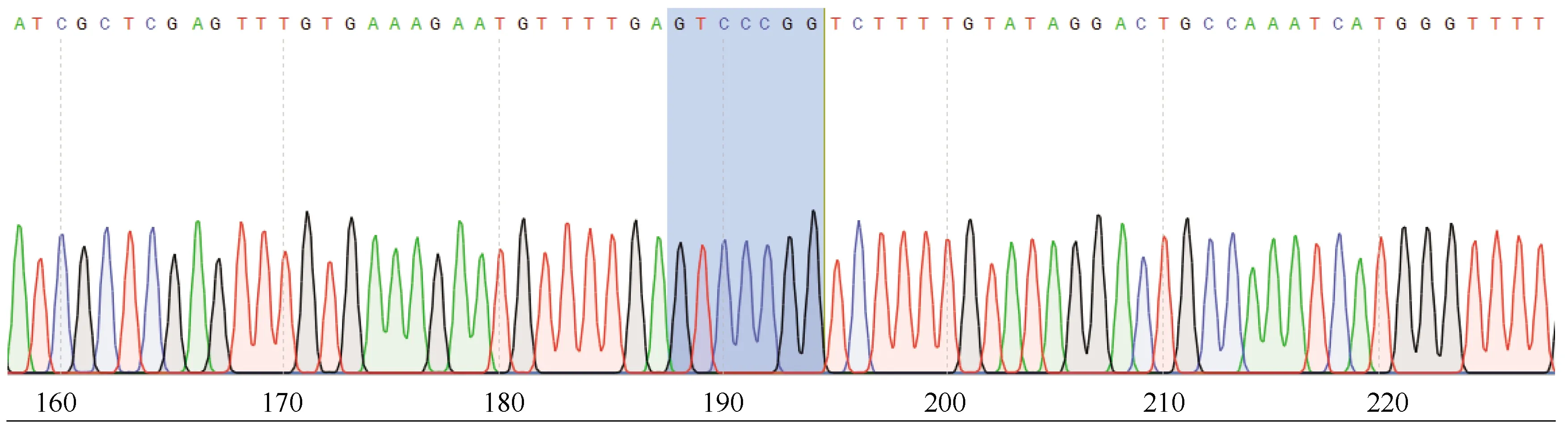
图3 荧光素酶报告载体h-ARHGAP29-MUT测序图(突变靶点序列81-87 CAGGGCC-GTCCCGG)Fig.3 Sequence diagram of luciferase reporter vector h-ARHGAP29-MUT (mutant target sequence 81-87 CAGGGCC-GTCCCGG)
2.3 荧光素酶活性分析
将hsa-miR-1291 mimic及NC分别同野生型载体共转染至工具细胞293T细胞,即h-ARHGAP29-WT+hsa-miR-1291组、h-ARHGAP29-WT+NC组,检测其相对荧光值分别为0.67±0.04及1.00±0.08。将hsa-miR-1291 mimic及NC分别同突变型载体共转染至工具细胞293T细胞,即h-ARHGAP29-MUT+hsa-miR-1291组、h-ARHGAP29-MUT+NC组,检测其相对荧光值为1.20±0.05及1.00±0.10。对各组荧光素酶检测结果分析显示,野生型载体转染hsa-miR-1291 mimic后,其荧光表达较NC组明显下降(0.67±0.04vs1.00±0.08,P=0.014);转染hsa-miR-1291 mimic后,突变型载体的荧光表达相对于野生型载体的荧光表达有所上升(1.20±0.05vs0.67±0.04,P<0.001),详见图4。
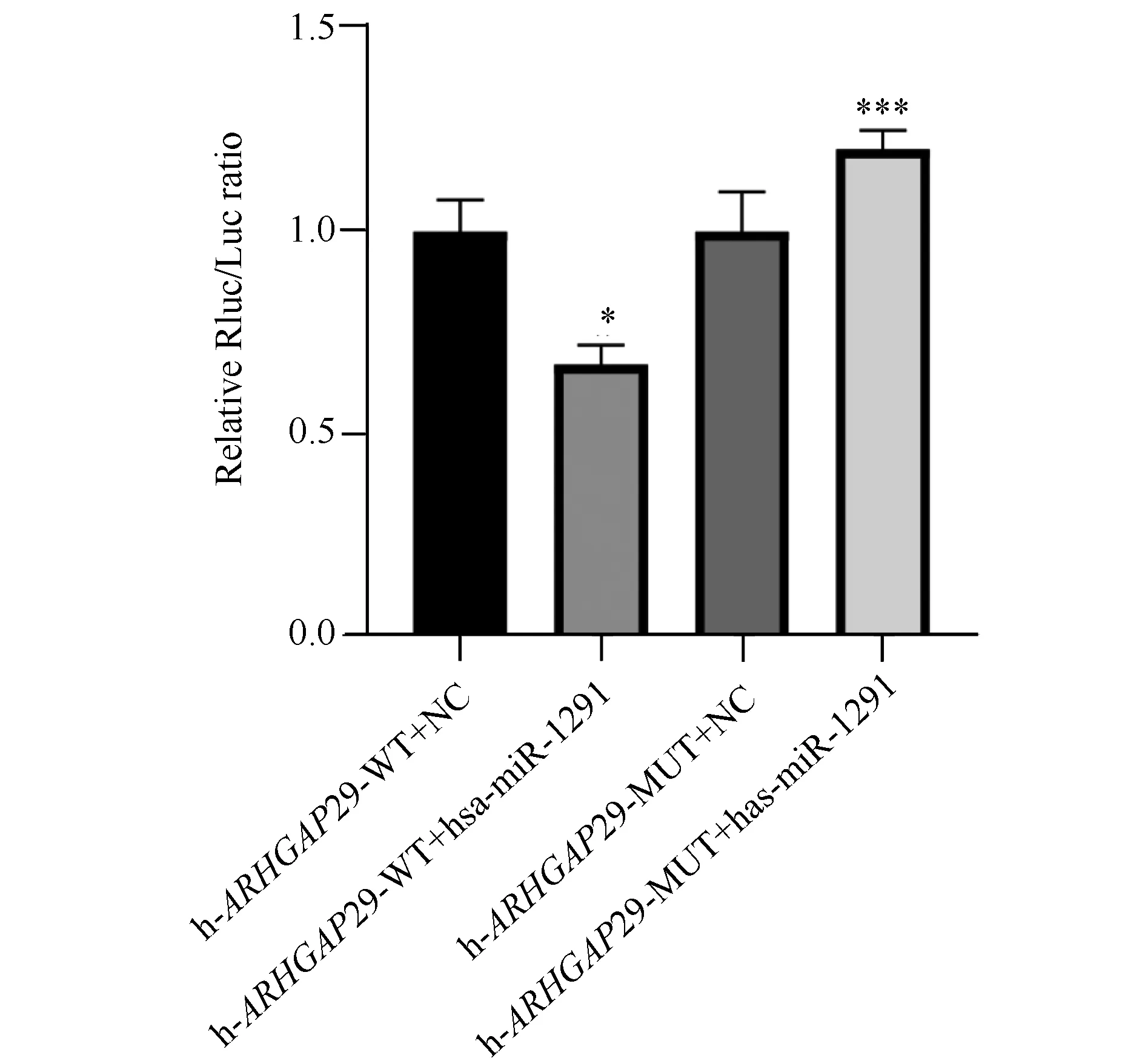
图4 相对荧光值表达(n=3)Fig.4 Relative fluorescence expression of different vector groups(n=3)*P<0.05 vs h-ARHGAP29-WT+NC group, ***P<0.001 vs h-ARHGAP29-WT+ hsa-miR-1291 group. NC:non-target control.
3 讨论
MicroRNA是长度为20~22个核苷酸的非编码单链RNA分子,能够通过互补序列和3′ UTR之间的核苷酸碱基配对在转录后水平抑制基因表达[1]。本研究组前期使用基因芯片技术,对宫腔粘连患者子宫内膜和非宫腔粘连患者子宫内膜组织中hsa-miR的差异表达进行检测,发现在宫腔粘连患者的子宫内膜中hsa-miR-1291水平显著升高[6]。研究[7-8]显示, miR-1291可具有多种功能,包括调节细胞药物反应及化学敏感性,以及通过特定靶基因来调节细胞增生和代谢。
通过GO分析、miRDB数据库及Targetscan软件,笔者预测ARHGAP29为hsa-miR-1291的负性调节靶基因。ArhGAP29是抑制Rho信号传导途径的特定类型RhoGTP酶活化蛋白,具有RhoA的GAP结构域,同RhoA具有很强的亲和力,是RhoA的关键调节因子,可使RhoA由三磷酸鸟苷(guanosine triphosphate,GTP)限制型转变为二磷酸鸟苷(guanosine diphosphate,GDP)限制型而失活,进一步影响下游效应分子,其对细胞骨架及细胞迁移、侵袭的影响已在多种疾病细胞系中得以证实[9-10]。
RhoA是小G蛋白超家族中的一个成员,具有GTP酶活性,是细胞表面受体同胞内多种信号蛋白的中介,参与多种信号通路调控,其中,Rho相关蛋白激酶(Rho-associated coiled-coil containing protein kinases,RhoA/ROCK)信号通路涉及多种纤维化疾病的调控,在肺、肾、心血管和肝脏纤维病变中被广泛研究[11-13]。目前研究[14]显示,宫腔粘连的重要病变机制为子宫内膜纤维化改变,笔者推测,ArhGAP29的降低可能导致RhoA被激活,影响下游效应分子ROCK,调节细胞动力学和肌动蛋白细胞骨架,进而影响细胞分裂及细胞周期,改变上皮细胞极性的稳定性,参与子宫内膜纤维化过程的调控。ArhGAP29可以通过同相关蛋白结合,蛋白移位以及多聚体的形成等方式,抑制Rho信号通路,促进应力纤维形成,增强内皮细胞的屏障功能,改变细胞骨架结构[15-16],这可能是ArhGAP29 在纤维化过程中发挥作用的机制之一。ArhGAP29作为分子开关在胞内信号转导以及肌动蛋白细胞骨架调控中发挥重要桥梁作用,因此有可能成为子宫内膜纤维化的调节靶点之一。
宫腔粘连内膜病变中hsa-miR-1291及其预测靶基因ARHGAP29的发现,为阐明宫腔粘连子宫内膜纤维化打开了新的视角。本研究确定了hsa-miR-1291同ARHGAP29基因的靶向调控关系,为进一步研究其在子宫内膜纤维化病变机制中的作用奠定了基础。MiR-1291是否有可能成为宫腔粘连的分子标志物,其靶基因ARHGAP29能否成为宫腔粘连的治疗靶点,通过调节肌动蛋白细胞骨架重构及改变细胞迁移能力,逆转和阻断子宫内膜纤维化病变的发展,值得进一步深入研究。
