BOLD MRI评价糖尿病患者尿微量白蛋白及氧合水平的研究
2021-02-03郑爽爽高志远宋双双何悦明
郑爽爽 高志远 宋双双 何悦明 卢 洁,4*
(1. 首都医科大学宣武医院放射科,北京 100053; 2. 首都医科大学附属复兴医院放射科,北京 100038; 3. 首都医科大学宣武医院核医学科,北京 100053; 4. 磁共振成像脑信息学北京市重点实验室,北京 100053)
近年来我国糖尿病(diabetes mellitus,DM)患病率逐渐增加,且呈年轻化趋势。流行病学研究[1]表明,我国约1.1亿人患有糖尿病,是世界上糖尿病患病率上升最快的国家之一,且患病率可能会进一步上升。糖尿病肾病(diabetic nephropathy,DN)是糖尿病最常见的并发症,也是糖尿病患者死亡的重要原因[2-3]。血氧水平依赖磁共振成像(blood oxygen level-dependent magnetic resonance imaging,BOLD MRI)技术是目前唯一能够活体内无创检测肾脏血氧含量的影像技术[4-5]。随着磁共振软硬件的不断升级,肾脏BOLD MRI在糖尿病中应用的研究逐步增多,但关于尿微量白蛋白浓度与肾脏氧合关系的报道较少。本研究通过BOLD MRI技术对2型糖尿病患者的肾脏进行扫描,测量不同尿微量白蛋白与尿肌酐比值(the ratio of urinary albumin and creatinine,ACR)和肾脏皮质、髓质的表观自旋-自旋弛豫率(apparent relaxation rate,R2*)值,分析尿微量白蛋白不同阶段的肾脏氧合变化情况。
1 对象与方法
1.1 研究对象
收集首都医科大学宣武医院2型糖尿病患者及健康对照者。入组研究对象共58例,其中男性32例(55.2%),女性26例(44.8%),平均年龄(60.64±8.9)岁。2型糖尿病组(DM组)44例,平均年龄(60.68±9.1)岁;健康对照组(NC组)14例,平均年龄(60.50±8.5)岁;糖尿病组和健康对照组年龄差异无统计学意义。糖尿病组又根据ACR分为ACR正常糖尿病组(DM1组)共22例,早期糖尿病肾病组(DM2组)共10例,临床糖尿病肾病组(DM3组)共12例。
糖尿病诊断标准:符合1999年WHO糖尿病分型和诊断标准[6];糖尿病肾病诊断标准[7]:早期糖尿病肾病:ACR为30~300 mg/g,临床糖尿病肾病:ACR>300 mg/g。ACR正常糖尿病:糖尿病患者,ACR<30 mg/g。对照组:排除糖尿病,ACR<30 mg/g。
排除标准:1型DM患者;高血压患者;伴有酮症酸中毒的2型DM患者;有原发性肾脏疾病(肾脏肿瘤、慢性肾炎、单侧肾等)的2型DM患者;存在泌尿系梗阻,合并泌尿系感染者;严重心功能不全者,有代谢性疾病史患者,患发热性疾病及应激者等。所有受试者均知情同意,自愿参加。
1.2 检查方法
磁共振扫描在美国通用电气公司的Signa 1.5T磁共振扫描仪上进行,标准TORSOPA线圈采集信号,扫描参数:冠状面T2WI,采用SE序列,TR:7 500 ms,TE:85 ms,FOV:36 cm×36 cm,NEX:4,层厚:5 mm,间隔:1.0 mm,矩阵:320×192,层数:14~18;冠状面T1WI,采用FSPGR序列,TR:150 ms,TE:4.2 ms,层厚:5 mm,间隔:1.0 mm,矩阵:320×192,层数:14~18; T2*MAP扫描(BOLD MRI):采用EPI序列,TR:100 ms,TE:3.1 ms,FOV:36 cm,NEX:1,层厚:5 mm,间隔:1.0 mm,矩阵:192×256,层数:5,每层16幅图像;肾脏BOLD MRI扫描前需空腹10 h以上,扫描期间受试者屏气,于呼气末屏气扫描。
1.3 图像后处理
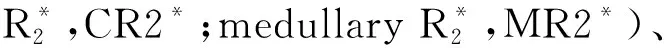

图1 肾脏皮、髓质ROI的选取Fig.1 Selection of renal cortex and medulla ROIA: The green area in R2* image is the medulla ROI; B: The green area in T2* image is the cortical ROI; ROI: region of interest.
1.4 统计学方法
使用IBM SPSS Statistics 21.0软件进行统计学分析;对DM组和NC组比较采用两独立样本t检验分析,对DM各组患者与正常对照组的肾脏CR2*、MR2*值进行单因素方差分析或秩和检验分析(若方差齐则采用单因素方差分析,若方差不齐则采用秩和检验),组间两两比较采用Bonferroni检验分析;采用受试者工作特征(receiver operating characteristic,ROC)曲线分析MR2*、MCR的诊断效能,统计阈值概率设定为P<0.05,检验糖尿病组与正常对照组间以及各亚组间差异有无统计学意义。
2 结果
2.1 两组受试者肾脏BOLD图像
14例对照组受试者肾脏BOLD图像肾脏皮质、髓质分界清晰(图2),肾脏T2*MAP上,肾脏结构清楚,皮质、髓质分界清晰。R2*图像髓质呈高信号,皮质低信号,T2*图像与之相反。R2*伪彩图皮质呈蓝色,髓质越近肾门区色彩就越接近红色。44例糖尿病组患者BOLD图像肾脏皮质、髓质分界欠清晰(图3)。
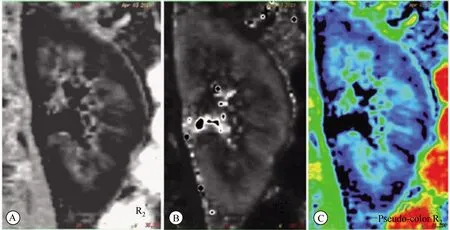
图2 对照组肾脏BOLD图像Fig.2 BOLD images of kidneys in healthy volunteers The demarcation of the kidney cortex and medulla is clear. A and B are R2* and T2* images respectively, and C is a pseudo-color R2* image. BOLD: blood oxygenation level dependent.
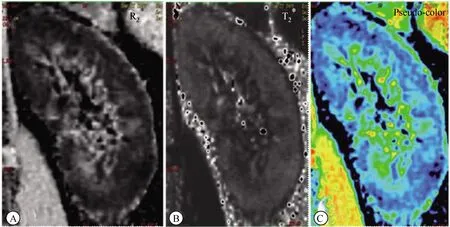
图3 糖尿病组患者肾脏BOLD图像 Fig.3 BOLD image of kidney in diabetic patients The demarcation of the kidney cortex and medulla is slightly less clear.A and B are R2 * and T2 * images respectively, and C is a pseudo-color R2* image. BOLD: blood oxygenation level dependent.
2.2 DM组与NC组的MR2*、CR2*、MCR值比较
44例DM组和14例NC组的MR2*值均高于CR2*值(P值均<0.001)。DM组较NC组的MR2*值(P=0.001)和MCR(P=0.013)明显升高,两者差异有统计学意义,详见表1。与正常对照组比较,DM1组的MR2*(P=0.015)、DM3组的MR2*(P=0.023)明显升高,差异有统计学意义;CR2*差异无统计学意义。其他各组两两比较,各参考值差异均无统计学意义,详见表2。
表1 DM组与NC组的MR2*、CR2*、MCR值比较Tab.1 Comparison of MR2*, CR2* and MCR values between DM group and NC group

表2 不同糖尿病组与NC组的MR2*、CR2*值比较Tab.2 Comparison of MR2* and CR2* values of different group
2.3 DM组的ROC曲线分析
44例DM组MR2*的ROC曲线下面积为0.791,最佳诊断阈值为15.99 ms-1,灵敏度与特异度分别为72.7%及78.6%;MCR的ROC曲线下面积为0.719,最佳诊断阈值为1.427,对应的灵敏度与特异度分别为70.5%及71.4%(图4)。
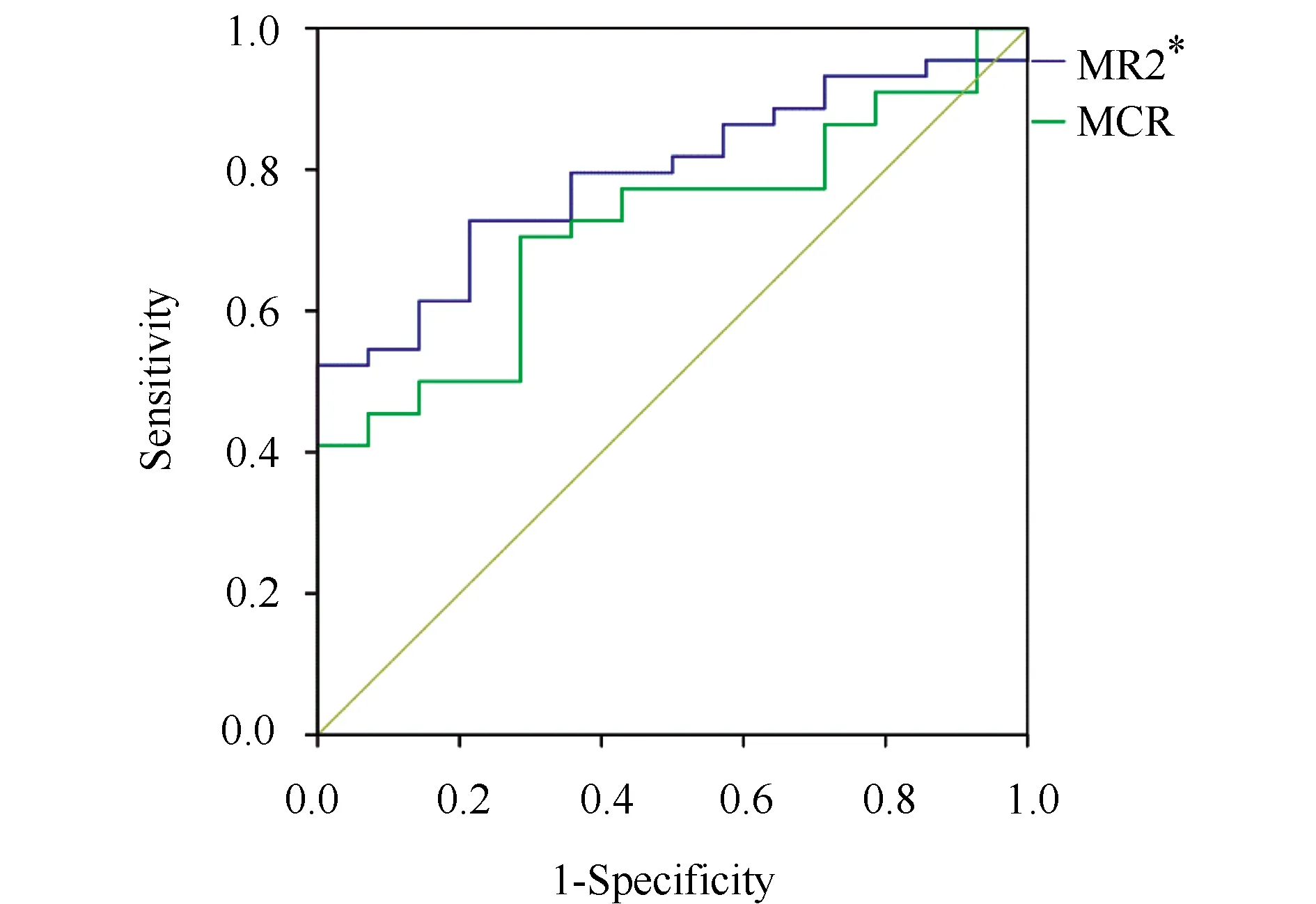
图4 关于MR2*、MCR值诊断糖尿病的ROC分析Fig.4 Analysis of receiver operating characteristics of MR2*, MCR values for diabetic diagnosisMR2*: medullary R2*; MCR: R2* ratio between medulla and cortex; ROC: receiver operating characteristic.
2.4 MR2*、CR2*、MCR值与临床指标的相关性分析
糖尿病组和对照组的ACR、估算肾小球滤过率(estimated glomerular filtration rate,eGFR)、糖化血红蛋白(glycated hemoglobin,HbA1c)、MR2*、CR2*和MCR值如表3所示。
表3 DM组与NC组的生化指标与MR2*、CR2*、MCR值Tab.3 The values of parameters and MR2*,CR2* and MCR between DM group and NC group
MR2*与ACR呈显著正相关(r=0.409,P=0.006),MCR也与ACR呈显著正相关(r=0.322,P=0.033)。MR2*、MCR与eGFR、HbA1c均无显著相关(r=-0.166、0.107;-0.103、0.021,P=0.212、0.424;0.443、0.876);CR2*与ACR、eGFR、HbA1c均无显著相关(r=0.230、-0.130、0.160,P=0.133、0.332、0.231)。
3 讨论

3.1 肾脏髓质生理性缺氧表现
本研究中糖尿病组与正常对照组的MR2*值均高于CR2*值,提示髓质较皮质处于缺氧状态,这与肾脏的微结构及功能有关。生理情况下,肾脏是人体高灌注器官,髓质氧分压较低与其高代谢和供给血管的分布有关[10]。原尿滤过液中的葡萄糖在肾小管内被全部重吸收回血液,部位主要位于近端小管,而位于外髓质的近端小管中依赖Na+-K+-ATP酶的Na+-葡萄糖协同转运体对葡萄糖进行重吸收,此过程耗氧较多,因而髓质氧分压低[11]。直小管内氧的逆流扩散作用和髓袢升支粗段高频率的离子主动转运亦使髓质氧分压降低[12]。
3.2 ACR不同阶段DM患者肾髓质的氧合状态
本研究显示,DM1组较NC组MR2*值明显增加,表明此阶段糖尿病患者ACR虽处于正常范围,但肾髓质已出现缺氧改变。这可能是因为糖尿病早期肾脏处于高滤过、高度重吸收、高耗氧的代谢状态,肾髓质因离子重吸收增多,引起耗氧量增加,导致髓质功能性缺氧,这也是糖尿病肾病发生和发展的重要机制[11,13-15]。Wang等[16]观察链霉素诱导的糖尿病鼠模型,发现早期DM组在出现微量白蛋白尿之前MR2*值已升高。由此可见,MR2*值不仅反映了肾髓质缺氧状态,而且可监测糖尿病早期肾脏功能变化。DM2组较NC组MR2*值增加,但差异无统计学意义,这可能与入组糖尿病患者病程时间差异大,此阶段肾脏基底膜增厚和系膜基质增加明显,肾小球小动脉出现病变,部分肾小球功能已丧失,肾脏的高滤过、高代谢状态有所缓解有关。DM3组较NC组MR2*值明显增加,与部分研究[17-18]结果相似,但与Wang等[19]结论相反;DM3组较DM1组、DM2组患者MR2*值略有增加,提示大量白蛋白尿期肾脏氧合最低。临床糖尿病肾病患者MR2*值升高的可能原因:(1)与血管活性物质失衡后氧化应激反应增多有关;有研究[20]证实血管活性物质激活可改变肾脏血氧含量,例如血管紧张素转换酶抑制剂可使高血压慢性肾病患者的肾脏氧合增加,可疑肾动脉狭窄患者经β-阻断剂慢性治疗后可改善肾髓质氧合[21]。(2)糖尿病肾病晚期肾脏血流重新分布、微血管病变引起肾脏血供减少,引起肾脏相对缺氧,或是部分肾单位功能缺失导致残存肾单位在相对高滤过状态下氧耗增加[22-23]。(3)DN后期肾小球硬化和间质纤维化改变了微循环并使氧的扩散受阻[24]。
3.3 ACR不同阶段DM患者肾皮质的氧合状态
本研究中DM各组间较NC组CR2*略有升高,提示各组间肾皮质氧合略有减低,差异较小。一方面是因肾皮、髓质的血流灌注异质性很大,几乎流经肾脏的血液均灌注至肾皮质[10],故皮质的氧供大于氧耗,皮质处于相对较高的氧合状态。另一方面,在血红蛋白氧解离曲线中,髓质氧分压约20 mmHg(1 mmHg=0.13 kPa),处于快速上升阶段,而皮质氧分压约50 mmHg,处于缓慢上升阶段,因此,皮质氧分压改变较大时,才能引起脱氧血红蛋白浓度有明显变化而被BOLD MRI显示。此外,也可能与DN中晚期时皮质对缺氧损伤耐受性好有关[19]。
3.4 ACR与MR2*的相关性
本研究中ACR与MR2*呈正相关,提示尿微量白蛋白越多,MR2*越高,髓质缺氧越严重,既往ACR与MR2*相关性的研究未见明确报道;eGFR、HbA1c均与MR2*无显著相关性,与部分文献[25]结果一致,而有研究[17]报道MR2*值与eGFR呈正相关,认为eGFR增高,加重肾小管主动重吸收负担,引起髓质耗氧增加。MR2*与临床实验室指标的相关性研究结果不完全一致,这可能与选取患者分期不同有关,另外影响R2*值的多因素也使血氧水平结果不确定[5]。
总之,本研究表明BOLD MRI不仅可以无创评估糖尿病患者ACR不同阶段的肾脏氧合水平,而且能监测糖尿病患者早期肾脏髓质的功能性缺氧改变,为临床早期诊断、治疗及预后评估提供依据,具有重要临床应用价值。
