一株伯克霍尔德菌的鉴定及其对木质素的降解特性研究*
2021-02-01马英辉李利军卢美欢仝泽方吴文朋
马英辉 李利军 卢美欢 仝泽方 吴文朋
(1.陕西省微生物研究所,陕西 西安 710043;2.西北农林科技大学资源环境学院,农业农村部西北植物营养与农业环境重点实验室,陕西 杨陵 712100)
木质素是由愈创木基、紫丁香基和对羟基苯丙烷3种单体通过醚键和碳碳键构成的有机聚合物,是构成木质纤维素的主要组分之一,在植物抵御外界入侵的过程中起到重要作用。由于木质素的难降解性,造成了木质纤维素资源不能得到充分利用[1]、造纸过程中形成大量的黑液[2]等问题。微生物对木质素的降解一直是国内外研究人员持续研究的热点,以往对木质素降解的研究主要集中在白腐真菌上[3],而由于细菌生长快速、易于大规模培养以及多底物利用等优点,细菌对木质素的降解也被广泛关注[4]。目前,已有很多文献研究了细菌对木质素的降解,主要涉及鞘氨醇单胞菌(Sphingomonaspaucimobilis)[5]、地衣芽孢杆菌(Bacilluslicheniformis)[6]、嗜热菌(Bacillusthermophilus)[7]、丛毛单胞菌(Comamonassp.)[8]、根瘤菌(Rhizobiumsp.)[9]等。
伯克霍尔德菌(Burkholderiasp.)是一种广泛存在于水、土壤、植物和人体中的革兰氏阴性细菌,其在环境污染物处理中的作用已有报道[10]。先前的研究已证实伯克霍尔德菌存在胞内类漆酶基因[11]751,但其对木质素的降解特性研究仍相对较少。本研究通过苯胺蓝和碱性木质素平板从陕西省某造纸厂污水底泥中筛选一株伯克霍尔德菌(记为菌株BNS),利用Biolog和16S rRNA对菌株BNS进行鉴定,并对其木质素降解特性进行研究,结果对于阐明伯克霍尔德菌降解木质素的代谢途径提供基础数据。
1 材料与方法
1.1 实验材料
1.1.1 菌种来源
从陕西省某造纸厂污水中过滤提取一定底泥用冰盒冷藏,通过苯胺蓝、碱性木质素平板法从底泥中富集筛选获得一株木质素降解菌,记为菌株BNS。
1.1.2 培养基
无机盐(MM)培养基:NH4NO32 g,KH2PO40.5 g,Na2HPO40.5 g,MgSO4·7H2O 0.3 g,微量元素液2 mL,制霉菌素(纯度≥98%)0.1 g,去离子水定容至1 000 mL,pH 7.0。微量元素液:FeSO4·7H2O 0.5 g,MnSO4·H2O 0.15 g,ZnSO40.14 g,CoCl20.2 g,去离子水定容至1 000 mL。
种子培养基:LB液体培养基。
无特殊说明,所用试剂均为分析纯。
1.1.3 主要仪器
DHP-300型恒温培养箱,DHZ-DA型恒温摇床,ABI 2720型聚合酶链式反应(PCR)仪,UV9001型紫外分光光度计,6700F型电子扫描显微镜(SEM),ALPHA型红外光谱(IR)仪,TGL-18MS冷冻离心机,7890B-7010B型气相色谱(GC)/质谱(MS)联用仪,全自动微生物鉴定仪(美国Biolog)。
1.2 实验方法
1.2.1 菌株BNS的生理生化及分子鉴定
将提取的菌株BNS接种于LB液体培养基中,30 ℃、160 r/min下摇瓶活化12 h,得到菌株BNS种子液。取10 mL种子液,在12 000 r/min离心5 min,用无菌去离子水冲洗3次,根据全自动微生物鉴定仪的要求制备IF-A菌悬液。IF-A菌悬液浊度控制在90%~98%,利用8排自动移液器加入到GenⅢ96孔板中,每孔加入120 μL,30 ℃下静置培养24 h,用于菌株BNS碳源与化学因子代谢的读板分析。
利用Ezup柱式细菌基因组DNA抽提试剂盒对菌株BNS进行DNA提取,采用16S rRNA通用引物(5’-AGTTTGATCMTGGCTCAG-3’,5’-GGTTACCTTGTTACGACTT-3’)进行PCR扩增(94 ℃预变性4 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,循环30次;72 ℃延伸10 min;4 ℃终止反应),对扩增产物进行测序。在美国国立生物技术信息中心(NCBI)中进行Blast序列比对后,利用MAGE 5.0软件采用Neighbor-Joining法构建系统进化树。
1.2.2 菌株BNS降解碱性木质素的影响因素分析
将菌株BNS种子液按0.5%(体积分数,下同)接入含1 000 mg/L碱性木质素的MM培养基中,160 r/min、35 ℃摇床培养60 h。培养过程中,通过调节培养温度(20、25、30、35、40、45 ℃)、pH(4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0)及添加金属离子(Cu2+、Fe2+、Zn2+、Mn2+,添加量均为0.5 mmol/L),测定碱性木质素降解率变化,分析各因素对菌株BNS降解碱性木质素的影响。
1.2.3 菌株BNS降解碱性木质素的动力学研究
向MM培养基中分别加入碱性木质素100、500、1 000、2 000 mg/L,接入0.5%菌株BNS种子液,在pH 9.0、30 ℃、160 r/min下摇床培养84 h,每隔6 h进行碱性木质素降解率的测定。
采用一级反应动力学对降解数据进行拟合[12],计算见式(1):
lnSt=-Ks×t+lnS0
(1)
式中:St为t时刻碱性木质素的质量浓度,mg/L;Ks为一级降解速率常数,h-1;t为降解时间,h;S0为碱性木质素的初始质量浓度,mg/L。
1.2.4 菌株BNS降解碱性木质素的产物分析
对于碱性木质素为1 000 mg/L的降解体系,分别在培养24、48、72 h取10 mL培养液,4 ℃、12 000 r/min 离心5 min,取上清液用6 mol/L的盐酸调pH为2.0,用等体积乙酸乙酯萃取3次,合并有机相,加入无水硫酸钠干燥,旋转蒸发浓缩至0.5 mL,加入0.1 mL的N,O-双(三甲基硅烷基)乙酰胺,60 ℃水浴30 min后用于GC/MS检测分析。GC参数:DB-5气相色谱柱,载气为高纯氮气,恒流1.0 mL/min,进样体积为1.0 μL,升温程序为60 ℃保持1 min,以10 ℃/min升至160 ℃,保持5 min,以10 ℃/min升至200 ℃,保持5 min,以15 ℃/min升至280 ℃,保持5 min。MS参数:电子轰击(EI)电离源,电子能量为70 eV,离子源温度230 ℃,连接杆温度150 ℃,扫描方式为全扫描。
1.3 检测方法
生物量采用烘干法测定,以每升培养液中生物干质量计。采用SEM及IR对菌株BNS降解前后碱性木质素的表面结构及官能团变化进行检测分析。
2 结果与讨论
2.1 菌株BNS的遗传鉴定
以菌株BNS总DNA为模板,采用通用引物进行PCR扩增,PCR产物测序后获得1 394个碱基,并在NCBI中进行Blast比对,该菌株16S rRNA序列与洋葱伯克霍尔德菌(Burkholderiacepacia)相似性达到98%,并根据菌株同源性,选择了部分模式菌株进行基于16S rRNA的系统进化树构建。由图1可见,菌株BNS与洋葱伯克霍尔德菌ATCC 25416进化距离接近,并将该菌株提交GenBank,登录号为KY681449.1。根据全自动微生物鉴定仪的读板分析结果,菌株BNS底物广泛,能够利用多种常规碳源和有机酸进行生长,且对洁霉素、四环素、利福霉素、万古霉素以及NaCl等表现出了较强的耐受性,在恶劣环境下具有重要的应用价值。
2.2 菌株BNS降解碱性木质素的影响因素
温度、pH、金属离子对菌株BNS降解碱性木质素的影响见图2。从图2可以看出,温度、pH对菌株BNS降解碱性木质素的影响较大,而添加金属离子对菌株BNS降解碱性木质素的影响相对较小,这是因为温度、pH主要影响菌株自身的生长情况,而金属离子影响的是菌株相关代谢产物的形成及活性[13-14]。由图2(a)可知,在温度为30~40 ℃时,碱性木质素的降解率基本保持稳定,30 ℃时降解率最高,为52.30%。由图2(b)可知,在pH为6.0~10.0时,碱性木质素降解率差异不明显,说明该pH环境适宜菌株BNS生长,其中pH为9.0时碱性木质素降解率最高,为53.88%。在微生物降解体系中加入适量金属离子能够显著增加相关酶的活力[15-16],由图2(c)可知,本次研究中0.5 mmol/L的Cu2+、Fe2+都能提高菌株BNS对碱性木质素的降解率,其中Cu2+可使碱性木质素降解率提高近7.0百分点,这是因为Cu2+能够提高菌株BNS中的漆酶活性[11]752,同理Fe2+也可能增强某种木质素降解酶活性从而提高了菌株BNS对碱性木质素的降解。
2.3 菌株BNS降解碱性木质素的动力学
碱性木质素初始质量浓度分别为100、500、1 000、2 000 mg/L时,菌株BNS连续培养84 h的碱性木质素降解率变化见图3。由图3可知,碱性木质素的降解率随着底物初始浓度的增大而降低,且初始浓度越低,菌株生长的适应期越短,降解率达到稳定的时间越短,这与汪旭晖等[17]采用Logistic模型拟合的氨氮降解动力学相同。初始质量浓度为100 mg/L时,碱性木质素在48 h降解率趋于稳定,达到78.7%;初始质量浓度为500、1 000 mg/L时,碱性木质素在60 h降解率趋于稳定,分别为63.1%、47.2%;初始质量浓度为2 000 mg/L时,碱性木质素降解率一直处于缓慢上升的趋势,84 h时降解率为39.26%。
对碱性木质素的降解过程进行一级动力学模型拟合,结果见表1。碱性木质素初始质量浓度为100、500、1 000、2 000 mg/L时,拟合模型的相关性系数分别0.937 2、0.939 0、0.915 2、0.975 9,拟合程度较好,说明菌株BNS对100~2 000 mg/L碱性木质素的降解符合一级动力学反应,降解速率常数分别为0.027 3、0.016 6、0.010 6、0.006 5 h-1,菌株BNS对碱性木质素的降解速率随着底物初始浓度的增大而减小。
2.4 碱性木质素的SEM和IR分析
菌株BNS降解前后碱性木质素的微观形貌见图4。可以看出,降解前碱性木质素结构比较致密,表面呈聚合状态,而经过菌株BNS降解后,碱性木质素表面结构崩解断裂,呈疏松的颗粒状。对比可知,菌株BNS能够对碱性木质素进行解聚,破坏其结构,裂解成颗粒状,这与张佩佩等[18]采用ComamonasserinivoransC35菌株降解木质素获得了类似的外观效果。

图1 菌株BNS 16S rRNA序列进化关系Fig.1 16S rRNA sequence evolution of strain
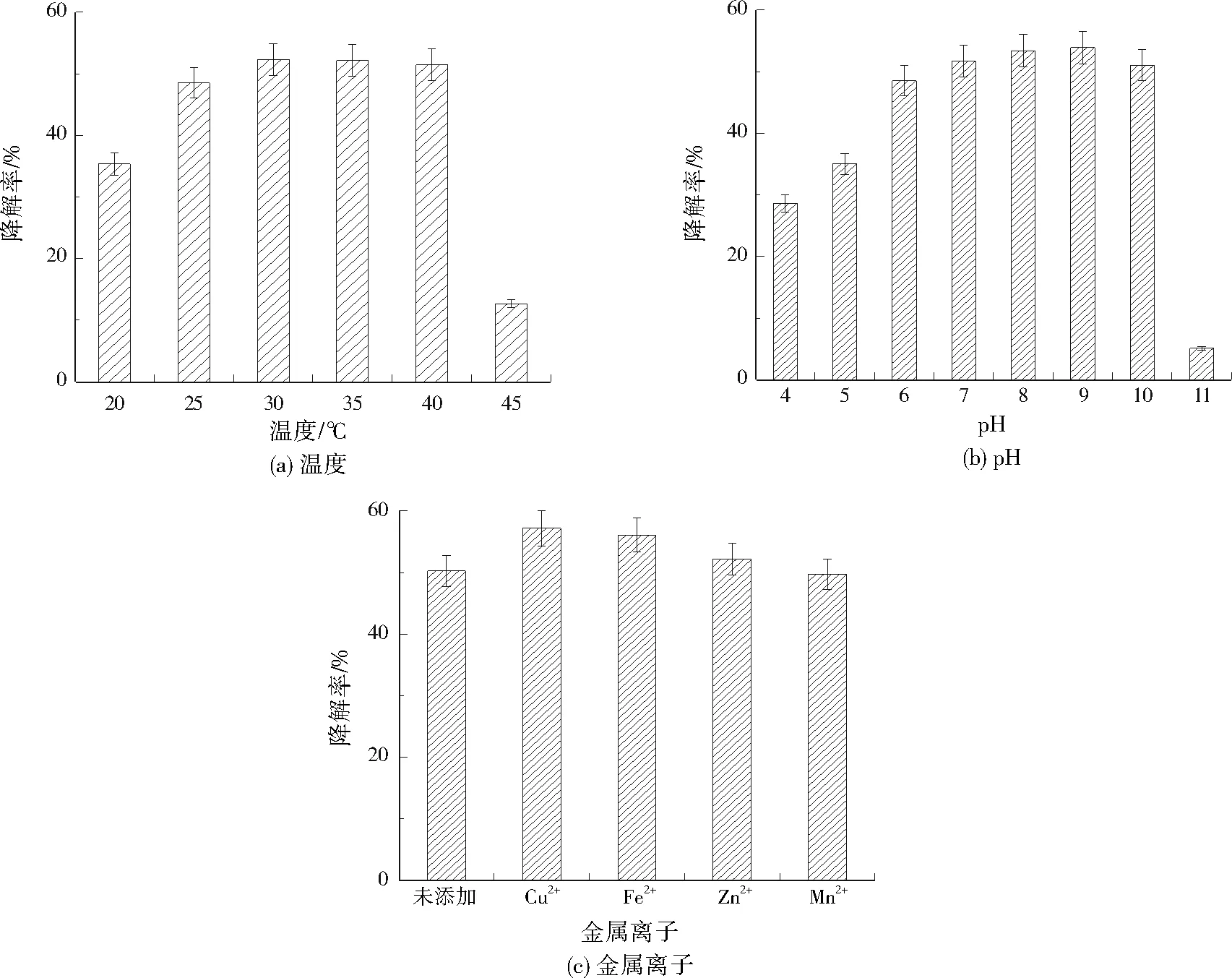
图2 温度、pH、金属离子对菌株BNS降解木质素的影响Fig.2 Effect of temperature,pH and metal ions on the degradation of lignin by strain BNS
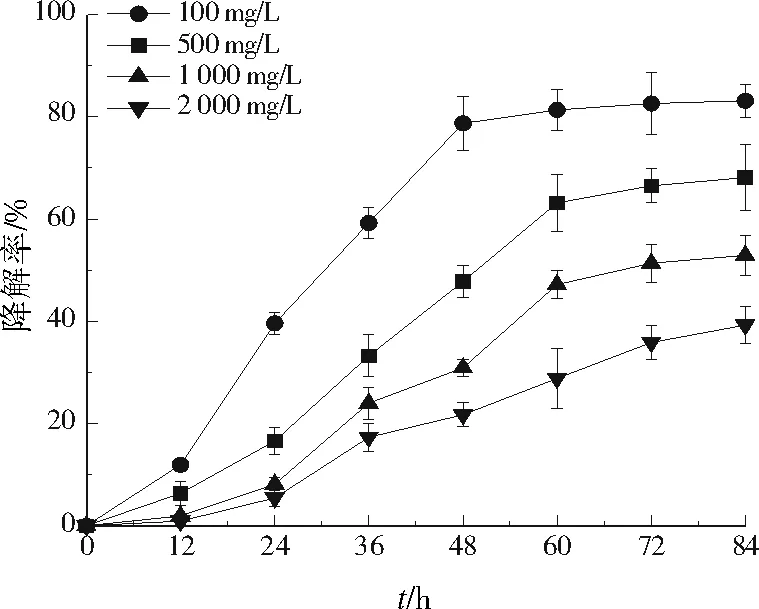
图3 菌株BNS对不同初始质量浓度碱性木质素的降解效果Fig.3 Degradation rates of alkaline lignin with different initial mass concentration by strain BNS
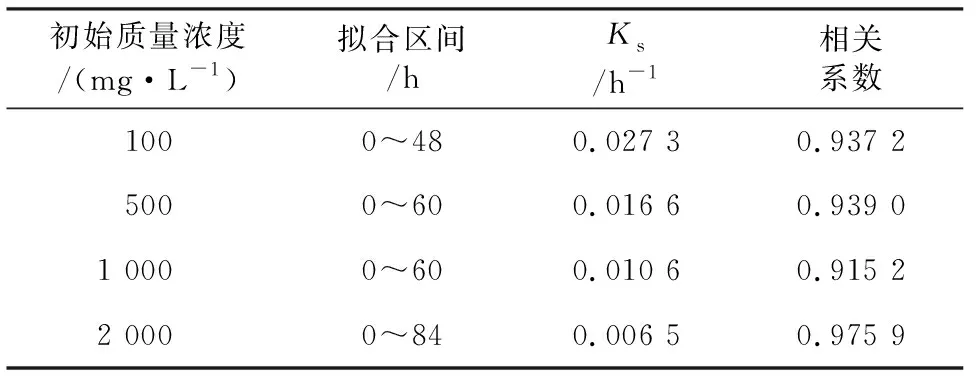
表1 菌株BNS对碱性木质素降解的动力学参数

图4 碱性木质素样品SEM图(×700倍)Fig.4 SEM photos of alkaline lignin samples
由图5可知,碱性木质素经过菌株BNS降解后,1 750、850 cm-1附近处有基团增加,1 560、1 400、1 340、1 100、1 050 cm-1处的基团明显减少,说明在菌株BNS的作用下,碱性木质素苯环骨架间的C=O、C—H、C—O—C键明显减少,苯环骨架的特征振动区域(1 400~1 600 cm-1)也明显减弱,苯环结构和以及一些侧链基团在降解过程中产生了一些变化和修饰[19]。另外,由于苯环骨架的开环,产物中增加了非共轭的羰基、酮基以及苯环之外的C—H基团,也使得产物的反应活性进一步提高,有利于产物进一步降解。

图5 降解前后碱性木质素的IR对比Fig.5 The IR spectrum of sodium lignosulfonate before and after degradation
2.5 碱性木质素降解中间产物分析
利用GC/MS对碱性木质素降解产物进行检测,结果见表2。在菌株BNS的作用下,碱性木质素由于解聚降解产生多种特征中间产物,随着降解的进行,中间产物逐渐被进一步降解产生了更小分子的物质。低分子量的醛和有机酸(香草醛、松伯醛、阿魏酸、香草酸等)等中间产物的产生,表明木质素β-芳基醚键和苯环间碳碳键的断裂[20],乙氧基的产生表明碱性木质素受到菌株过氧化物酶系的作用[21]。

表2 碱性木质素降解过程中产生的中间产物1)
3 结 论
(1) 菌株BNS属于伯克霍尔德氏菌属,与洋葱伯克霍尔德菌16S rRNA序列高度相似,属于洋葱伯克霍尔德菌或其亚种。
(2) 菌株BNS对碱性木质素的最佳降解温度为30 ℃、最佳pH为9.0,碱性木质素降解率最高可达53.88%,0.5 mmol/L的Cu2+、Fe2+能够提高菌株BNS对碱性木质素的降解;菌株BNS对100~2 000 mg/L碱性木质素的降解过程符合一级反应动力学方程,降解常数在0.006 5~0.027 3 h-1。
(3) 菌株BNS通过自身的过氧化物酶系将碱性木质素的聚合结构裂解,降解主要发生在苯环间的C—C、C—O—C等部位,最终降解产物主要为醛类和有机酸类。
