螺旋藻多糖对子宫内膜异位大鼠血清指标及PI3K/Akt/mTOR信号通路基因表达的影响
2021-02-01马浩天关思宇狄建兵李润植崔红利
王 猛,马浩天,关思宇,于 杰,狄建兵,王 愈,李润植*,崔红利*
1山西农业大学农学院分子农业与生物能源研究所;2山西农业大学食品科学与工程学院,太谷 030801
近年来,子宫内膜异位症(endometriosis,EMs)发病率明显增加。EMs指具有活性的子宫内膜组织出现在子宫腔被覆黏膜以外的部位[1]。EMs好发于育龄期妇女,可能与雌激素的过多分泌相关,其虽为良性病变,但呈局部浸润生长、好侵袭,妇科症状明显,治疗后容易多次复发,给女性身心健康带来极大危害。然而治疗EMs的方法却十分有限,除了外科手术之外,常用的内科治疗多为长时间使用孕激素类药物。随着治疗时间的延长,患者可出现各种副作用,如骨量流失、免疫系统失控和内分泌紊乱等[2]。因此,寻找一种新的无副作用的EMs治疗药物是迫在眉睫的。
天然产物具有丰富的生物学活性以及可作用于不同的生物靶点的优势,因而其开发利用领域取得了极大的进步。来源于黄花蒿的青蒿素是目前全世界治疗疟疾作为有效的手段,并已被用作免疫调节、抗炎和部分癌症药物等先导化学物[3]。红豆杉提取物也被用于治疗乳腺癌和卵巢癌,目前已成为化学抗肿瘤药物的研究重点[4]。在众多天然产物治疗疾病的研究中,我们发现来源于陆生植物及水生植物的其他提取物如儿茶素、白藜芦醇、虾青素等海藻提取物,都表现出多种治疗效果,如抗炎、抗菌抗肿瘤等[5]。因此,寻找有利于治疗子宫内膜异位症的天然大分子化合物,为药学库提供新的理论基础及药物资源的思路变得可行。Tang等[6]发现紫草提取物可以有效治疗EMs,并且显著影响异位内膜组织的炎性因子和凋亡基因活性;Zhang等[7]发现蠲痛饮可以有效缓解大鼠EMs症状;Liu等[8]发现藏红花素可通过抑制细胞增殖和炎性因子来改善EMs。
螺旋藻是开发较早的微藻产品,具有很高的市场知名度。螺旋藻多糖(polysaccharide fromSpirulina,PSP)是一类来源于原核生物螺旋藻,具有抗氧化、抗炎、抗菌、抗肿瘤、抗病毒等多重功效的天然生物大分子[13]。近年来,PSP因其不同于抗肿瘤活性常用药物的特点而被广泛研究。而目前已经有较多研究发现PSP可以通过作用于某些肿瘤信号通路上的分子达到调控下游基因表达的作用,Xu等[9]发现复合PSP抑制人类乳腺癌细胞的增殖。Yu等[10]研究PSP对宫颈癌细胞的影响发现,PSP可通过周期性阻滞而抑制Hela细胞的增殖。Sheng等[11]通过体外、体内实验证明,硫酸酯化的PSP对小鼠S180肉瘤有显著抑制作用。Chen等[12]研究表明,PSP通过提高免疫细胞活性来增强机体抗H22细胞能力。此外,大量的体外研究表明,PSP不仅可直接作用于某些肿瘤细胞,还可预防肿瘤患者在化疗和放疗时对细胞的损伤。因此我们推测PSP可以介导部分通路来缓解EMs的产生及增殖,但还未有任何天然多糖治疗EMs的研究报告,因此本课题拟基于PI3K/Akt/mTOR信号通路,探究PSP对子宫内膜异位症大鼠的治疗作用,为开发新型的EMs治疗方案和后续治疗药物提供新的选择。
1 材料与方法
1.1 实验材料
螺旋藻藻粉购买自福清市新大泽螺旋藻有限公司,并由本实验室保管,肿瘤坏死因子(tumour necrosis factor-α,TNF-α)和血管内皮生长因子(vascular endothelial growth factor,VEGF)试剂盒(南京建成);基质金属蛋白酶2(matrix metallopeptidase 2,MMP-2)试剂盒购自武汉华美。Trizol试剂(上海生工);PrimeScript RT试剂盒(Takara);1 TAE电泳buffer(Tris 4.84 g,Na2EDTA·2H2O 0.744 g,CH3COOH 1.142 mL,pH 8.5)、BCA蛋白试剂盒(南京建成);anti-PI3K、AKt、mTOR rabbit(Abcam)。
1.2 实验方法
1.2.1 PSP的制备及纯度鉴定
PSP的制备参照我们实验室已经发表的研究进行[13]。提取PSP后,使用Sephacryl S-100 HR为固定相装填中压特制玻璃层析柱(1.5 cm×60 cm)进行纯化。过柱时流动相为超纯水,以0.5 mL/min的流速洗脱。在过滤器浓缩后获得纯化的PSP。随后进行纯度、分子量的检测。使用苯酚-硫酸法检测PSP的总糖。按照Chen等[14,15]描述的方法,使用高效液相凝胶渗透色谱法(HPGPC)检测PSP的分子量。
1.2.2 大鼠EMs模型的制备
清洁级SD大鼠(无生育史)24只购自山西医科大学实验动物中心,8周龄,体重160±15 g。实验大鼠于标准条件下饲养在山西农业大学分子农业与生物能源研究所动物房的隔离笼中,适应性培养两周后开始实验。
采用自体异位种植术[16]构建大鼠模型。简要步骤如下:术前一天各组大鼠灌胃戊酸雌二醇,禁食不禁水6 h。种植术在超净工作台中进行,大鼠腹腔注射水合氯醛(5%,0.6 g/kg)麻醉,以镊子刺激足部无反射为麻醉成功标准。腹部剃毛,75%酒精消毒备皮,待干。耻骨水平中线开口,沿腹中线纵向剪开皮肤,钝性镊子分离皮肤与腹膜壁;沿腹中线切开3~4 cm(上至剑突),逐层分离肌肉,打开腹腔。进入腹腔后,检查腹腔整体情况,找到子宫及卵巢。分别于近卵巢端、近子宫末端使用0.6不可吸收缝线结扎,切除中段子宫,立刻置于无菌生理盐水中,眼科镊子保定,纵向切开,将子宫内膜剥离并切成面积约0.3 cm×0.3 cm的方块,分别于腹壁处、卵巢处进行对角线缝合。缝合完毕后,检查有无出血情况,使用庆大霉素注射液进行冲洗,连续缝合关腹,术毕,待苏醒。术后两天青霉素皮下注射,防止感染。
造模4周后,开腹检查,如若发现移植处囊状增大,新生血管形成且与周边组织粘连,即造模成功。
1.2.3 PSP治疗大鼠EMs的实验设计
本实验共设四组处理,分别为空白对照组、模型组及两个梯度的多糖治疗组(50 mg/kg PSP和100 mg/kg PSP),多糖组浓度的确定依据参考文献[13]。空白对照组(control group,CK)、模型组(model group,M)的大鼠灌胃等剂量生理盐水。两个治疗组(50 mg/kg PSP和100 mg/kg PSP)大鼠首先灌胃等剂量的生理盐水(50 mg/kg),并于灌胃生理盐水1 h后分别灌胃50 mg/kg 和100 mg/kg的PSP溶液(实验处理设置见表1)。灌胃操作于每天下午1∶00进行,每天一次,持续四周后将所有大鼠腹主动脉采血,并使其失血性休克死亡,使用游标尺测定病灶大小并采集样本。

表1 基于EMs治疗实验的处理分组表(n=6)
1.2.4 EMs大鼠PI3K、Akt、mTOR基因转录及蛋白表达分析
开腹采集样本,使用Trizol试剂盒提取大鼠子宫内膜异位组织total RNA,经琼脂糖凝胶电泳(观察是否出现28、18、5 s三条带)、核酸仪检测OD260/OD230与OD260/OD280比值质检合格后,按照Takara PrimeScript RT试剂盒说明书步骤进行反转录实验,合成cDNA后置于-20 ℃保存。
qPCR引物设计:在NCBI数据库中,根据PI3K、Akt、mTOR基因转录本序列开放式阅读框(ORF)设计PCR扩增引物;在NCBI数据库中,根据大鼠管家基因β-actin设计内参引物β-actin-F和β-actin-R,引物序列见下表。
反应条件:95 ℃预变性5 min;95 ℃变性30 s;退火30 s;72 ℃延伸40 s,循环数25。PCR结束后,用1%琼脂糖凝胶电泳检测PCR产物。使用SYBR Premix Ex Taq II(Takara)在CFX 96实时PCR检测系统进行qPCR,使用2-△△Ct法分析数据。
按照蛋白提取试剂盒说明书提取子宫内膜异位组织样本中的总蛋白后,测定蛋白含量。取20 μg待测样品与上样缓冲液混匀后,进行蛋白凝胶电泳(SDS-page)实验,电泳后转模,分别加入PI3K、Akt、mTOR抗体孵育,选择合适的二抗,ECL发光液发光后显影,以β-actin作为内参。

表2 PCR引物的核酸序列

续表2(Continued Tab.2)
设计RT-PCR反应体系如下:

表3 RT-PCR反应体系
1.3 统计学方法
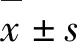
2 结果与分析
2.1 PSP的纯度及化学组成
如表4所示,PSP的得率约为1.95%,总糖、总蛋白质和灰分的含量分别为89.72%、5.07%和2.11%,PSP的相对分子量为29.6 kDa。

表4 螺旋藻多糖组分及分子量
2.2 各组处理大鼠的一般观察
造模期间每日观察大鼠表型,如毛色、精神状态、摄食情况、活动能力等。术后48 h每日皮下注射青霉素,因而各组大鼠体温正常,未见感染;相比于空白组,前一周手术组大鼠活动能力减弱,一周后活动能力恢复;手术组大鼠均发生了咬线情况,对缝合处使用75%酒精消毒,未再进行缝合。各组大鼠摄食差异较大,灌胃组摄食量较少,可能与灌胃溶液较多有关;术后PSP-H组一只大鼠因体温过低死亡,灌胃过程中PSP-L组因药液误入气管呛死2只,模型组(M)意外死亡一只,其余生存良好。本次造模成功率达到83.3%。实验四周后测定各组大鼠体重,未发现明显差异(图1)。
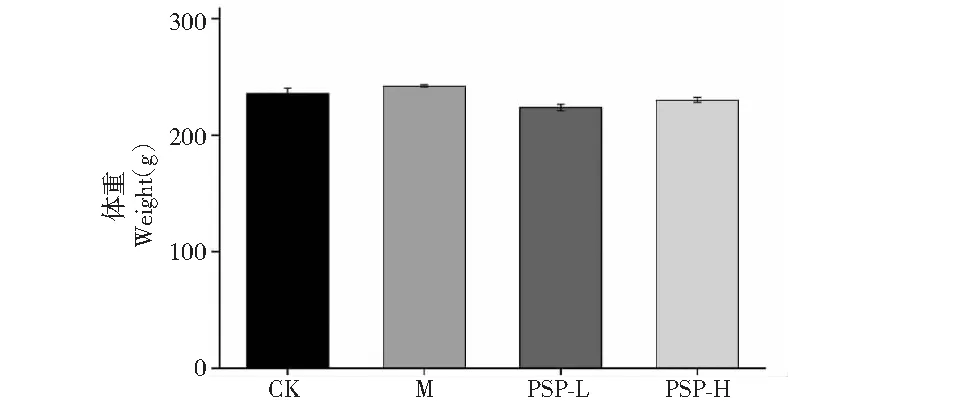
图1 PSP对大鼠体重的影响Fig.1 The effect of PSP on body weight in rats
2.3 PSP对大鼠异位子宫内膜生长的影响
通过使用游标卡尺对组织块的高度、表面积进行测量(图2),结果发现相较于模型组,不同剂量的PSP灌胃治疗均显著使异位子宫内膜组织高度降低、表面积减少,这表明PSP可有效减小异位子宫的病灶,例如高剂量多糖可以使病灶高度降低约42%,表面积减少52.8%,差异显著(P<0.05)。

图2 PSP对EMs病灶生长情况的影响Fig.2 The effect of PSP on the growth of EMs注:与模型组相比,*P < 0.05;**P < 0.01。Note:Compared with model,*P < 0.05;**P < 0.01.
2.4 PSP对大鼠血清TNF-α、VEGF、MMP-2含量的影响
与空白对照组相比,模型组EMs可显著增加大鼠血清中TNF-α的水平,TNF-α增加了近27%,差异显著(P<0.05);而使用多糖干预后,大鼠血清TNF-α的含量有所下降,低、高剂量多糖分别使TNF-α减少了约19%和17.6%,效果呈现剂量依赖性;与TNF-α的趋势相似,EMs均显著增加了血清VEGF和MMP-2的水平,而PSP可显著降低以上两种细胞因子的含量,治疗效果呈现剂量依赖性(图3)。
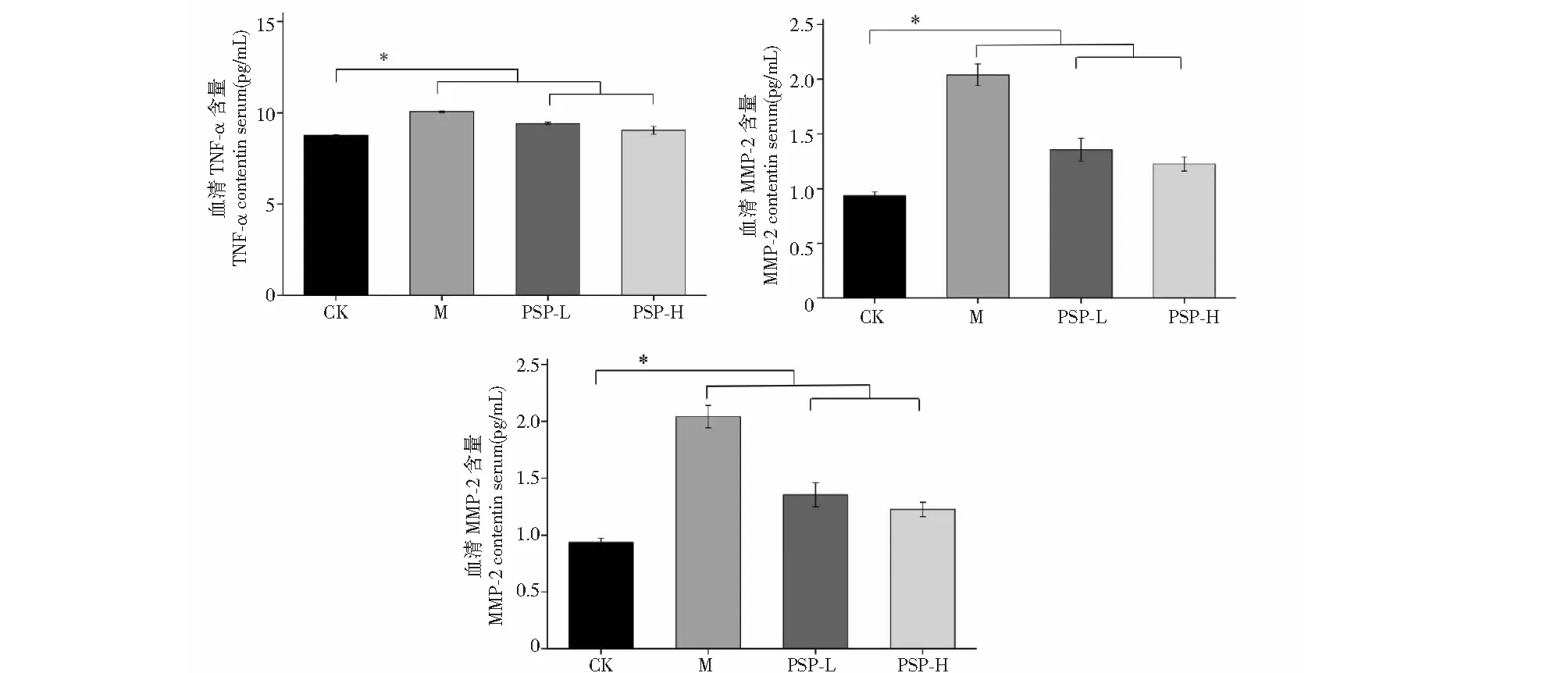
图3 PSP对大鼠TNF-α、VEGF和MMP2含量的影响Fig.3 Effects of PSP on the content of TNF-α,VEGF and MMP2 in rats注:与对照组相比,*P < 0.05;**P < 0.01。Note:Compared with control,*P < 0.05;**P < 0.01.
2.5 PSP对大鼠PI3K、 Akt、mTOR基因转录及蛋白表达的影响
qPCR分析(图4)表明,与模型组相比,对照组、PSP-L和PSP-H组中PI3K的表达下调,且具有显著性差异(P<0.05)。在所有治疗组中均检测PI3K、Akt和mTOR的相似表达模式,即模型组中这些基因的表达上调,而空白对照及治疗组中的表达下调,并且这些结果均具有显著性差异,由此可见EMs可显著提高PI3K/Akt/mTOR的表达,而PSP均可以显著抑制该信号通路上关键分子的表达。
蛋白免疫印迹分析图4表明,所有实验组均出现条带,且不同浓度多糖处理后,PI3K、Akt和mTOR蛋白相对表达差异具有统计学意义。与对照组相比,模型组中PI3K、Akt和mTOR蛋白表达相对较高,而治疗组中PSP可抑制蛋白的表达,特别是高剂量的PSP作用效果更加显著。
3 讨论与结论
EMs的发病率逐年增高,但是其治疗方法却十分有限,往往会采用长时间的内科药物干预,这样不仅影响病人的治疗信心,同时也导致极大的副作用。此外,开发新型有效的EMs治疗药物是迫在眉睫的,随着功能食品产业的发展,具有药理学功能的新型天然产物引起了人们广泛的重视。PSP是一类具有多重功效的天然生物大分子,目前已经有较多研究发现PSP可以通过作用于某些肿瘤信号通路上的分子达到调控下游基因表达的作用,而EMs的形成及发展与大多数肿瘤细胞的信号通路相似,因此我们推测PSP可以介导部分通路来缓解EMs的产生及增殖。
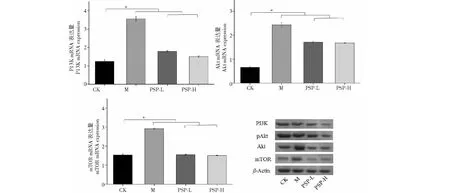
图4 qPCR分析PI3K/Akt/mTOR基因转录水平及蛋白免疫印迹分析Fig.4 The qPCR analysis of PI3K/Akt/mTOR gene transcription level and Western blot analysis注:与模型组相比,*P < 0.05;**P < 0.01。Note:Compared with model,*P < 0.05;**P < 0.01.
本研究首先对PSP进行了提取和纯化,本次多糖的提取率可以达到1.95%,经柱层析法测定后纯度较高(89%),可以用作活性鉴定实验;我们采用SD大鼠进行EMs造模,因大鼠器官组织较大,便于剥离、种植等操作。EMs造模可以分为自体移植和异体移植等,在此我们为了避免产生免疫排斥,选择自体移植术进行造模,造模成功率可以达到80%以上。PSP干预后,对大鼠进行了长期动态的观察,发现大鼠的体重并无显著变化,这意味PSP对正常大鼠及EMs大鼠的生长不存在负面影响。通过对腹腔移植物的高度、面积进行测量,发现PSP的干预显著减缓了EMs的发展,即PSP或许可以用于EMs治疗。
我们猜测PSP可能是通过调控与EMs形成发展相关的细胞因子而产生治疗效果。由细胞因子所调控的细胞黏附、血管生成等是EMs发展的重要环节,例如MMP-2可调节细胞之间、细胞与基质之间的信息交流,也有研究证明MMP2可以增强细胞的黏附作用,进而使得子宫内膜细胞更容易在异位定植,本研究中EMs大鼠的MMP2水平较高,这与Yuan等[17]的发现一致;而PSP可以降低MMP2的活性,这意味着MMP2可能是PSP的作用靶点。在细胞增殖、侵袭的过程中,TNF-α扮演了重要的角色,TNF-α具有促进细胞增殖和分化、影响血管功能等众多特点[18]。本研究中,PSP可显著降低EMs大鼠血清中的TNF-α水平,并且进一步降低了TNF-α下游调控的VEGF的合成,进而抑制了EMs细胞的增殖及病变组织的血管形成,血管形成是EMs局部病灶易于转移和免疫逃逸的重要原因。VEGF的水平还受PI3K/Akt通路调控[19]。PI3K/ Akt/ mTOR通路整合一系列的细胞外信号,调节各种细胞功能。该通路通过整合黏附素/细胞间黏附因子-1介导子宫内膜细胞黏附作用(此为子宫内膜异位的必要病理生理学条件)[20];间接调控金属蛋白酶(MMP)和金属蛋白酶组织抑制剂(TIMP)来介导子宫内膜细胞的侵袭、转移;调控VEGF形成新生血管,此为形成EMs的重要步骤[21];此外,PI3K/Akt/mTOR信号通路还可调控细胞凋亡及雌激素分泌,二者也是EMs形成和发展不可缺少的因素。我们发现PI3K/Akt/mTOR在模型组小鼠中均显著表达增强,该通路的激活意味着细胞的生长、增殖以及血管形成,这无疑加剧了EMs的发展。本研究中我们发现PSP可以抑制PI3K/Akt/mTOR信号通路的激活,这可能是TNF-α、VEGF等细胞因子合成减少的重要原因。然而迄今为止还很少有论文报道PSP对该通路的调控作用,PSP通过何种途径实现对PI3K/Akt的调控?这将是我们下一步的研究重点。
本研究在PSP制备及纯化的基础上,完成了对PSP的成分,并基于自体异位种植术制备了符合要求的大鼠EMs模型,基于模型探究了PSP对大鼠子宫内膜异位症的改善作用,具体表现为可有效降低血清TNF-α、VEGF、MMP-2等细胞因子的含量,达到抑制EMs发展的作用;进一步基于PI3K/Akt/mTOR信号通路探究PSP对大鼠子宫内膜异位症的治疗机制,结果表明:与模型组相比,治疗组大鼠异位子宫内膜组织PI3K、AKT、mTOR的基因表达量明显下降,蛋白表达检测证实PSP可抑制AKT的磷酸化进而抑制PI3K、mTOR蛋白表达,这表明PSP可通过抑制PI3K/Akt/mTOR信号通路改善大鼠EMs症状。本文为发现PSP的新型药理功能及阐述相关机理提供了参考,为下一步研究开发提供了科学基础。
