缝隙连接渗透率对钙离子传输的影响
2021-02-01宋正勋马迪崔焱旭郎百和杨立波王作斌
宋正勋, 马迪, 崔焱旭, 郎百和, 杨立波, 王作斌
(1. 长春理工大学 电子信息工程学院, 吉林 长春 130022; 2. 长春理工大学 国家纳米操纵与制造国际联合研究中心, 吉林 长春 130022; 3. 长春理工大学 教育部学科创新引智基地(D17017), 吉林 长春 130022)
随着纳米技术的迅速发展,纳米尺度(1~100 nm)的信息与通信技术日益成为研究热点.分子通信领域中,缝隙连接(gap junction,GJ)作为一种生物纳米机器之间的接口[1],连接两个相邻细胞的细胞质,允许胞内某些小分子(如Ca2+)在相邻细胞间扩散,从而影响细胞内离子浓度.同时,缝隙连接蛋白(connexin,Cx)以多种类型表达和分布于动物细胞组织的不同部位中,且同一细胞或组织可能有多种蛋白存在.例如,家兔窦房结组织表达的Cx43和Cx31.9与心动过缓密切相关[2];Cx43,Cx40与Cx45影响血管痉挛[3];心肌细胞表达的Cx40和Cx43同时影响着心房颤动[4];Cx43和Cx37对卵巢卵泡的发育起着重要作用.因此,控制不同种GJ蛋白行为对药物的传送及疾病的治疗有重要意义.
目前,对缝隙连接模型的研究大致有两类.一类研究集中于根据细胞类型找到影响GJ行为的因素,从而建立模型.研究人员从信息论角度,根据动作电位影响GJ的行为,建立以心肌细胞为例的兴奋型细胞间的GJ通道传输模型[5-6].对于星型胶质细胞,要实现细胞内部途径长距离通信,需要对GJ进行非线性耦合[7];对于上皮细胞(代表不可兴奋型细胞)、平滑肌细胞(代表可兴奋型细胞)、星形胶质细胞(代表杂种细胞),可以建立电压敏感随机模型模拟GJ开关过程[8].另一类研究则基于GJ,由两个与相邻细胞内钙离子浓度变化密切相关的半通道连接子组成,建立切换控制模型[9-10].
上述GJ模型旨在分析GJ开关特性与外界环境和细胞内部离子浓度等因素的关系,却忽略了连接蛋白本身差异性,将所有蛋白类型的开关控制归为一类.实际上,即使是同种细胞,也会同时表达不同种连接子蛋白,从而使缝隙连接介导的通信过程传输情况有所不同.因此,本文考虑到GJ本身的差异性,从GJ蛋白类型出发,分别分析其对发送、传输和接收过程的影响,丰富现有的从生物学角度描述分子通信过程的方法,并对过滤功能进行数值分析,优化缝隙连接渗透性模型,引入渗透率参数,探究不同渗透率对传输距离和接收幅度的影响.
1 通信过程
对比传统意义上的通信系统,缝隙连接介导的分子通信过程[11],如图1所示.在一维生物场景下,钙离子传输模型,如图2所示.图2中:w为刺激强度.
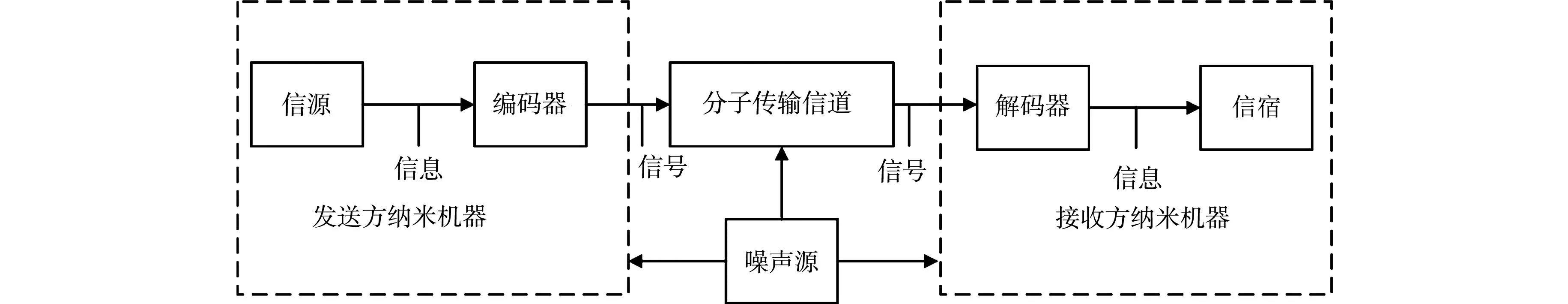
图1 缝隙连接介导的分子通信过程Fig.1 Process of molecular communication mediated by gap junction
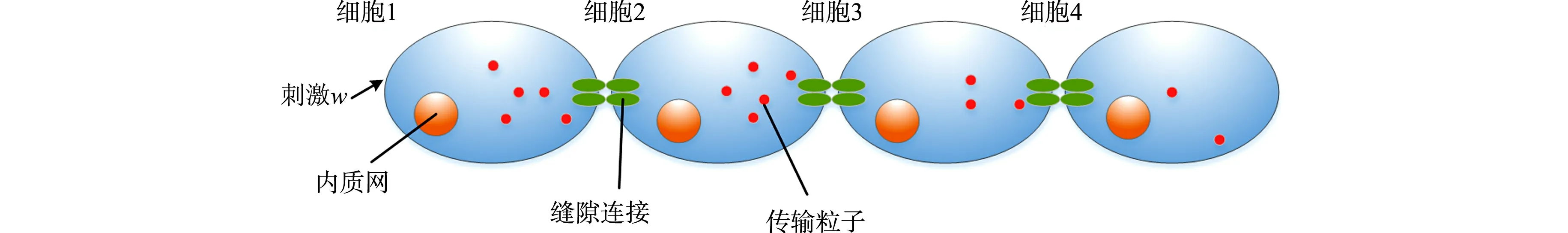
图2 一维场景下钙离子传输模型Fig.2 Transport model of calcium ions in one dimension
图1中,刺激发送方纳米机器发送信号分子,将信号分子转化成适合在生物细胞或组织中传播的粒子,如三磷酸肌醇(inositol 1,4,5-triphosphate,IP3)(编码过程),在细胞中或细胞间传输,到达接收方纳米机器前转换成特定的响应,比如肌肉收缩(解码过程).由于生物环境中存在各种化学反应,因此,噪声一直存在,而研究基于无其他化学反应且收发同步的假设.
刺激细胞1(发送方纳米机器)使细胞产生钙振荡,并依次向细胞2,3,4传输,假设周围无其他交换过程,细胞内钙振荡及细胞间GJ介导的钙传输交替出现,从而实现钙离子到达细胞4(目标接收机).
1.1 缝隙连接
钙离子传播通信的一个重要特征是可以从一个细胞传播到另一个细胞,这种交流包含细胞内钙离子动力学(胞内传输)和细胞之间的通信(胞间传输).而GJ正是细胞之间钙离子传播的关键介质.
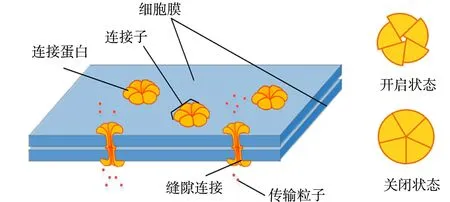
图3 缝隙连接的生物模型Fig.3 Biological model of gap junction
缝隙连接的生物模型,如图3所示.GJ通道是在两个相邻细胞间形成的物理通道,连接两个细胞的细胞质.GJ通道由围绕中心孔的两个相邻的连接蛋白六聚体组成.研究表明,连接蛋白有Cx43,Cx37,Cx40等超过20种,不同连接蛋白在分子渗透性和选择性方面具有不同的性质[12].影响GJ渗透性和选择性的因素包括环境的pH值,钙离子浓度和钙调蛋白等[13].作为动物组织中普遍存在的一种细胞连接方式,GJ的开闭往往可控,并控制着细胞间通路,影响胚胎、组织和器官的发育、细胞死亡等.因此,研究GJ渗透性对细胞间通信过程的影响具有重要意义.
一般来讲,除了对GJ蛋白特征与性能进行生物学实验外,还可用数学模型量化缝隙连接渗透性对钙离子的传播过程.刺激单一细胞(发送端输入)会引起钙离子传播.在分子通信的分层结构中,GJ作为生物纳米机器子层具有分子释放功能,可直接进入其他生物纳米机器中,通过与另一种生物纳米机器的直接连接打开连接两个细胞的GJ通道[14].
1.2 发送
发送是通过刺激物对发送方纳米机器产生一定强度的刺激传输钙离子的方式开始的.实验已经证实,只要满足条件实现再生波传播,钙离子就可以以自扩增的方式向下传递[15].发送过程的实现需满足两个基本条件:1) 刺激强度可以达到发送纳米机器感知的程度,使细胞内出现钙振荡;2) 发送方细胞与下一个传递的相邻细胞间GJ打开,使钙离子可以向下传输.然而,当同一发送纳米机器周围存在多种GJ连接多个第2传输细胞时,对于一定刺激强度,发送方纳米机器发送传输粒子,不同GJ对粒子的感知程度不同,从而发生分子优先通过某一GJ通道,这一过程可以描述为过滤.过滤实质上是由于GJ对传输粒子的敏感度不同而出现的渗透性差异,使发送的粒子受到传输限制或择优通过的过程.
1.3 传输
钙离子在生物体内普遍存在,并参与调节生物生长发育、组织分化和凋亡等生理活动.细胞中钙离子浓度调节着机体活动[16].钙离子传输包括两个过程:胞内传输和胞间传输.内部传输表示刺激产生的钙离子在细胞内形成钙波.钙离子胞间传输包含内部途径和外部途径[17].对于GJ介导的钙离子通信过程,传输距离是一个重要指标,想要实现药物靶向治疗,通过粒子的传输距离确定其到达的指定位置是关键.除了文献[6]中信息容量、分子延迟和信号干扰等研究外,GJ类型与传输距离密切相关.文献[12]的实验证实了用IP3刺激融合生长的海拉细胞Cx32传输效率比Cx36高3~4倍.
1.4 接收
纳米接收机能否成功解码接收到钙信号从而实现响应是接收的关键.在其他条件(刺激发送与传输过程)不变且接收端收到钙浓度一定的前提下,GJ渗透性差异影响解码出的钙振荡幅度.由于不同GJ渗透性不同,即使接收前钙传播相同,最后接收到的钙波幅度也将不同.
2 数学模型
2.1 钙离子传输模型
设所有参与通信的细胞集合为G,任何一个通信过程中第i,j个细胞相邻,且i,j∈G,发送方细胞为第1个细胞,刺激强度w使钙离子经过内外传播途径向目标接收细胞传播.用cX,i表示第i个细胞中的钙离子浓度,内质网中钙离子浓度为cY,i,传输时间为t.这里仅对细胞间钙振荡的经典双池模型进行描述.最小钙确定性模型[18]为
(1)
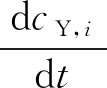
(2)
式(1),(2)中:v0为钙离子从细胞外流入细胞内的速率;I为输入刺激在细胞中的响应,其表达式为
(3)
式(3)仅假设在细胞集合G内,外界刺激对传输有影响,不在此范围内的外部刺激则对传输过程不产生影响.其中,a1w表示输入刺激使细胞内钙离子浓度升高的速率;SE,i表示均值Si为0,方差为DE的高斯白噪声,表达式为
SE,i=a1wSi
.
(4)
式(1),(2)中的v1和v2表示由参数a2~a6控制的钙库(内质网)与胞质间的钙离子交换速率,其中,a2表示胞内钙离子泵入钙库的最大速率;a4表示钙库中的钙离子释放到细胞内的最大速率;a3,a5,a6分别为泵送、释放和激活的阈值常数.v1和v2的表达式为
(5)
k1cX,i表示钙离子从胞质内流出细胞导致胞质内钙离子浓度降低的速率;k2cY,i表示细胞内内质网泄露钙离子到细胞质中导致细胞内钙离子浓度升高的速率;SI1,i和SI2,i分别表示由细胞体积Vi和独立的标准正态变量η0,i~η5,i和η6,i,j控制的细胞质中及钙库中的内部噪声,即
(6)
(7)
SG,i,j表示均值Γi,j为0,方差为DG的缝隙连接产生的高斯白噪声,其表达式为
(8)
式(8)中:Pi,j为缝隙连接渗透性,表示相邻细胞胞质中钙离子穿过GJ的渗透性,它表征两个连接子的耦合程度.更多数值设置及内容分析参照文献[10].
2.2 缝隙连接模型
式(1)中的耦合项Pi,j并不是早期研究中的常数项,文献[8]设计通道开关,通过钙离子浓度对GJ通透性的影响建立信道切换模型,该模型基于细胞间切换机制将其改进为可选通的可变项.GJ是由两个连接子构成,其渗透性可直接由两个连接子的渗透程度表示,即
Pi,i+1=Pi(cX,i)·Pi+1(cX,i+1).
(9)
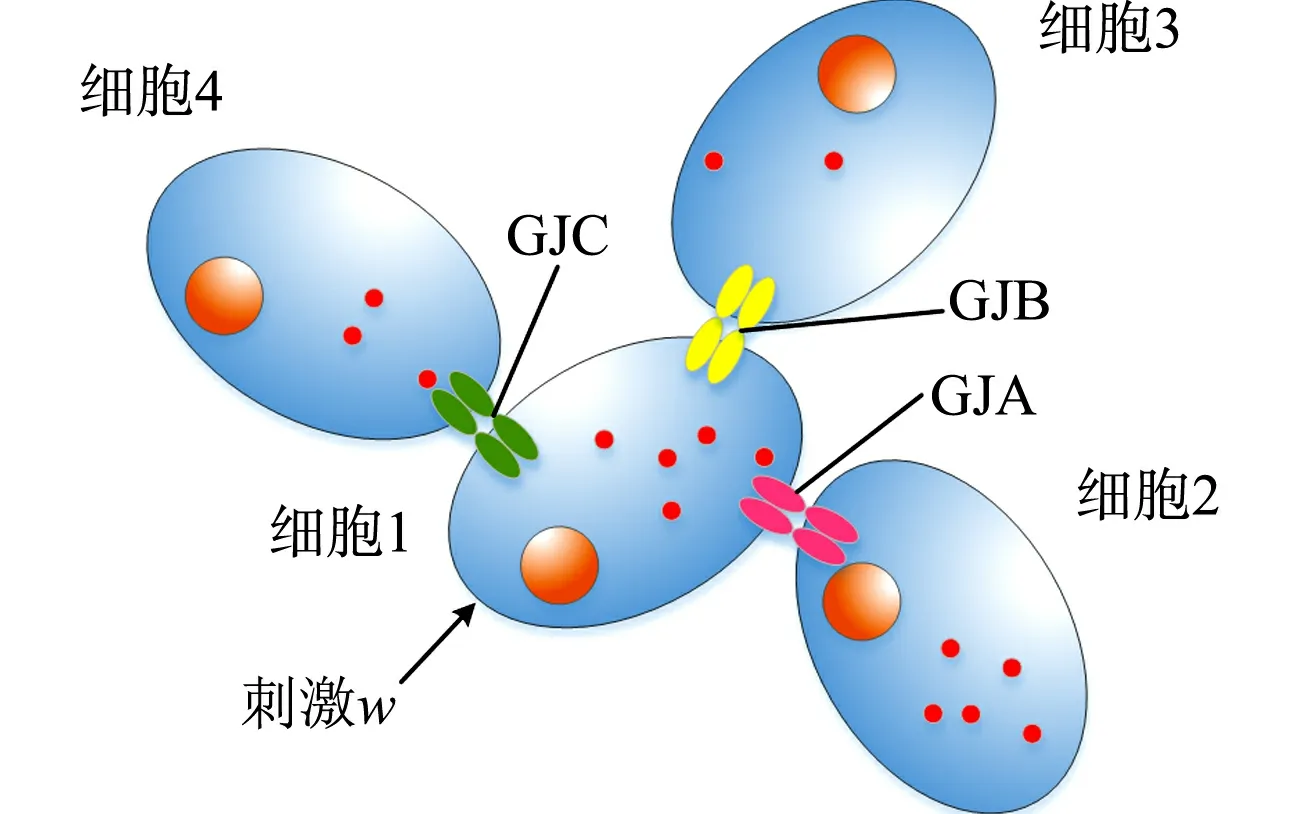
图4 细胞间不同连接蛋白的 钙离子传输模型Fig.4 Calcium ions transport model of different connexins between cells
式(9)中:i+1=j;Pi与Pi+1分别表示第i与第i+1个细胞上连接子对钙离子的渗透程度,若使GJ形成通道,要求两个连接子类型相同,各连接子渗透性受各自所在细胞中钙离子浓度的影响.
然而,作为蛋白本身属性,不同GJ类型的连接子将直接影响钙离子在细胞间的发送、传输和接收过程,最明显体现在发送过滤.细胞间不同连接蛋白的钙离子传输模型,如图4所示.同一细胞(发送细胞1)质膜上存在多种连接子蛋白,多种不同连接子蛋白与相邻细胞2,3,4表面连接子结合成不同类型缝隙连接A,B,C,分别用GJA,GJB,GJC表示.刺激细胞1后,钙离子通过不同GJ向下传递(刺激后假设钙离子在细胞中均匀分布),则GJ差异直接影响渗透性,钙离子经过GJA,GJB,GJC的阻碍程度不同,传递至下一个细胞后,想要达到该细胞中钙离子所能检测到阈值的时间也就不同,造成3个路径下的传输延迟,形成过滤.在对过滤理论分析的基础上,模拟GJ发送过滤机制,定义渗透率参数p.渗透率是表示不同连接蛋白构成的GJ通道对传输粒子阻碍程度的物理量,它仅区分蛋白属性,表征连接蛋白间的差异性.由于两个同种连接子的耦联才形成GJ通道,因此,渗透率仅针对能构成GJ的两个连接子.与渗透性不同,渗透率仅表征蛋白差异引起的对传输粒子阻碍的作用,用来描述GJ蛋白特性的量.而渗透性则是蛋白通道对粒子的阻碍作用,反映粒子通过蛋白通道传输的能力,这种能力与pH值、温度及蛋白差异等多种因素有关.因此,在原渗透性模型的基础上,加入渗透率参数表示蛋白差异的影响因素,优化渗透性模型.
缝隙连接渗透性模型为
(10)
(11)
式(10),(11)中:参数b1~b4和n,m,q的设置影响GJ的打开速度,受环境因素的影响;Pmax表示最大能达到的渗透性.根据具体生物场景,在有些非正常细胞中,随着胞内钙离子浓度的增加,GJ趋于关闭状态,渗透性降低(由式(10)模拟);还有一些细胞,当钙离子浓度升高,GJ趋于打开状态,于是渗透性升高(由式(11)模拟)[9].
一定刺激下,3种不同类型通道的状态及1个短周期内传递细胞中钙离子振荡峰值出现的情况,如表1所示.表1中:T表示1个周期;t1~t3为1个周期的3个时间点;“”表示振荡;“-”表示非振荡.
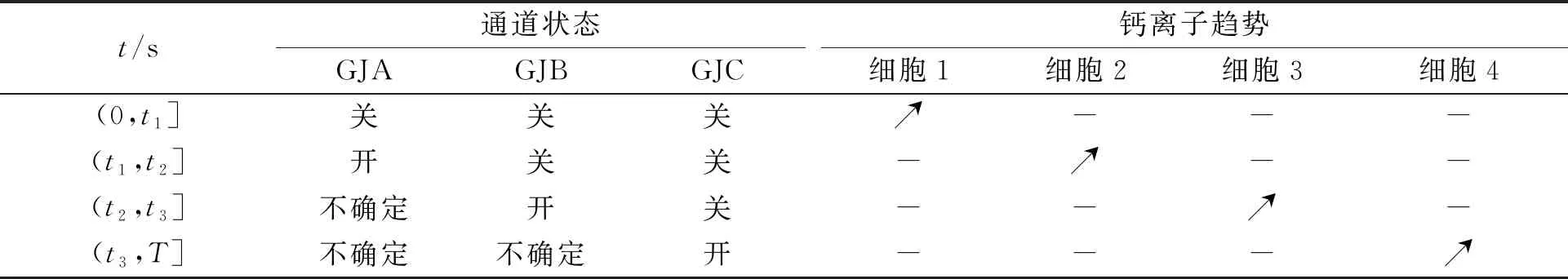
表1 通道状态及细胞内钙离子趋势Tab.1 Channel status and intracellular calcium ion trends
在0时刻,给细胞1一定刺激(达到细胞产生钙离子振荡的程度),在(0,t1]时段,刺激引起IP3浓度升高,发射细胞1中的钙离子浓度随之增加,细胞1开始出现振荡.假设钙离子浓度在细胞中分布均匀,即达到峰值后向下传输的起始浓度一致.当钙离子浓度增加到指定阈值后,由于GJA对刺激产生的钙离子敏感度较强,于是,GJA优先在(t1,t2]时段内开放,渗透性升高,钙离子在细胞2中开始振荡;GJB对钙离子敏感度相对较低,在(t2,t3]时段内打开,钙离子进入细胞3中,开始出现振荡峰值.由于该时段内细胞2已经振荡并向下传递,其内部钙离子接近稳态,所以,即使细胞1,2之间的GJA在(t2,t3]时段与GJB一同开放,也并不影响正常通信,仅起到正常膜蛋白作用,不考虑环境因素影响,仅与两细胞内钙离子浓度稳态波动有关,开或关对细胞3传递过程的影响可忽略不计,只比较不同蛋白传输的过滤先后,忽略不同蛋白依次打开后同时开放对发送传递的影响,因此,用不确定表示.GJC对钙离子的敏感度最低,因此,在(t3,T]时段内打开,细胞4开始振荡.同理,该时段内GJA和GJB用不确定表示.这样便呈现出不同时段的钙离子选通特性.表1中的“开”和“关”是一种相对的概念,表示钙离子通过时GJ的变化.为了描述这一过滤现象,引入参数p来区别不同通道蛋白的类型.
3 仿真结果与讨论
3.1 发送结果
仿真过程中,对细胞1刺激(图4),刺激传播至相邻细胞,假设3种不同连接蛋白连接发送细胞1与相邻细胞.钙离子将分别通过GJA,GJB,GJC传播至细胞2,3,4.于是,随着刺激强度的增加,GJ表现出不同的渗透性.两种机制下的GJ渗透性,如图5所示.
在无刺激时,细胞膜上的GJ通道参与维持细胞内、外离子平衡,介导相邻细胞通信[19].但刺激的产生改变了相对稳定的状态,随着刺激的逐渐增加,在细胞膜及内质网膜受体的作用下,细胞内钙离子动员分子IP3增加,进而升高细胞溶质中钙离子的浓度.因此,刺激增强,在细胞中产生的钙离子浓度变大,由于当前钙离子的稳定状态被破坏,细胞的自我保护机制使GJ通道趋于关闭的状态,渗透性降低.然而,在某些病态下,GJ依然会打开,渗透性依然升高,允许钙离子继续通过[9].
对节2.1的公式部分仿真,刺激输入增加,使细胞产生的钙离子浓度逐渐增加,从而改变GJ渗透性.然而,在实际生物场景中,刺激过强将导致蛋白表达失常,例如,在高糖作用下,肾小球系膜细胞间的GJ蛋白表达降低,影响正常通信[20].为了与实际场景契合,改变刺激强度w的值,w的取值范围为[0,1.8].图5(b)中有一处跳变的原因在于,当刺激达到一定程度时,细胞1内钙离子浓度加速增长到峰值,GJ达到开放最佳,即该时刻第2个细胞钙离子浓度的振荡将影响GJ的渗透性程度,因此产生跳变.
两种不同的钙离子浓度影响机制都显示渗透率越高,GJ渗透性越大.以图5的第2种机制为例,不同渗透率时钙离子传输延迟性,如图6所示.图6中:cX表示细胞中的钙离子浓度.由图6可知:当发送细胞1同时传递钙离子时,渗透率低时表现出一定的传递延迟性.以上结果体现出过滤性质,即不同GJ对刺激的敏感程度不同,因此,在发送时,同一刺激下渗透率高,GJ渗透性越强,容易开放,钙离子优先通过,从而实现过滤.在(0,0.5] s时段内,GJA开放,细胞2开始出现振荡峰值;在(0.5,1.0] s内,GJB开放,细胞3开始出现振荡峰值;在(1.5,2.0] s内,GJC开放,细胞4开始出现振荡峰值.由此可得,通过不同p的取值,可以实现不同时段的通道开放,从而描述过滤过程.
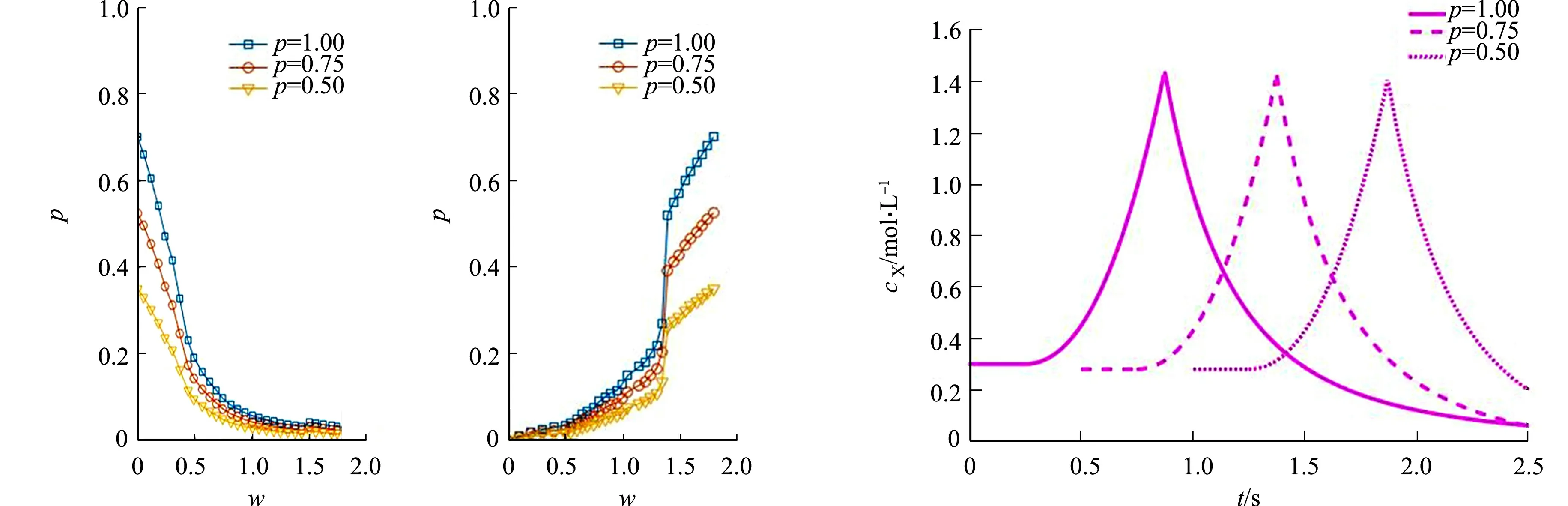
(a) GJ趋于关闭 (b) GJ趋于打开图5 两种机制下的GJ渗透性 图6 不同渗透率时钙离子传输延迟性Fig.5 GJ permeability undertwo mechanisms Fig.6 Calcium ion transport delays at different penetration rate
3.2 传输结果
选择直线型结构传输(物理模型见图2),分别以同一刺激强度对3种不同渗透率的GJ进行钙离子传输,假设每次刺激时钙离子都在相同GJ蛋白中传输.钙离子向下传递过程中浓度持续衰减,而传递的距离(用传递细胞数描述)因蛋白类型(用缝隙连接渗透率表示)的不同而表现出不同的传输效果.

图7 p=0.50时的钙离子传输浓度Fig.7 Concentration of calcium ion transport at p=0.50
当p=0.50时,钙离子传输到细胞1,2,3的浓度,如图7所示.图7中:钙离子以振荡形式传播,这里仅显示1个周期(下同).由图7可知:一维钙波细胞1产生振荡波峰,表示传输成功;细胞2内浓度相对衰减,但依然产生波峰,细胞2传输成功;然而,细胞3内钙离子振荡峰值较小,即细胞钙离子浓度变化趋缓,开始向正常细胞动态平衡状态变化,细胞3传输失败.因此,传播细胞数为2.
当p=0.75时,钙离子传播到细胞1,2,3,4的浓度,如图8所示.由图8可知:一维钙波传递至细胞1,2,3时振荡峰值虽依次递减,但均有波峰产生,表示传输成功;而细胞4钙离子浓度逐渐趋于动态平衡状态,即细胞4传输失败.因此,传播细胞数为3.
当p=1.00时,钙离子传播到细胞1,2,3,4,5的浓度,如图9所示.由图9可知:一维钙波传递到细胞1,2,3,4时均有振荡波峰产生,表明传输正常;第4个细胞后,钙离子浓度便趋于动态平衡状态,传输失败.因此,传播细胞数为4.

图8 p=0.75时的钙离子传输浓度 图9 p=1.00时的钙离子传输浓度 Fig.8 Concentration of calcium ion Fig.9 Concentration of calcium ion transport at p=0.75 transport at p=1.00
通过对比不同渗透率下的传输情况可知,改进后的模型可以明显区分蛋白属性.通过设置渗透率描述钙离子在不同传输通道下传输的距离不同,即渗透率越大(p最大不超过1.00,当p=1.00时,钙离子并非全部通过GJ,即p≤1.00,因为还有其他环境等因素控制着连接蛋白开关,GJ介导的钙离子传播中,蛋白类型所起的作用越低,其他控制因素显示的作用越大),传播的细胞数越多,传输距离越远.根据已有的生物实验[14],将p取值为1.00,0.75,0.50,分别对应连接蛋白Cx32,Cx43,Cx26.
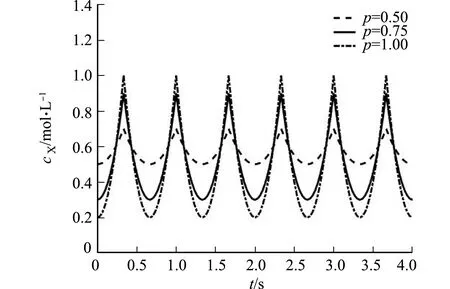
图10 解码接收到的钙离子信号Fig.10 Calcium ion signal decoded by receiver
3.3 接收结果
解码接收到的钙离子信号,如图10所示.钙离子在接收机细胞内已经处于稳定振荡状态,然而,即使接收机前一细胞钙离子浓度相同,接收机解码的振荡幅度也不同.原因在于GJ通道类型差异影响接收机接收信号的强度.由图10可知:渗透率越高,振荡幅度越大,接收效果越明显,在实际生物场景中,响应将更显著.
3.4 讨论
改进前的模型由于未区分不同连接蛋白的差异,即蛋白是统一的,因此,粒子无法对GJ通道进行选择,进而无法利用该属性实现分子通信的过滤;而改进后的GJ渗透性模型改善了原有模型中蛋白统一的局限性,区分了不同连接蛋白的差异,表明不同蛋白类型对刺激具有不同的敏感度,这一表征与实验结果一致.同时,由仿真结果得出,引入GJ渗透率参数建立的新模型可用来描述GJ类型对发送、传输、接收过程的影响,且与生物场景契合,增强了模型对实际生物场景的细节描述.
4 结束语
基于缝隙连接的生物学特点,通过设置渗透性参数,优化GJ渗透性模型.以钙离子作为传输粒子,通过数值实验对过滤过程进行分析,发现GJ渗透率不仅影响钙离子的传递距离,而且影响解码接收的钙信号振荡幅度.由此得出结论:细胞间GJ渗透率对钙离子通信过程有一定影响,渗透率越大,钙离子越早发送,且渗透率优化的模型可描述发送过滤过程,传输距离越远,接收幅度越大.由于缝隙连接蛋白类型有限(目前发现20余种),后续研究中,希望可以通过实验找到一些其他类型的传输渗透率,使缝隙连接介导的通信过程更精确化,并且深入研究不同GJ蛋白同时开放或关闭对钙离子传输的影响.对于特定细胞,某些蛋白的渗透率较高,传输性能较好,更利于药物靶向传输,可根据需要导入所需连接蛋白基因类型,使目标蛋白表达,从而延长传输距离.
