基于EKR/AKT 信号通路探讨湿热中阻方改善脾胃湿热小鼠症状的分子机制
2021-01-30周丽雅张益蒴
尤 文,周丽雅*,魏 岩,曹 路,张益蒴
(1.长春中医药大学基础医学院,长春 130117;2.长春科技学院医药学院,长春 130600)
脾胃湿热证是湿热蕴结脾胃,致脾失健运、胃失纳降而形成的证候[1]。脾胃是先天之本,气血生化之源[2],若感受湿邪、饮食不节制,就会导致痰湿内生,郁久化热,从而生成湿热之邪,故“清热祛湿”是治疗的根本[3]。本研究中湿热中阻方是王氏连朴饮[4]加海螵蛸、白及、瓦楞子而成,具有燥湿化浊、清透蕴热、理气宣通、调达中州功效。经查阅文献可知,脾胃湿热证的改善与炎症通路、自噬通路相关[5-6],炎症反应的发生将影响局部细胞的免疫反应增强,释放炎症因子的同时,会释放氧自由基[7-8],直接或者间接影响到血管内皮的损伤[9]。本实验选取ERK/AKT 通路展开研究,探究湿热中阻方改善具脾胃湿热症状患鼠的分子机制。报道如下。
1 材料与方法
1.1 动物与材料
1.1.1 实验动物 SPF 清洁级昆明小鼠(18~20 g)60 只,雌雄各半,周龄6~8 周,购自辽宁长生生物技术有限公司[生产许可证号SCXK(辽)2015-0001]。所有小鼠饲养于洁净级别大于10 000 的饲养室内,噪音(无动物时<50 dB),昼夜循环(12 h/12 h),室温22~24℃,相对湿度50%~55%,动物自由摄食饮水。实验开始前动物适应性饲养7 d,实验期间实验动物伦理严格按照减少,替代,优化原则进行管理[10]。
1.1.2 实验用药与主要试剂 湿热中阻方,长春中医药大学附属医院提供;RIPA 裂解液(P0013B),BCA 蛋白浓度测定试剂盒(P0012S),上海碧云天生物技术有限公司;胃泌素(GAS)试剂盒(H239)、胃东素(MTL)试剂盒(H182),南京建成生物工程研究所有限公司;极超敏ECL 化学发光即用型底物(AR1191),武汉博士得生物工程有限公司;ERK(4695T)、p-AKT(3787S)、GAPDH(5174S),美国Cell Signaling Technology 公司;羊抗兔IgG[Goat Anti-Rabbit IgG(H+L)HRP,ZJ2020-R]、羊抗鼠IgG[Goat Anti-Mouse IgG(H+L)HRP,ZJ2020-M],美国Bioworld Technology 公司;引物序列(ERK、AKT、GAPDH),生工生物工程(上海)股份有限公司;白酒(红星二锅头55 度,SC11511160310087),北京红星股份有限公司。
1.2 实验方法
1.2.1 实验用药制备与储存 湿热中阻方由王氏连朴饮加海螵蛸、白及、瓦楞子成方。按照《医疗机构中药煎药室管理规范》制备中药复方汤剂,浓缩后每1 mL 药液中含生药量1.2 g,干燥器储存。
1.2.2 模型制备与药物干预 所有小鼠随机分配6 组:空白组(A 组)、模型组(B 组)、湿热中阻方低剂量组(C 组)、湿热中阻方中剂量组(D 组)、湿热中阻方高剂量组(E 组)、阳性药组(F 组)。除空白组外,其余各组小鼠建立脾胃湿热模型,即喂养普通饲料同时,添加200 g/L 蜂蜜水自由饮用,隔日按照m/m 对每只小鼠灌服油脂(10 g/kg),再隔日v/m灌服白酒。30 d 后,采集小鼠生理信息,追踪鼠精神状态、日常活动、反应情况等一般生理指标,并每组随机抽取小鼠,剖腹分离胃组织,利用HE 染色对模型进行评价。筛选模型成功小鼠,治疗各组按照《药理实验方法学》(徐叔云,主编)人鼠等效剂量比值换算,小鼠给药剂量为成人9.1倍,给予湿热中阻方(浓缩复方选取蒸馏水稀释),每只鼠每日1 次进行灌胃,空白组、模型组给予相同条件的蒸馏水刺激,实验中对各组小鼠进行一般情况记录。实验共干预7 d,随后进行实验取材。
1.2.3 酶联免疫吸附法(Enzyme linked immunosorbent assay,Elisa)检测胃肠激素水平 给药7 d 后,眼球取血置离心管内,室温静置0.5 h 后,离心15 min(3 000 r/min),回收上清,按照试剂盒说明书进行检测并计算比较各组GAS、MLT 含量的表达。
1.2.4 苏木精-伊红染色法(Hematoxylin-Eosin staining,HE)观察组织形态学改变 取血后断颈法处死小鼠,剖腹分离胃组织,置于4%多聚甲醛中固定过夜,修剪组织后置于脱水盒中,按组标记并利用组织脱水机进行脱水处理,随后进行组织包埋,-20 ℃进行蜡块成形固定,修整蜡块后进行组织切片,片厚为4 μM,烘烤后进行HE 染色,并在光学显微镜下进行观察,从病理学角度,判断各组组织情况,做出病理学描述。
1.2.5 实时荧光定量法(q-PCR)检测关键基因表达 取血后断颈法快速处死小鼠,剖腹分离胃组织,进行总RNA 提取,并对其纯度以及完整性进行检测,之后按照cDNA 逆转录试剂盒说明配制溶液,进行梯度反应,时间为30 min,随后按照试剂盒说明进行试剂配制,进行RNA 定量检测,时间为90 min,目的基因(引物序列见表1)均与内参(GAPDH)进行相对比较,计算相对基因表达。

表1 PCR 引物及产物大小
1.2.6 蛋白免疫印迹法(WB)检测目的蛋白 取胃组织,在液氮中研磨后,加入RIPA 蛋白裂解液,4℃用匀浆机细碎组织,离心去除多余杂质后,利用WB 实验检测已经提取的胃组织目的蛋白表达水平,主要步骤为配置8%~12% SDS-PAGE 分离凝胶和5% SDSPAGE 浓缩凝胶,电泳浓缩凝胶部分用80~110 v 进行电泳,30 min 后调整电压为110 v 进行分离凝胶部分电泳,时间为90 min,之后利用聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)进行湿法转膜,进行凝胶-PVDF 膜蛋白转移,5% BSA 溶液进行1 h 封闭,一抗孵育,浓度为1:1000-1:2500,4℃摇床过夜,TBST 清洗液清洗5 次,1 次5 min,后进行二抗孵育,均都为1:2 000-1:5 000,室温摇床1 h,清洗后,通过增强的ECL 进行化学显色,令蛋白表达可视化,最终用Image J得到目的蛋白灰度值,并计算目的蛋白表达。
1.3 统计学方法使用SPSS 21.0、GraphPad Prism 8.0数据处理软件进行数据可视化、整理和分析,数据均以均数±标准差()表示,采用单向方差分析法、Turkey检验用于各组间比较,P<0.05 被认为差异具有统计学意义。
2 结果
2.1 湿热中阻方对脾胃湿热小鼠血清中胃肠激素表达的影响如表2 所示,与空白组比较,造模后,小鼠血清中GAS、MTL 含量表达下降,分别为65.81%、40.98%,具显著性差异(P<0.05)。在给予湿热中阻方后,GAS、MTL 表达抑制均得到改善,其中高剂量组抑制效果最佳,与模型组比较,分别回调65.99%和46.14%,且效果强于阳性药组,与阳性药组比较,高剂量组表达GAS 含量高于3.87%、MTL 含量高于2.97%,但数据间差异无统计学意义(P>0.05)。以上结果表明,湿热中阻方能显著性的改善脾胃湿热症状小鼠的胃肠激素表达水平,并且与剂量呈正相关,这与临床结果一致。
表2 小鼠血清中胃肠激素表达(,n=10) ng/L
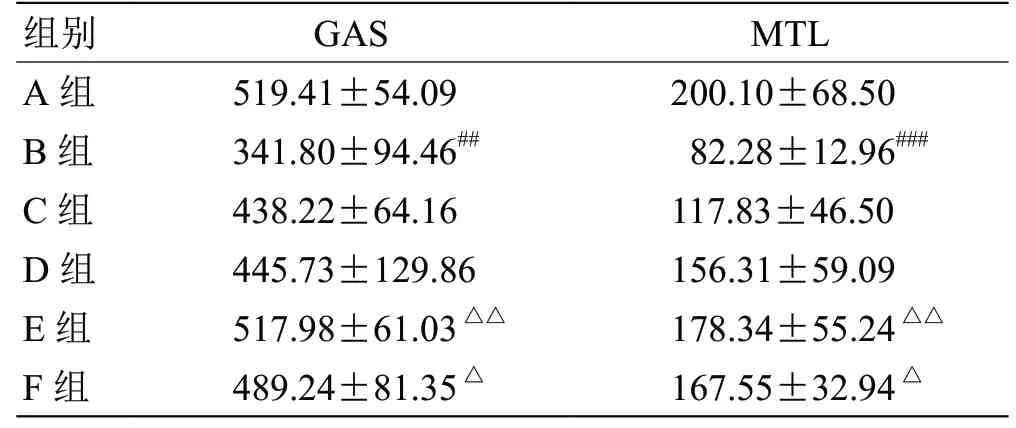
表2 小鼠血清中胃肠激素表达(,n=10) ng/L
注:与A 组比较,## P<0.01,### P<0.001;与B 组比较,△P<0.05,△△P<0.01
2.2 湿热中阻方对脾胃湿热小鼠胃组织形态学影响根据HE 染色结果,可看出空白组小鼠胃组织黏膜层结构完整,上皮细胞排列紧密,固有层胃腺丰富,未见炎症反应(图1-A)。而模型组胃组织黏膜层上皮细胞脱落(黑色箭头),固有层和黏膜下层可见少量炎性细胞浸润(图1-B);与模型组比较,胃组织黏膜层的上皮细胞脱落、固有层胃腺减少,主细胞、壁细胞形态结构异常,黏膜下层水肿、结缔组织排列疏松的情况,治疗药各组均有改善(图1-C、D、E),并且比对各治疗组后,发现随着湿热中阻方给药剂量增加,具有脾胃湿热症状的小鼠胃组织固有层和黏膜下层的淋巴细胞、肥大细胞与中性粒细胞浸润情况得到改善,但还是和阳性药组存在差距(图1-F)。
2.3 湿热中阻方对脾胃湿热小鼠胃组织中ERK、AKT mRNA 表达的影响由于阳性药仅是作为本文中湿热中阻方对脾胃湿热症状小鼠影响的对比,所以涉及药物对于疾病干预的生物学机制探讨,本文仅列出模型组与湿热中阻方的实验结果比较。实验结果如图3 所示,与空白组比较,造模后ERK mRNA、AKT mRNA表达升高1.8 倍和1.69 倍;与模型组比较,湿热中阻方各剂量组ERK 和AKT 的基因表达水平降低,并且与给药浓度有关系,其中低剂量组与模型组数据无明显差异。说明湿热中阻方是通过ERK/AKT 通路改善小鼠的脾胃湿热症状,且由实验结果可知,同模型组比较,给药后ERK mRNA 的表达显著性要高于AKT mRNA 的表达。

图2 小鼠胃组织中ERK、AKT mRNA 相对表达量
2.4 湿热中阻方对脾胃湿热小鼠胃组织中p-ERK、p-AKT 表达的影响为了进一步炎症ERK/AKT 通路是否参与湿热中阻方对脾胃湿热小鼠的影响,通过WB实验法检测小鼠胃组织中p-ERK、P-AKT 的蛋白表达,详见图3。根据图4 的数据可知,蛋白水平检测实验结果与基因水平相一致,患有脾胃湿热的小鼠在给予温热中阻方后,ERK 和AKT 蛋白磷酸化水平表达得到抑制,并且高剂量组的显著性要高于中、低剂量组(P<0.05)。经过实验验证后,本文中涉及蛋白质只通过磷酸化表达水平反应药物干预对通路的影响,且不涉及多通路间的交互作用,故此本文中不展示总蛋白表达实验结果,仅列出蛋白的磷酸化水平表达。以上表明,ERK/AKT 通路与改善脾胃病小鼠症状相关,并且根据已知文献报道,这可能与抑制肿瘤形成有关[10]。

图3 小鼠胃组织ERK 和p-AKT 的相对表达

图4 小鼠胃组织p-ERK 和p-AKT 的相对表达量
3 讨论
为探究湿热中阻方对脾胃湿热小鼠的影响,本实验分别从胃肠激素水平、基因水平、蛋白水平、病理学角度开展研究。脾胃湿热证由饮食内伤、湿热之邪引起,已有文章报道,脾胃湿热证多表现为胃炎急性发作阶段,这会损伤胃黏膜屏障,导致胃黏膜发生糜烂,这与本文HE 染色实验中有脾胃湿热症状的小鼠胃组织黏膜层病理学结果相一致,而当湿热中阻方作用后,不仅改善了小鼠的胃黏膜损伤时炎症反应症状,并且根据胃肠激素水平实验结果,相较于模型组,给药后GAS、MLT 的回调,说明了湿热中阻方可以改善脾胃湿热小鼠的肠激素水平,从而减轻患鼠病症。为了进一步探究胃组织的黏膜层、固有层损伤症状减轻、炎性细胞浸润减少是否与ERK/AKT 通路有关,本实验从基因水平、蛋白水平双重进行了实验,根据实验结果发现,较模型组比,湿热中阻方治疗后,ERK、AKTmRNA 的表达得到抑制,说明湿热中阻方改善脾胃湿热小鼠症状与ERK/AKT 有关,但是基因水平仅是代表DNA 中的某一编码蛋白质的片段[11],为了探讨分子机制,还应该从胞内蛋白质水平加以实验进行验证,实验结果表明一致。ERK 为脯氨酸导向的丝氨酸/苏氨酸激酶,从细胞受到刺激至细胞出现相应的生物学效应,这可能是通过MAPK 信号转导通路多级激酶的级联反应[12-13],与改善小鼠体内氧化应激环境有关[14],更多的关联性已经有文献报道,抑制活性氧会刺激PI3K/AKT/NF-κB活化,从而可以抑制炎症[15-16]。这与从基因水平检测得到的小鼠胃组织AKT mRNA 在治疗后被显著性抑制的实验结果是一致的,说明湿热中阻方改善脾胃湿热小鼠的症状能与炎症反应有关,AKT 的表达与细胞存活和凋亡有关[17],AKT 是经典炎症通路中NF-κB 因子的上游因子[18],AKT 磷酸化可以使IKBα 磷酸化、泛素化,从而导致NF-κB 活化并转移到核中,进行目的基因的转录,从而影响炎症反应,预防肿瘤类疾病的形成[19]。
综上所述,湿热中阻方改善脾胃湿热小鼠胃黏膜损伤以及炎症反应症状与ERK/AKT 通路有关,是通过从磷酸化水平抑制ERK、AKT 的相对表达从而不同程度的减少脾胃湿热引起的胃组织损伤,提高胃肠的正常生理能力,达到有效拮抗湿热所引发的胃肠疾病的效果。
