滁菊多酚的大孔树脂纯化工艺研究
2021-01-30安晓婷陈静戴缘缘谢小花
安晓婷, 陈静, 戴缘缘, 谢小花
滁菊多酚的大孔树脂纯化工艺研究
安晓婷, 陈静, 戴缘缘, 谢小花
(滁州职业技术学院 食品与环境工程学院, 安徽 滁州, 239000)
对5种树脂进行筛选, 结果AB-8树脂有较好的吸附和解吸性能, 可作为滁菊多酚的纯化树脂。AB-8树脂对滁菊多酚的吸附时间在2.5 h达到平衡, 解吸时间在1 h达到解吸平衡。优化A8-8树脂纯化条件, 得出最佳纯化工艺为滁菊多酚上样液浓度2.8 mg/mL、pH值5, 70%乙醇洗脱, 上样速率1 mL/min, 洗脱体积110 mL。滁菊多酚纯度由纯化前的13.18%提高到纯化后的67.52%。
滁菊; 多酚; 大孔树脂; 纯化
滁菊, 菊科植物, 是菊花中花瓣最为紧密的一种, 可药食两用, 安徽省著名地道药材, 也是4大名菊(滁菊、杭白菊、怀菊、亳菊)之一[1–2]。滁菊富含多酚、黄酮、多糖、氨基酸、挥发油等有效成分[3–7], 经研究发现, 其总多酚含量比其它种类的菊花高30%以上。滁菊的功效远远高于其他菊花, 具有较强的抗氧化、抑菌、提高免疫力、抗疲劳、降血压、调节血脂、降血糖等生理功能[8–11]。
大孔树脂是一种多孔微球吸附剂, 比表面积大, 理化性质稳定, 已被很多研究者用于植物多酚等功效物质的纯化。例如, 高海荣[12]等采用XDA-5制备茶多酚产品, 得率为10%, 纯度为70%; 李斌[13]等利用大孔树脂纯化黑果腺肋花楸多酚, 纯度由11.62%提高到64.37%; 蒋孟君等[14]利用大孔树脂纯化食用玫瑰花总酚, 纯化后能明显提高其抗氧化活性。目前关于滁菊多酚分离纯化的研究鲜有报道。试验从5种不同型号的大孔树脂中筛选出一种适合滁菊多酚分离纯化的树脂, 确定了滁菊多酚的最佳纯化条件, 以期为滁菊多酚的深度加工提供技术支持, 对滁菊的综合利用具有重要意义。
1 材料与方法
1.1 主要材料与试剂
滁菊干花粉末(安徽菊泰滁菊草本科技有限公司), 干燥、粉碎, 过 60 目筛备用; 福林酚试剂、没食子酸标准品(国药集团化学试剂有限公司); 大孔树脂D101、DM-2、AB-8、XAD-7、HPD400(上海昕沪实验设备有限公司); 95%乙醇、三氯化铁、无水碳酸钠(南京化学试剂股份有限公司), 均为分析纯。
1.2 主要仪器与设备
304不锈钢粉碎机(永康市铂欧五金制品有限公司); PX224ZH/E型电子天平(奥豪斯仪器(常州)有限公司); 雷磁PHS-25 pH计(上海仪电科学仪器股份有限公司); TU-1950型分光光度计(北京普析通用仪器有限责任公司); BT100-2J恒流泵(保定格兰恒流泵有限公司); SHZ-D型循环水式多用真空泵(河南省予华仪器有限公司)。
1.3 试验方法
1.3.1 滁菊多酚提取液的制备
取一定量滁菊粉末按1︰20料液比加入 60%乙醇, 60 ℃震荡提取1.5 h, 中速离心0.5 h, 旋转蒸发除去乙醇, 冷冻干燥, 得到滁菊多酚粗提物固体粉末, 测定滁菊多酚质量浓度, 备用。
1.3.2 滁菊多酚质量浓度的测定
采用蔡义忠等改进的福林酚比色法[15], 用80%乙醇将没食子酸储备液稀释为0、20、40、60、80、100 mg/L的没食子酸标准系列。分别取0.2 mL于6支试管中, 加入0.5 mol/L 福林酚试剂2 mL, 摇匀后在室温下静置4 min, 再加入75 g/L碳酸钠溶液2 mL, 摇匀后于暗处反应2 h; 在760 nm波长下测定吸光度值, 绘制标准曲线, 得到回归方程为= 0.006+ 0.0039,2= 0.9975。取适当过滤并稀释的样品溶液(0.2 mL)在相同条件下测定吸光值, 滁菊多酚质量浓度以没食子酸浓度表示, 单位mg/mL。
1.3.3 滁菊多酚纯度的测定
取一定体积(, mL)一定滁菊多酚质量浓度(, mg/mL)的粗提液与纯化后的洗脱液, 低温蒸干, 冻干, 称重(, mg), 多酚纯度(%) = (/)×100。
1.3.4 大孔树脂的预处理
称取5种新树脂各100 g分别倒入300 mL烧杯中, 每个烧杯加入95%乙醇200 mL浸泡24 h, 接着用纯净水将树脂洗到没有白色, 也没有乙醇味; 再加入5% HCL溶液 200 mL浸泡12 h, 用纯净水冲洗直到pH呈中性; 然后加入5% NaOH溶液200 mL浸泡12 h, 用纯净水清洗到中性; 最后把各种处理完毕的大孔树脂装入具塞锥形瓶中, 加入纯净水浸泡待用[16]。
1.3.5 大孔树脂的筛选
把经过预处理的5种树脂用真空泵抽滤除去水分, 再分别称取5.0 g()抽干的树脂于5个250 mL的锥形瓶中, 各加入50 mL(1)滁菊多酚浓度为2.5 mg/mL(0)样液, 放入恒温振荡器中室温震荡吸附12 h, 取200 μL上清液测定滁菊多酚质量浓度(C1); 用纯净水将充分吸附的各种树脂表面的残留粗提液洗净, 用滤纸擦干, 再分别加入80%乙醇溶液50 mL(2)解吸12 h, 取少量解吸液测定滁菊多酚质量浓度(2), 按照下面的公式计算吸附量、吸附率、解吸率, 筛选出适合纯化滁菊多酚的树脂[17]。= (0-1)×1/,(%) = ((0-1)/0)×100,(%) = ((0×1)/0)×100,(%) = (2×2)/(×)×100。
1.3.6 动力学曲线的绘制
把预处理好的AB-8树脂抽干, 称取5.0 g于250 mL锥形瓶中, 加入2.5 mg/mL滁菊多酚粗提液50 mL, 放入恒温振荡器中震荡吸附4 h, 每隔0.5 h取200 μL上清液测定滁菊多酚质量浓度, 考察吸附量随吸附时间的动态变化。将上述吸附饱和的树脂用纯净水清净表面残留的粗提液, 滤纸吸干, 加入80%乙醇溶液50 mL, 于25 ℃恒温振荡器中震荡吸附4 h, 分别在0.5、1.0、1.5、2.0、2.5、3.0、3.5、4 h时取少量解吸液测定解吸率, 以解吸时间为横坐标解吸率为纵坐标绘制AB-8树脂的解吸动力学曲线。
1.3.7 静态试验条件优化
上样多酚质量浓度: 取5.0 g抽干的AB-8树脂于250 mL锥形瓶, 各加入滁菊多酚浓度1.6、2.0、2.4、2.8、3.2、3.6、4.0 mg/mL的样液50 mL, 室温震荡2.5 h, 各取200 μL上清液测定滁菊多酚质量浓度, 考察其对吸附量的影响。
上样pH: 取5.0 g抽干的AB-8树脂于250 mL锥形瓶, 各加入滁菊多酚浓度2.8 mg/mL、pH分别为3.5、4.0、4.5、5.0、5.5、6.0的样液50 mL, 室温振荡2.5 h, 测定平衡滁菊多酚质量浓度, 并计算吸附量。
乙醇体积分数: 在6个250 mL锥形瓶中各加入5.0 g吸附饱和的AB-8树脂, 再分别加入40%、50%、60%、70%、80%、90%乙醇溶液50 mL, 室温振荡, 解吸1 h, 计算解吸率。
1.3.8 动态试验条件优化
上样流速: 采用湿法装柱, 将AB-8树脂装入1.0 cm×60 cm的层析柱, 分别以1、2、3 mL/min流速将多酚浓度2.8 mg/mL、pH 5.0的样液进行上样, 收集流出液, 10mL/管并测定滁菊多酚质量浓度, 考察其对吸附效果的影响。
洗脱体积: 当柱内树脂吸附饱和后, 用纯净水冲洗杂质, 再用70%乙醇溶液洗脱, 收集洗脱液, 10mL/管并测定滁菊多酚质量浓度, 考察其对洗脱效果的影响。
2 结果与分析
2.1 大孔树脂的筛选
D101、DM-2、AB-8、XAD-7、HPD400树脂的静态吸附与解吸能力见表1。DM-2和AB-8树脂的吸附量相差不大, 分别为22.42、22.83 mg/g, 明显高于其他3种树脂; AB-8树脂的吸附率为91.3%, 显著高于其他4种树脂; 5种树脂中AB-8和XAD-7树脂的解吸率较高, 分别为90.25%、90.54%。AB-8树脂为弱极性吸附树脂, 对弱极性的滁菊多酚具有良好的选择吸附性, 并且用弱极性的有机溶剂可以将滁菊多酚很好地解吸下来, 综合分析, 选择AB-8树脂作为滁菊多酚的纯化树脂。
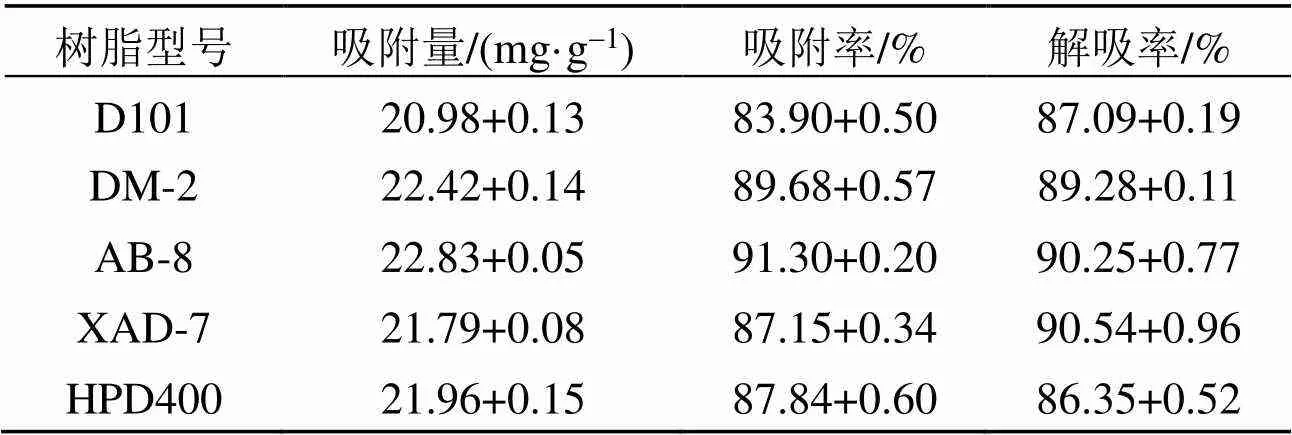
表1 大孔树脂的吸
2.2 静态吸附和解吸动力学曲线
静态动力学曲线展示的是随时间的增加树脂对滁菊多酚吸附和解吸能力的变化。由图1可知, 在2.5 h之前, AB-8树脂对滁菊多酚的吸附量不断增加, 超过2.5 h, 吸附能力趋于平衡。由图2可知, 解吸时间在1 h时AB-8树脂的解吸率达到最大, 在1 h以后解吸达到动态平衡。因此, AB-8树脂对滁菊多酚的吸附时间为2.5 h, 解吸时间为1 h。

图1 静态吸附动力学曲线
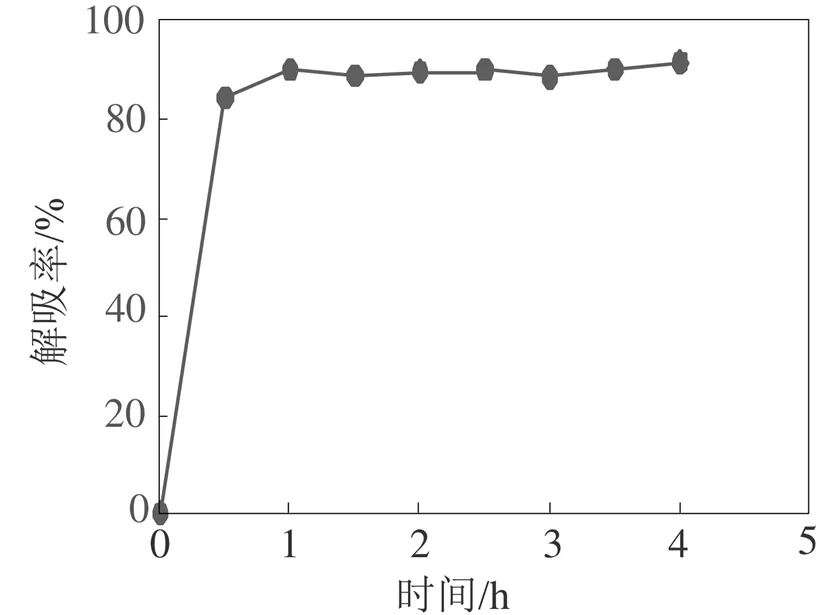
图2 静态解吸附动力学曲线
2.3 纯化条件的优化
2.3.1 滁菊多酚上样浓度的影响
上样浓度过小树脂不容易吸附饱和, 上样浓度过大又可能堵塞树脂微小的孔径, 不利于树脂对溶质的吸附。如图3所示, 随着滁菊多酚上样浓度的增大吸附量先升高后降低, 滁菊多酚上样液浓度在2.8 mg/mL时吸附量达到最大值25.75 mg/g, 此滁菊多酚浓度可作为上样浓度。
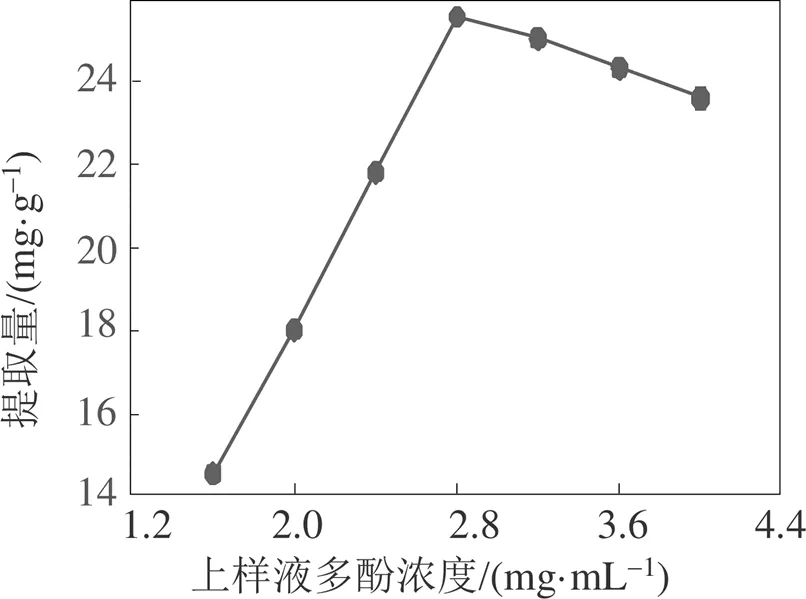
图3 滁菊多酚上样液浓度的影响
2.3.2 滁菊多酚上样pH的影响
样液的酸碱性会影响多酚的存在形式和溶液的极性[17]。由图4可知, 随滁菊多酚上样pH值增大AB-8树脂对滁菊多酚的吸附效果先增强后减弱, pH值为5时吸附效果最佳, 这可能是因为滁菊多酚含有大量酚羟基, 呈弱酸性, 在pH值为5时更有利于多酚的解离, 并增强和大孔树脂间的分子作用力。
2.3.3 乙醇体积分数的影响
洗脱剂浓度不同, 溶液极性发生改变, 影响多酚与树脂间的分子作用力, 进而影响解吸效果。由图5可知, 随乙醇体积分数增大AB-8树脂对滁菊多酚的解吸效果先增强后减弱, 70%乙醇解吸效果最佳。
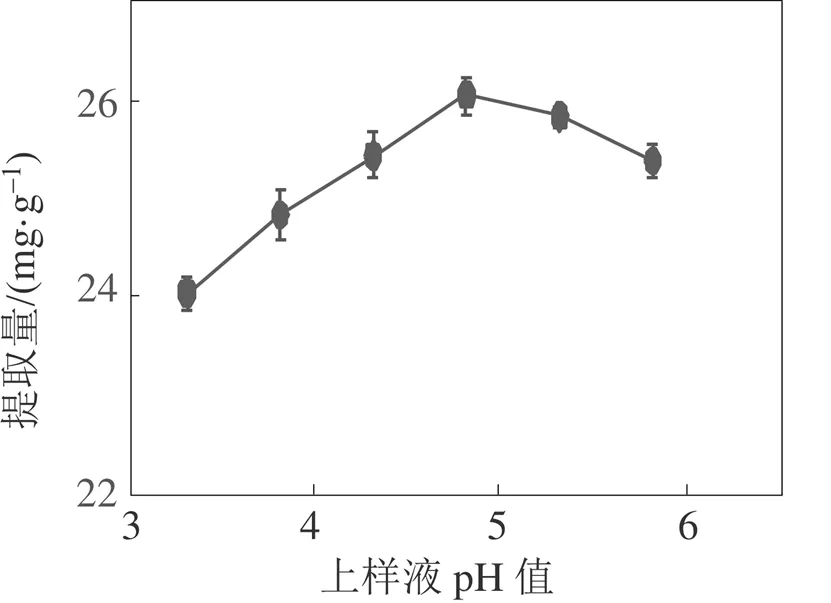
图4 滁菊多酚上样液pH对提取量的影响
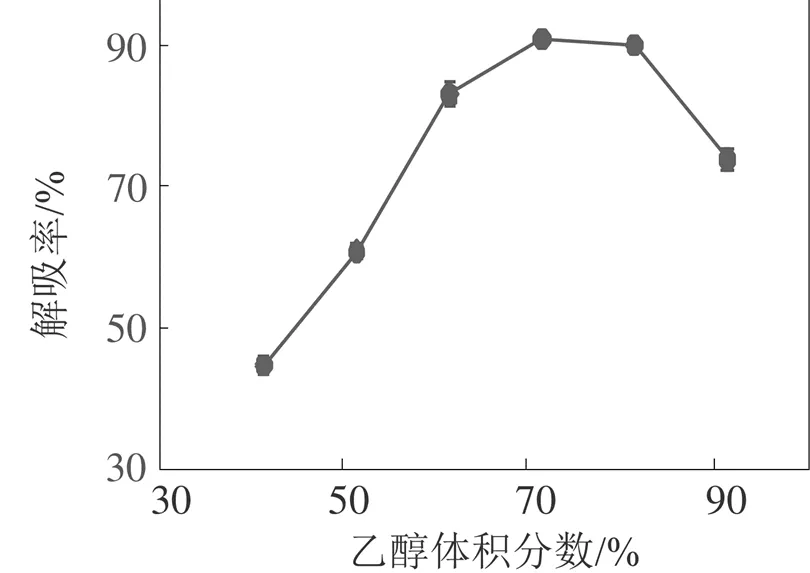
图5 乙醇体积分数对解吸率的影响
2.3.4 上样流速的影响
在动态上样时当流出液多酚质量浓度为上样浓度的1/10时即到达泄露点, 上样流速越大, 泄漏点出现的越早。由图6可知, 上样流速分别是1、2、3 mL/min时, 泄漏点分别出现在220、170、140 mL附近, 为了使树脂能够充分吸附滁菊多酚, 减少滁菊多酚的损失, 上样流速选择1 mL/min。
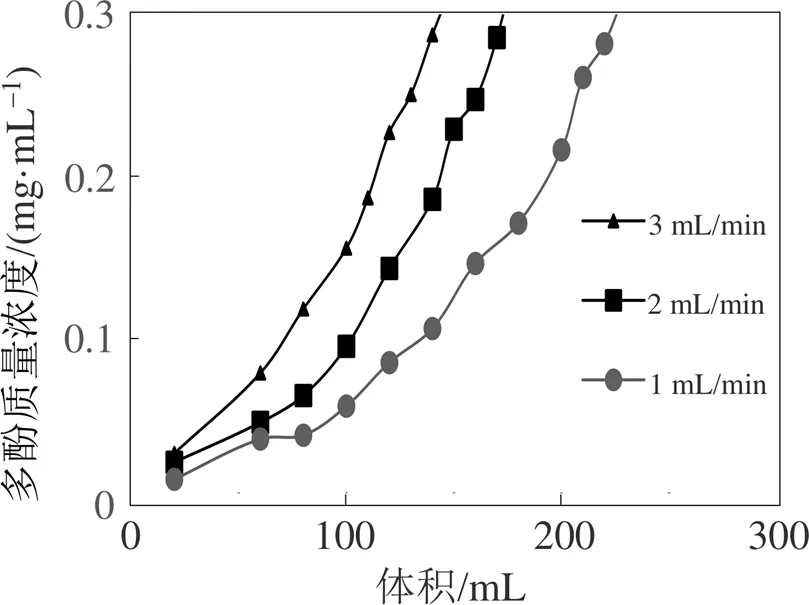
图6 流速对多酚质量浓度的影响
2.3.5 洗脱体积的确定
用70%的乙醇溶液对树脂进行动态洗脱(见图7), 洗脱曲线峰形较窄且拖尾不明显, 说明滁菊多酚非常容易洗脱, 洗脱体积在0~40 mL时, 滁菊多酚质量浓度迅速增加, 洗脱体积在40~110 mL时滁菊多酚质量浓度不断降低, 洗脱体积在110 mL时, 滁菊多酚几乎全部被洗脱下来。为了节约溶剂, 综合考虑洗脱体积选择110 mL。
2.4 多酚纯度的计算
采用得到的最佳纯化工艺制备滁菊多酚, 再利用滁菊多酚纯度计算公式得出滁菊多酚经AB-8树脂纯化后纯度由13.18%提高到67.52%, 表明AB-8树脂对滁菊中的多酚类化合物的纯化效果较好。
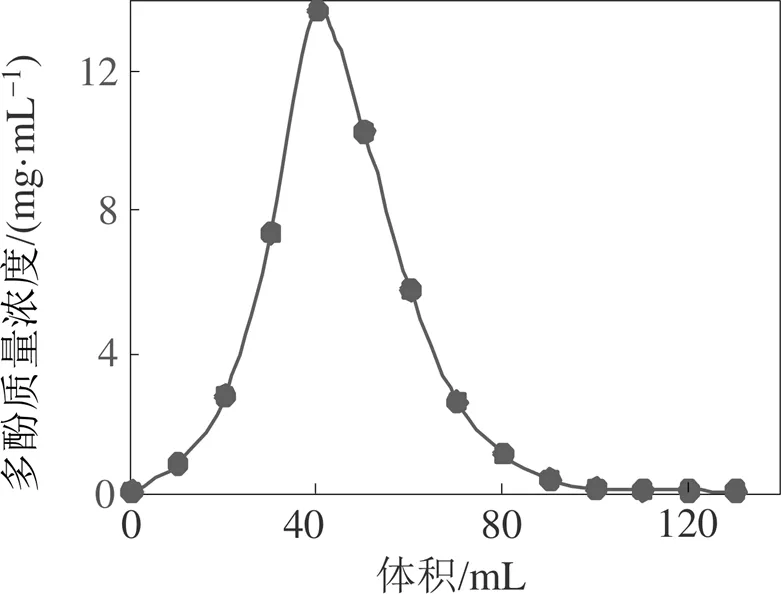
图7 滁菊多酚洗脱曲线
3 结论
从5种不同型号的大孔树脂中筛选出AB-8树脂比较适合用来纯化滁菊多酚, 并且AB-8树脂具有较短的吸附时间和解吸时间。AB-8树脂的最佳纯化条件为滁菊多酚上样浓度2.8 mg/mL、pH=5, 乙醇体积分数70%, 上样流速1 mL/min, 洗脱体积110 mL。在此条件下, 滁菊多酚纯度由13.18%提高到67.52%。
[1] 国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2010: 231–240.
[2] 于士军, 王伟, 孙辉, 等. 滁菊的HPLC指纹图谱制作及其化学计量学分析[J]. 生物资源, 2017, 39(3): 185–191.
[3] 谢越, 俞浩, 汪建飞, 等. 高效液相色谱法同时测定滁菊样品中的9种酚酸[J]. 分析化学, 2013, 41(3): 383–388.
[4] 孙艳辉, 李波, 吴霖生. 同步荧光光谱法测定滁菊总黄酮含量[J]. 食品科技, 2011, 36(5): 283–290.
[5] 于士军, 王睿, 祁婉玲, 等. 响应面法优化超声波提取滁菊水溶性多糖工艺及其红外光谱分析[J]. 安徽农业大学学报, 2019, 46(4): 595–602.
[6] 吴霖生, 潘升玲, 孙艳辉, 等. 同步荧光光谱法测定滁菊中氨基酸总量[J]. 理化检验(化学分册), 2015, 51(2): 180– 183.
[7] 何晓伟, 张汆. 滁菊挥发油成分分析及其应用研究进展[J]. 中国食品添加剂, 2019(9): 182–186.
[8] 詹歌, 孙艳辉, 严佳慧, 等. 干燥方式对滁菊抗氧化、抑菌活性和挥发性风味物质的影响[J]. 食品与机械, 2018, 34(11): 193–199.
[9] 李世光, 龚建国, 张涛, 等. 滁菊降血压改善临床症状的研究[J]. 中医临床研究, 2013, 5(7): 22–23.
[10] 董克江, 刘均涛, 陈岩, 等. 滁菊水提物对肥胖症及血脂异常的预防作用[J]. 食品研究与开发, 2014, 35(4): 101–104.
[11] 俞浩, 张孝林, 熊友谊, 等. 滁菊总黄酮和白背三七总黄酮配伍对糖尿病血瘀证大鼠血糖及血液流变学的影响[J]. 中成药, 2014, 36(4): 830–834.
[12] 高海荣, 王亚鑫, 谢晨, 等. XDA-5大孔树脂分离茶叶中茶多酚工艺优化[J]. 中国食品添加剂, 2019(11): 67–72.
[13] 李斌, 高凝轩, 刘辉, 等. 大孔树脂纯化黑果腺肋花楸多酚的工艺优化[J]. 食品科学, 2016, 37(16): 69–74.
[14] 蒋孟君, 王艺, 任建青, 等. 超声提取食用玫瑰花总酚及其大孔树脂纯化前后抗氧化活性[J]. 食品工业科技, 2017, 38(23): 164–166.
[15] Cai Y Z, Luo Q, Sun M, et al. Antioxidant activity and phenolic compounds of traditional Chinese medicinal plants associated with anticancer [J]. Life Sciences, 2004, 74(17): 2 157–2 184.
[16] 朱怡霖, 张海生, 赵鑫帅, 等. 大孔树脂分离纯化横山老黑豆酚类物质[J]. 食品与生物技术学报, 2019, 38(9): 103– 110.
[17] 张卉, 王亚茹, 刘洋峰. XAD-7型大孔树脂纯化黑果腺肋花楸多酚条件优化[J]. 食品研究与开发, 2019, 40(8): 159– 163.
Optimization on purification process of polyphenols from Chuju chrysanthemum by macroporous resin
An Xiaoting, Chen Jing, Dai Yuanyuan, Xie Xiaohua
(College of Food and Environment, Chuzhou Vocational and Technical College, Chuzhou 239000, China)
The purification effects of five macroporous resins are investigated. The results indicated that AB-8 resin has good adsorption and desorption properties, so it is very suitable to purify polyphenolsfrom Chuju chrysanthe- mum. The adsorption time of AB-8 resin reaches the adsorption equilibrium at 2.5 h, and the desorption time reaches analytical equilibrium at 1 h. The purification conditions of AB-8 resin are optimized, and the optimal purification conditions are listed as that concentration of polyphenols and pH are 2.8 mg/mL and 5, ethanol concentration is 70%, feeding rate is 1.0 mL/min, elution is 110 mL. After purification, the purity of polyphenols increases from 13.18% to 67.52%.
Chuju; polyphenols; macroporous resin; purification
10.3969/j.issn.1672–6146.2021.01.006
S 609.9
A
1672–6146(2021)01–0025–05
谢小花, 258080778@qq.com。
2020–06–08
安徽省教育厅高校自然科学研究项目(kj2018a0841); 安徽省大规模在线开放课程示范项目(2018mooc179)。
(责任编校: 刘刚毅)
