酶解时间对罗非鱼鱼皮胶原蛋白酶解物抗氧化活性的影响
2021-01-30王晴石程宇钱玉梅李红侠陈红玲陈嶍嶍曹稳根
王晴, 石程宇, 钱玉梅, 李红侠, 陈红玲, 陈嶍嶍, 曹稳根
酶解时间对罗非鱼鱼皮胶原蛋白酶解物抗氧化活性的影响
王晴, 石程宇, 钱玉梅, 李红侠, 陈红玲, 陈嶍嶍, 曹稳根
(宿州学院 生物与食品工程学院,安徽 宿州, 234000)
为了探究酶解时间对罗非鱼鱼皮胶原蛋白酶解物抗氧化活性的影响, 采用酸法提取罗非鱼鱼皮胶原蛋白, 胃蛋白酶酶解3、6、9、12和24 h制备酶解物, 进行紫外光谱扫描, 水解度测定, 以DPPH·、·OH和O2-·清除率为指标评价抗氧化活性。结果表明: 最大紫外吸收峰相似, 水解度与酶解时间呈正相关; 9 h酶解物对三种自由基清除效果最好; 罗非鱼鱼皮胶原蛋白酶解物抗氧化活性与酶解时间有关, 为罗非鱼鱼皮进一步加工利用提供理论依据。
罗非鱼鱼皮; 胶原蛋白; 酶解; 抗氧化活性
鱼类来源胶原蛋白相比于哺乳动物来源的胶原蛋白具有生物安全性更高、材料来源更广、生产成本更低廉等优势[1], 因此近年来人们对胶原蛋白来源的研究逐渐从哺乳动物转移到鱼类上。罗非鱼俗称非洲鲫鱼、越南鱼等, 属鲈形目丽鱼科罗非鱼属。该属种类众多, 共有600多个品种, 到如今人工养殖的大约有十五种。我国从1957年起逐渐引进了十多个品种的罗非鱼, 如: 红罗非鱼, 奥里亚罗非鱼, 尼罗罗非鱼和莫桑比克罗非鱼等。罗非鱼日益受到大众的欢迎, 它的消费量增加迅速[2]。中国是世界上最大的罗非鱼养殖国, 也是最大的罗非鱼出口国, 罗非鱼及其加工制品已经成为我国沿海地区的主要淡水产品。其中, 冷冻罗非鱼片、鱼排的出口增长尤其迅速, 由此也产生了大量鱼皮、鱼骨、鱼鳞、内脏等副产物[3], 其中罗非鱼鱼皮中胶原蛋白含量高且脂肪含量低, 具有较高利用价值。
胶原蛋白酶解产物中有大量胶原蛋白活性肽。肽是由氨基酸组成的蛋白质亚单位, 通常含10个以上氨基酸残基(<50个)的肽被称为多肽, 而含10个以下的称为寡肽或低聚肽[4–5]。活性肽是一千多种含生理功能的肽的总称, 其分子相对于蛋白质小得多故人体的消化吸收率达到99%以上。胶原蛋白活性肽主要有抗氧化、清除自由基, 提高机体免疫力, 维持内分泌系统稳定性, 促进脑细胞修复与营养, 抗高血压和高血脂等生理功能[6]。同时胶原蛋白活性肽还具有较好的稳定性可以作为食品、药品及化妆品等的功能因子。
张寒俊[7]等用碱性蛋白酶酶解罗非鱼鱼皮, 并测定了酶解液对羟自由基的清除能力, 结果表明, 当水解度大于4%时, 清除率超过80%; 王成成[8]等用5种蛋白酶酶解罗非鱼鱼皮胶原蛋白60 min及120 min制成明胶肽, 综合评价后发现酶解60 min的明胶肽活性大于酶解120 min的明胶肽的活性; 朱静静[9]等对胶原蛋白进行二次酶解, 发现碱性蛋白酶经二次酶解所得产物抗氧化活性较好。综上表明, 胶原蛋白酶解产物的抗氧化活性跟其酶解条件有关, 其中关于酶解时间对胶原蛋白酶解物抗氧化活性的影响尚未见报告。
本文以罗非鱼鱼皮为原料, 采用酸法提取胶原蛋白, 利用胃蛋白酶分别酶解3、6、9、12 h和24 h制备酶解物。测定不同酶解时间下胶原蛋白酶解物的紫外吸收光谱与水解度, 通过DPPH·、·OH、O2-·清除率探究酶解时间对罗非鱼鱼皮胶原蛋白酶解物抗氧化活性的影响, 以期为罗非鱼鱼皮商业价值开发与罗非鱼鱼皮胶原蛋白的进一步利用提供一些理论依据。
1 材料与方法
1.1 材料与试剂
罗非鱼鱼皮(江苏省连云港市非凡水产公司); 胃蛋白酶、羟脯氨酸, 分析纯(安徽省合肥市博美生物科技有限公司); DPPH(福建省福州市飞净生物科技有限公司); 磷酸氢二钠、磷酸二氢钠、氯胺T、对二甲氨基苯甲醛、氢氧化钠、胃蛋白酶、硫酸亚铁、邻菲罗啉、焦性没食子酸、甘氨酸、酪蛋白、乙酸、过氧化氢、无水乙醇、正丁醇, 均为分析纯(上海国药集团化学试剂有限公司)。
1.2 仪器与设备
HH-2恒温水浴锅(江苏省金坛市荣华仪器制造有限公司); FA1104B电子天平(上海越平科学仪器有限公司); SP-723紫外—分光光度计(上海光谱仪器有限公司); SC-3612台式离心机(江苏荣华仪器制造有限公司); SHZ_D(Ⅲ)循环水式真空泵(巩义市予华仪器有限公司); FD-1C-50真空冷冻干燥机(北京博医康实验仪器有限公司)。
1.3 实验方法
1.3.1 罗非鱼鱼皮预处理
将罗非鱼鱼皮剪成2 cm × 2 cm的小块, 去除杂质并粉碎。将处理后的鱼皮用0.1 mol/L氢氧化钠溶液浸泡24 h, 纯水清洗至中性。后使用体积分数为10%的正丁醇溶液浸泡24 h, 纯水清洗至中性。最后使用75%乙醇溶液浸泡24 h, 纯水清洗, 烘干备用。
1.3.2 鱼皮胶原蛋白提取
采用酸法提取罗非鱼鱼皮胶原蛋白[10–11]。按照1︰20的料液比将经预处理的鱼皮于0.5 mol/L乙酸溶液中浸泡24 h, 将上述浸提液6 000 r/min离心20 min, 舍弃沉淀。取上清液于10倍体积0.1 mol/L的乙酸溶液中透析48 h, 每8 h更换1次透析液。再以10倍体积的蒸馏水透析24 h, 每8 h更换1次透析液, 透析至中性。所得胶原蛋白提取液冷冻干燥得罗非鱼鱼皮胶原蛋白, 于4 ℃封闭冷藏备用。
1.3.3 罗非鱼鱼皮胶原蛋白含量测定
羟脯氨酸为胶原蛋白所独有的氨基酸, 一般其含量约为胶原蛋白干重14%。若胶原蛋白来源为陆生动物, 则换算系数为7.1, 若来源为水生动物换算系数为11.1。本文采用羟脯氨酸比色法测定胶原蛋白含量[12]。
(1) 羟脯氨酸标曲绘制。吸取羟脯氨酸标准工作液加蒸馏水定容稀释至不同浓度。取上述标准工作液4 mL加2 mL 0.05 mol/L的氯胺T溶液, 于室温下静置20 min。再加入2 mL对二甲氨基苯甲醛, 均匀混合后加塞, 于60 ℃水浴锅中显色20 min。取出冷水浴至室温, 再次静置30 min后在560 nm处测定吸光度, 以纯水作空白管。以浓度为横坐标, 以吸光度为纵坐标绘制标准曲线, 得到回归方程。
(2) 胶原蛋白含量测定。准确称取待测样品1 g于圆底烧瓶, 加入50 mL6 mol/L盐酸, 于120 ℃干燥箱中水解16 h。利用滤纸将水解产物滤至100 mL容量瓶, 加纯水定容。再取其中1 mL, 定容至100 mL, 调节pH = 6.0, 摇匀备用。按上述标曲绘制步骤, 测定样品吸光度, 带入回归方程可得稀释后的羟脯氨酸浓度。即得样品中得胶原蛋白含量(%) = (羟脯氨酸浓度× 稀释倍数× 11.1/样品质量) × 100。
(3) 胶原蛋白提取率测定。胶原蛋白提取率(%) = (1×1/(2×2)) × 100。其中:1为成品质量(g);2为原材料质量(g);1为成品胶原蛋白含量(%);2为原材料胶原蛋白含量(%)。
1.3.4 不同酶解时间罗非鱼鱼皮胶原蛋白酶解物的制备
称取罗非鱼鱼皮胶原蛋白, 溶解于磷酸盐缓冲溶液, 制成底物质量浓度为0.05 g/mL胶原蛋白溶液。在37 ℃、pH值为5.0、加酶量5%的条件下, 使用胃蛋白酶分别酶解时间3、6、9、12、24 h。然后于90 ℃灭酶10 min, 冷却后再次冷冻干燥, 即得不同酶解时间下的罗非鱼鱼皮胶原蛋白酶解物, 于4 ℃贮藏备用。
1.3.5 紫外吸收光谱扫描
紫外吸收光谱法是一种常用的有机分析方法, 广泛地应用于有机化合物定性、定量或结构鉴定。其具体操作为, 在室温条件下取0.1 g不同酶解时间的罗非鱼鱼皮胶原蛋白酶解物溶解于200 mL 0.5 mol/L醋酸溶液中, 于紫外—可见光分光光度计上测定样品在200~400 nm范围内的吸光度, 绘制紫外吸收曲线。
1.3.6 测定不同酶解时间胶原蛋白酶解物水解度
采用茚三酮比色法测定不同酶解时间下罗非鱼鱼皮胶原蛋白酶解的水解度DH[8]。其原理是蛋白质或多肽中游离氨基可与水合茚三酮共热产生蓝紫色化合物, 且在一定浓度范围内其颜色的深浅与游离氨基酸含量成正比。其具体操作为, 首先以甘氨酸为标准氨基酸绘制标准曲线, 然后取0.4 mL稀释一定倍数的酶解液加蒸馏水1.6 mL、茚三酮1 mL均匀混合后于水浴锅中沸水浴15 min, 最后取出冷水浴至室温, 于570 nm处测定吸光度, 参考标准曲线计算游离氨基含量H(%) = ((-)/) × 100。其中:为酶解液中游离氨基含量;为胶原蛋白溶液中游离氨基含量;为强酸水解胶原蛋白溶液后游离氨基含量。
1.3.7 不同酶解时间胶原蛋白酶解物抗氧化活性
(1) 罗非鱼鱼皮胶原蛋白酶解物对DPPH·的清除能力。参考尹利端等[13]的测定方法, 并在其基础上适当改动。取不同酶解时间的罗非鱼鱼皮胶原蛋白酶解物用磷酸盐缓冲液配制成质量浓度为1.0、1.5、2.0、2.5、3.0 mg/mL的溶液作为样品组。取2 mL样品溶液加入2 mL的DPPH·无水乙醇溶液(2 mmol/L)于具塞试管中迅速摇匀, 室温条件下避光反应30 min。样品液于517 nm处测定吸光度, 记为S。以同体积纯水与同体积DPPH·无水乙醇溶液混合液测得吸光度A0。同时, 以同体积纯水与同体积无水乙醇混合液测得吸光度B。样品清除DPPH自由基的能力以吸光度值的变化作为判断依据[14]。每组试验重复3次, 所得数据代入计算DPPH清除率=[1-(S-B)/0] × 100%。
(2) 罗非鱼鱼皮胶原蛋白酶解物对·OH的清除能力。参考文献[15]的测定方法, 并在其基础上适当改动, 取不同酶解时间的罗非鱼鱼皮胶原蛋白酶解物以磷酸盐缓冲液配制成质量浓度为2、4、6、8、10 mg/mL的溶液作为样品组。将0.3 mL邻菲罗啉溶液(1.5 mmol/L), 0.6 mL磷酸盐缓冲液(0.2 mol/L, pH=8), 0.3 mL纯水与0.3 mL硫酸亚铁溶液(0.75 mmol/L)加入试管中, 充分混匀。再加入0.3 mL过氧化氢溶液(2 mmol/L), 于室温下反应45 min。再536 nm下测定吸光度, 记为B。用等体积纯水代替过氧化氢溶液为空白组, 测得吸光度0。用等体积样品溶液代替纯水, 测得吸光度记S。每组试验重复3次, 所得羟自由基清除率=(S-0)/(B-0) × 100%。
(3) 罗非鱼鱼皮胶原蛋白酶解物对O2-·的清除能力。参考张韫等[16]的测定方法, 并在其基础上适当改动。将不同酶解时间的罗非鱼鱼皮胶原蛋白酶解物用磷酸盐缓冲液配制成质量浓度为5、10、15、20、25 mg/mL的溶液作为样品组。取1 mL样品溶液与4.5 mL Tris-HCl缓冲液(0.1 mol/L, pH=8.0)混合, 置于25 ℃水浴锅中预热20 min。后加入同样25 ℃预热的焦性没食子酸溶液(45 mmol/L) 0.4 mL, 充分混合后再置于25 ℃水浴锅中反应5 min。加入0.1 mL盐酸(8 mmol/L)作为反应终止剂。样品液于320 nm下测定吸光度为1。以等体积纯水代替样品液作为空白组测得吸光度为0。每组试验重复3次。按下列公式计算超氧自由基清除率(%) = (0-1)/0× 100。
2 结果与分析
2.1 罗非鱼鱼皮中胶原蛋白含量及提取率
通过羟脯氨酸标准曲线(图1)计算得表1, 胶原蛋白提取率= (15.159 × 86.43)/(30.015 × 57.12%) × 100% = 76.42%。该数据表明, 干燥后得罗非鱼鱼皮中胶原蛋白含量达57.12%, 是一种较好的胶原蛋白提取原材料。使用酸法提取罗非鱼鱼皮胶原蛋白纯度较高达86.43%, 其提取率约为76.42%。
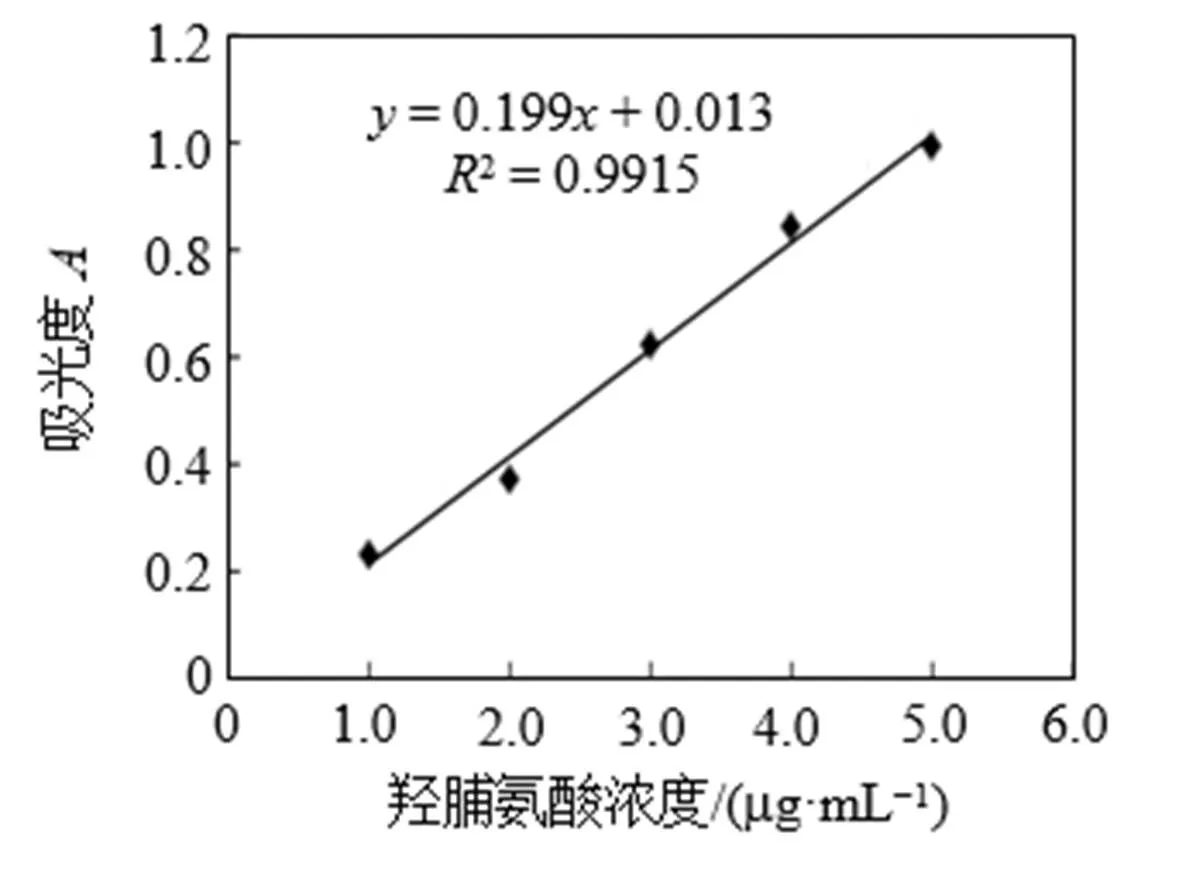
图1 羟脯氨酸标准曲线

表1 胶原蛋白含量
2.2 紫外吸收光谱分析
通常, 胶原蛋白肽中的氨基酸残基或其他次级键可在210~250 nm的波长范围内产生吸收峰, 肽键可在210 nm以下波长范围产生吸收峰, 芳香族氨基酸残基可在250~280 nm波长范围内产生吸收峰[17]。由图2罗非鱼鱼皮胶原蛋白酶解物的紫外吸收光谱可知, 这5组样品的吸收峰均处于225 nm 左右。其中酶解时间为24 h组吸收峰出现在220 nm 处, 12 h组吸收峰出现在224 nm处, 9 h和6 h组吸收峰出现在225 nm处, 3 h组的最大紫外吸收峰在228 nm处。已知色氨酸和酪氨酸最大紫外吸收峰分别在280 nm左右, 苯丙氨酸最大紫外吸收峰在250 nm左右, 胶原蛋白几乎不含色氨酸。由上述结果可推断本试验提取得罗非鱼鱼皮胶原蛋白纯度较高, 为典型胶原蛋白。
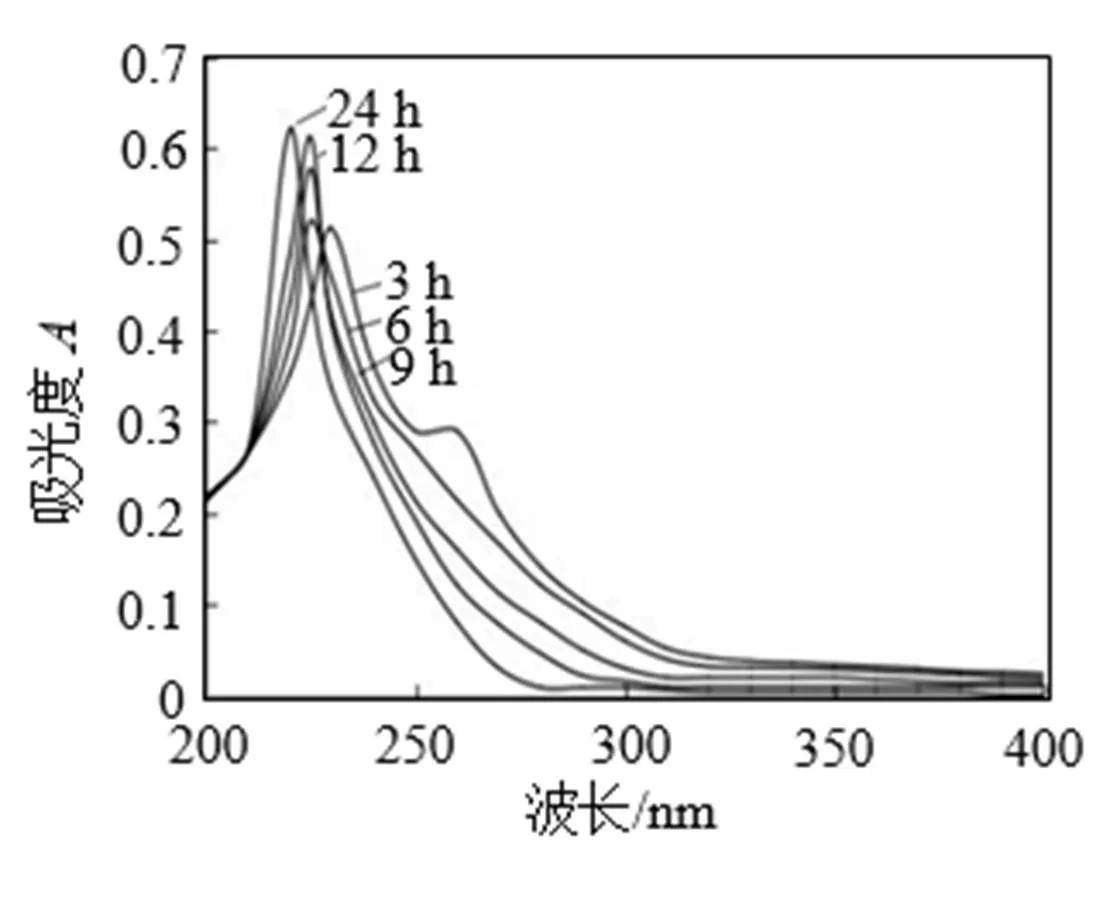
图2 不同酶解时间罗非鱼鱼皮胶原蛋白酶解物紫外吸收光谱
2.3 不同酶解时间胶原蛋白酶解物水解度
蛋白质水解度DH是大分子蛋白质受生物或化学因素影响而被水解的肽键占分子总肽键的百分比。由图3可知, 随着酶解时间的增长罗非鱼胶原蛋白水解度不断增长, 且增长趋势逐渐趋于平缓。酶解时间从长到短, 这5组样品组的水解度分别为: 0.96%、2.37%、5.13%、5.61%、5.95%。

图3 不同酶解时间罗非鱼鱼皮胶原蛋白水解度
2.4 不同酶解时间胶原蛋白酶解物抗氧化活性
2.4.1 DPPH·清除能力
由图4可知, 这5组酶解时间不同的罗非鱼鱼皮胶原蛋白酶解物都具备一定的DPPH自由基清除能力, 且其对DPPH自由基的清除能力与样液质量浓度成正相关, 各样品组均于试验最大浓度质量处达到最大清除率。其中, 以酶解时间为9 h制备的罗非鱼鱼皮胶原蛋白酶解物清除效果最好, 当质量浓度为3.0 mg/mL时, 其对DPPH自由基的清除率达到了80.05%。酶解时间为3 h组与12 h组清除效果相近, 在质量浓度为3.0 mg/mL时清除率分别为64.44%和68.55%, 同时这两组在质量浓度为1.5 mg/mL时出现重合。5种不同酶解时间制备的罗非鱼鱼皮胶原蛋白酶解物清除DPPH·能力由大到小依次为: 9 h>6 h>24 h>12 h>3 h。

图4 不同酶解时间罗非鱼鱼皮胶原蛋白酶解物清除DPPH·的能力

图5 不同酶解时间罗非鱼鱼皮胶原蛋白酶解物清除·OH的能力
2.4.2 ·OH清除能力
羟自由基是活性最强的氧自由基, 它能够降解DNA、损伤细胞膜、杀死红细胞, 从而引起衰老癌症及其他多种病变, 因此清除羟自由基对疾病预防有重要意义[18]。由图5可知, 试验中5组不同酶解时间的罗非鱼胶原蛋白酶解物均具备一定清除羟自由基能力, 且其清除羟自由基能力随着质量浓度的增加而增强, 各样品组均于试验最大浓度10 mg/mL处达到最大清除率。其中, 酶解时间为9 h组清除效果最好, 且线性相关性强, 当试验浓度为10 mg/mL时, 羟自由基清除率达到77.14%。酶解时间为24 h组, 清除率波动最大, 其清除能力与浓度不具备良好的线性相关性, 当质量浓度为10 mg/mL时达到最大清除率71.42%。5种不同酶解时间制备的罗非鱼鱼皮胶原蛋白酶解物清除·OH能力由大到小依次为: 9 h>12 h>6 h>3 h>24 h。
2.4.3 O2-·自由基清除能力
由图6可知, 5组不同酶解时间的罗非鱼鱼皮胶原蛋白均具有一定清除超氧自由基能力, 在一定质量浓度范围内对超氧自由基清除率呈增长趋势, 在20 mg/mL质量浓度左右各样品组清除率达最大值, 超出该范围后略有下降趋势。其中, 仍以酶解时间为9 h组清除效果最好, 在质量浓度为20 mg/mL时超氧自由基清除率为62.75%。其次为酶解时间为6 h组, 在质量浓度达到20 mg/mL时, 其清除率为53.4%, 该组各质量浓度时超氧自由基清除率都低于9 h组而优于其他各样品组。酶解时间24 h组在质量浓度为15 mg/mL时超氧自由基清除率最大为50.04%, 而后随着浓度增加超氧自由基清除率略有下降。5种不同酶解时间制备的罗非鱼鱼皮胶原蛋白酶解物清除O2-·能力由大到小依次为: 9 h>6 h>12 h>24 h>3 h。

图6 不同酶解时间罗非鱼鱼皮胶原蛋白酶解物清除O2-·的能力
3 结论
本文对使用胃蛋白酶酶解罗非鱼鱼皮胶原蛋白3、6、9、12 h及24 h下的酶解物抗氧化活性进行探究, 测定了各样品组的紫外吸收光谱、水解度DH及在一定浓度范围内对DPPH·、·OH和O2-·清除率, 结果表明: 不同酶解时间下的罗非鱼鱼皮胶原蛋白酶解物的最大紫外吸收峰均出现在波长为225 nm左右, 其紫外吸收光谱特性符合典型胶原蛋白的紫外吸收特性; 酶解时间越长罗非鱼鱼皮胶原蛋白酶解物的水解度越高, 但其自由基清除能力并不随之增高, 故水解度与抗氧化活性相关性低; 不同酶解时间下的罗非鱼鱼皮胶原蛋白酶解产物对不同的自由基清除能力各有高低, 但都在一定浓度范围内随着浓度的增高清除率呈上升趋势而后趋于平缓或下降。其中, 酶解时间为9 h制备的罗非鱼鱼皮胶原蛋白酶解物对DPPH自由基、羟自由基和超氧自由基的清除效果都最好, 清除率分别达到80.05%、77.14%和62.75%。随着酶解的进行, 罗非鱼鱼皮胶原蛋白水解程度不断变化, 其中有部分大分子基团逐渐分解成抗氧化多肽, 同时也有部分抗氧化多肽等活性物质被分解而失去抗氧化活性[19], 以致酶解时间9 h组清除DPPH·、·OH和O2-·自由基能力最优; 二是活性肽的抗氧化活性与其特定的氨基酸组成、氨基酸序列、空间结构及分子质量等因素密切相关[20–21], 同种活性肽清除不同自由基的能力也不同, 故各样品组清除DPPH自由基、羟自由基和超氧自由基能力各有高低。本文证明了罗非鱼鱼皮胶原蛋白酶解物的抗氧化活性与酶解时间有关。在一定条件下制备的罗非鱼皮胶原蛋白酶解物具有良好的清除DPPH·、·OH和O2-·自由基能力, 这种能够抗衰老和预防重大疾病的生理功能使罗非鱼鱼皮胶原蛋白酶解物拥有广阔的应用范围和商业价值, 譬如作为美容护肤品、功能保健品、食品和药品的有效成分。在此前提下, 无论是对罗非鱼鱼皮胶原蛋白酶解物功效或最佳工艺的深入研究, 或以此为参考开发鱼骨、鱼鳞、内脏等其它副产物的功能, 都能带来巨大的社会效益与经济效益。
[1] 李露园, 王升帆, 朱有贵, 等. 酶法制备鲟鱼皮胶原蛋白多肽及其抗氧化活性研究[J]. 食品与发酵工业, 2019, 45(20): 138–143.
[2] 丁卓平, 刘振华, 李仁冬, 等. 罗非鱼鱼皮胶原蛋白提取条件的研究[J]. 水产科技情报, 2006, 33(4): 190–192.
[3] 张寒俊, 杨国燕, 张蕾. 碱性蛋白酶水解罗非鱼鱼皮提取胶原蛋白肽的最佳条件研究[J]. 食品研究与开发, 2008, 9: 27–30.
[4] 刘海军, 乐超银, 邵伟, 等. 生物活性肽研究进展[J]. 中国酿造, 2010, 5: 5–8.
[5] 姚曦, 何标. 游泳运动对2型糖尿病小鼠海马Aβ及生成相关蛋白的影响[J]. 湖南文理学院学报(自然科学版), 2020, 32(1): 20–24, 60.
[6] 梁拥军, 孙向军, 杨璞, 等. 罗非鱼鱼皮胶原蛋白多肽的制备及其理化性质研究[J]. 安徽农业科学, 2009, 37(4): 1 588–1 590.
[7] 张寒俊, 杨国燕, 张蕾. 罗非鱼鱼皮胶原蛋白肽酶解液的制备及其抗氧化特性研究[J]. 中国酿造, 2008, 13: 28.
[8] 王成成. 罗非鱼鱼皮明胶肽抗氧化活性及对细胞氧化应激的保护作用[D]. 大连:大连工业大学, 2017.
[9] 朱静静, 潘道东, 孙杨赢, 等. 酶解法制备胶原蛋白肽及其抗氧化活性的研究[J]. 宁波大学学报(理工版), 2016, 29(4): 26–32.
[10] Tang L, Chen S, Su W, et al. pHysicochemical properties and film- forming ability of fish skin collagen extracted from different freshwater species [J]. Pro Biochemcess, 2015, 50(1): 148–155.
[11] 卢珍华, 郭彩华, 叶鹏, 等. 养殖花鳗鲡鱼皮胶原蛋白的特性分析[J]. 淡水渔业, 2019, 49 (6): 100–106.
[12] 袁野, 李佳林. 胶原蛋白检测方法研究进展[J]. 明胶科学与技术, 2014, 34(4): 175–180.
[13] 尹利端, 黄静, 王立志. 鲤鱼鱼鳞胶原蛋白肽抗氧化活性研究[J]. 明胶科学与技术, 2015, 35(3): 133–136.
[14] Jamdar S N, Rajalakshmi V, Pednekar M D, et al. Influence of degree of hydrolysis on functional properties, antioxidant activity and ACE inhibitory activity of peanut protein hydrolysate [J]. Food Chemistry, 2010, 121(1): 178–184.
[15] 顾欣, 崔洁, 李迪, 等. 山杏仁肽的体外抗氧化活性研究[J]. 中国油脂, 2012, 37(9): 40–43.
[16] 张韫, 高苏亚, 唐一梅, 等. 盘龙七中黄酮抗氧化活性的评价研究[J]. 当代化工, 2019, 48(8): 1 651–1 654.
[17] 温慧芳, 陈丽丽, 白春, 等. 基于不同提取方法的鮰鱼皮胶原蛋白理化性质的比较研究[J]. 食品科学, 2016, 37(1): 74–81.
[18] 杨珊珊, 刘会平, 张璐, 等. 蛋清多肽体内外抗氧化活性的研究[J]. 食品工业科技, 2019, 40(22): 40–43.
[19] 刘静, 李湘利, 苗仙仙, 等. 蛋白酶水解鸡枞菌制备酶解液工艺优化及抗氧化活性[J]. 中国调味品, 2020, 45(3): 77–82.
[20] 王晴, 曹稳根, 钱玉梅, 等. 不同酶解胶原肽的制备及抗氧化活性研究[J]. 洛阳师范学院学报, 2020, 39(2): 18–21.
[21] 苏海玲, 韩涛. 多肽生物活性与其结构的关系[J]. 中国食物与营养, 2012, 18(6): 21–25.
Effects of hydrolysis time on antioxidant activity of tilapia skin collagen proteolytic
Wang Qing, Shi Chengyu, Qian Yumei, Li Hongxia, Chen Hongling, Cao Wengen, Zang Feng
(School of Biology and Food Engineering, Suzhou University, Suzhou 234000 China)
To investigate the effect of enzymolysis time on the antioxidant activity of collagen protein hydrolysate of tilapia fish skin. Acidic extraction of tilapia fish skin collagen, pepsin enzymolysis for 3, 6, 9, 12 and 24 h to prepare enzymatic hydrolysate, UV spectrum scanning, hydrolysis degree determination, using DPPH, OH and O2-·.The clearance rate is an index to evaluate antioxidant activity. The maximum UV absorption peak was similar, and the degree of hydrolysis was positively correlated with the enzymolysis time. 9 h enzyme hydrolysate has the best effect on scavenging three free radicals. Conclusion: The antioxidant activity of collagen proteolytic products of tilapia fish skin is related to the time of enzymolysis, which provides a theoretical basis for further processing and utilization of tilapia fish skin.
tilapia skin; collagen; enzymatic hydrolysis; antioxidant activity
10.3969/j.issn.1672–6146.2021.01.008
TS 254.9
A
1672–6146(2021)01–0036–06
王晴,szxywangqing@163.com。
2020–06–01
安徽省自然科学基金项目(1908085MC100); 安徽省教育厅自然科学研究重点项目(KJ2018A0443, KJ2017A- 441); 安徽省大学生创新训练项目(201910379125); 宿州学院学术技术带头人项目(2016XJXS06); 宿州学院教授(博士)科研启动基金项目(2016jb02); 宿州学院科研平台开放课题(2017ykf05, 2019ykf28)。
(责任编校: 刘刚毅)
