抗原致敏DC联合CTL细胞对小细胞肺癌NCI-H209细胞移植瘤裸鼠的疗效观察①
2021-01-30彭玉澄黄艳春
彭玉澄,黄艳春,杨 佳
(新疆医科大学附属肿瘤医院检验科,乌鲁木齐830011)
小细胞肺癌是一种起源于支气管黏膜上皮的神经内分泌肿瘤,约占肺癌的15%~20%,其特点是恶性程度高、侵袭性高、进展快、早期出现远处转移,广泛期小细胞肺癌预后极差,中位总生存期仅仅8~10个月,5 年生存率不5%[1]。目前对肺癌尤其是小细胞肺癌的治疗没有绝对有效的方案,急需研究新的治疗方法和方案帮助患者提高生存收益。随着对小细胞肺癌分子生物学认识的深入,研究重点转向了免疫治疗。特异性细胞免疫治疗因其强大的抗肿瘤作用和明显的疗效已成为国内外抗肿瘤治疗方向的研究趋势,与恶性肿瘤病情进展有关的细胞主要是恶性肿瘤局部树突状细胞(dendritic cells,DC)其数量和状态与肿瘤呈正相关[2-3]。有研究通过体外实验证实致敏后的杀伤细胞(cytokine induced killers,CIK)对小细胞肺癌的杀伤作用[8],为了进一步探讨抗原致敏DC诱导的细胞毒性T 淋巴细胞(cytotoxic T lymphocyte,CTL)靶向性的抑制小细胞肺癌细胞的机制,本研究建立了小细胞肺癌NCI-H209 细胞裸鼠移植瘤动物模型并使用小细胞肺癌株NCI-H209 细胞裂解物作为抗原,用来负载树突状细胞诱导细胞毒性T淋巴细胞,经过以上步骤验证致敏后的DC-CTL 对小细胞肺癌裸鼠移植瘤的生长是否有抑制作用,为临床上提供了理论依据。
1 材料与方法
1.1 主要试剂、细胞株和实验动物X-VIVO15 无血清培养基购自LONZA 公司,重组人细胞因子(rhGMCSF、rhIL-4、rhTNF-α、rhIL-1α、)均购自Peprotech 公司,胎牛血清购自美国Hyclon 公司,rhIL-2 购自北京四环生物制药有限公司,anti-CD3McAb 购自德国miltenyi Biotec 公司,IFN-γ购自上海凯茂生物医药有限公司,人外周血淋巴细胞分离液购自天津市灏洋生物制品科技有限公司。外周血单个核细胞(PBMC)分离自健康志愿者外周血。NCI-H209 细胞株源自美国ATCC。BALB/c 裸鼠购自北京维通利华实验动物技术有限公司,选取5~7周龄,体重(18±2)g的SPF级雌性小鼠80只。
1.2 小细胞肺癌细胞株NCI-H209 的培养和全细胞抗原的制备
1.2.1 NCI-H209 细胞裂解物分离的混合蛋白抗原的制备 消化收集1×107个NCI-H209细胞,生理盐水洗涤2 遍,加入1 mL 单纯RPMI-1640,放入液氮中,10 min 后迅速取出放入37℃水浴中,待其完全融化后,再次放入液氮中,反复3 次。离心除去细胞碎片,微孔滤膜过滤,收集滤液于4℃保存备用。
1.2.2 CTL 细胞、DC-CTL 细胞、NCI-H209 细胞裂解物致敏的DC-CTL 细胞的培养DC 细胞的诱导培养:取健康成人外周血30 ml,经淋巴细胞分离液密度梯度分离得到PBMC,用X-VIVO15 无血清培养基重悬细胞并平均分至2个25 cm2培养瓶中,37℃、5%CO2培养箱静置4 h 后收集非贴壁细胞(用于CTL 细胞培养),贴 壁 细胞 加 入含rhGM-CSF 1×106U/L、rhIL-4 5×105U/L 的X-VIVO15 无血清培养基。隔天半量换液、补充细胞因子,第7天每瓶加入rhTNF-α 100 μg/L(2×106U/L),倒置相差显微镜及电镜观察细胞的形态。CTL 细胞的培养扩增:收集上一步的非贴壁细胞,调整密度为(3~5)×106/mL,悬于含IFN-γ 1000 U/mL 的X-VIVO15无血清培养基中,放置37℃、5%C02培养箱中培养。第2 天加入细胞因子rhIL- 1α 1 ng/mL,anti-CD3McAb 100 ng/mL 和rhIL-2 1 000 U/mL。根据细胞生长情况适时补充培养基。 NCI-H209 细胞裂解物分离的混合蛋白致敏DC:DC 诱导培养的第6d,加入NCI-H209 细胞冻融抗原100 μL,混匀,继续于37℃、5%CO2培养箱培养,第7 天常规加入rhTNF-α 2×106U/L,第8 天收获成熟的DC 细胞。 DC 细胞与CTL 细胞共培养:培养第8 天,收集NCI-H209 细胞冻融抗原致敏过的DC、未致敏的DC、CTL,分别计数,按DC:CTL=1:50~100 比例将DC 按实验分组分别与CTL 细胞混合共培养,培养液为含rhIL-2 1 000 U/mL的X-VIVO15无血清培养基。观察DC 与CTL 共培养后的增殖情况。
1.3 实验分组及造模选择80 只裸鼠(雌性,5~7 周龄),无菌环境下经适应性饲养后随机分为4 组。模型组:20 只,注射对数生长期的NCI-H209 小细胞肺癌悬液(1×107)(用生理盐水悬浮)与基质胶比例为1∶1(0.2 mL∶0.2 mL)皮下注射接种于动物右侧前肢腋下,隔一天使用游标卡尺测量生长在皮下的肿瘤尺寸,并将成瘤标准定为皮下结节直径大于或等于0.5 cm。第14天(从注射小细胞肺癌悬液开始计为第1 天)达到成瘤标准,尾部注射0.2mL 生理盐水,1 次/3 d;CTL组:20只,造模成瘤后即第14天起,尾部注射0.2 mL(1×107)CTL 细胞,用生理盐水悬浮。1 次/3 d;未致敏DC-CTL 组:20 只,第14 天起,尾部注射0.2 mL(1×107)未致敏DC-CTL细胞,用生理盐水悬浮。1次/3 d;抗原致敏DC-CTL 组:20 只,第14 天起,尾部注射0.2 mL(1×107)抗原致敏DC-CTL 细胞,用生理盐水悬浮,1次/3 d。
1.4 生理指标观察干预期间每天对裸鼠的精神状态,活动状况,对外界的刺激反应,以及进食、饮水进行观察。每3天用卡尺测量肿瘤长短径,绘制移植瘤体积变化曲线。计算方法肿瘤体积(V):V=1/2 长径×宽径2。第33 天(即最后一次注射完免疫细胞悬液后4 d),以颈椎脱位方式每组随机处死10 只裸鼠,用镊子镊住裸鼠右侧前肢腋下肿瘤生长部位皮肤后,手术剪开皮肤暴露肿瘤,用手术剪完整剥离肿瘤,生理盐水冲洗后擦干用精密天平称瘤重,尺子测量瘤块大小,计算各样本对瘤质量的抑制率(IR),IR=[(对照组平均瘤质量-样本瘤质量)/对照组平均瘤质量]×100%。剩下每组10只裸鼠观察记录存活周期。
1.5 肿瘤组织样本收集为收集肿瘤样本,将剥离的肿块切片并快速用10%甲醛溶液浸泡用于HE 染色,观察肿块内部有无坏死区及颜色和质地。
1.6 统计学处理采用SPSS 20.0 统计软件行统计分析。计量资料以均数±标准差(-x±s)表示,2 组间均数比较采用成组t检验,检验水准α=0.05。
2 结果
2.1 裸鼠生长状态皮下接种NCI-H209 小细胞肺癌悬液第14 天,成功建立裸鼠皮下小细胞肺癌模型,成瘤率100%,肿瘤直径0.5~0.7 cm,位于裸鼠右侧前肢腋下,皮下瘤表面未见红肿、破溃、出血,腹部未见明显膨隆。接种肿瘤细胞后各组裸鼠肿瘤发展皆较为迅速,接种3周时个别裸鼠开始出现精神萎靡的情况,其中模型组最为明显,随着皮下瘤块增大,逐渐有瘤块表面发生红肿、破溃,肿瘤质软,活动度差,未触及血管搏动,接种第4 周时,虽然4 个组裸鼠瘤块尺寸差别不大,但模型组明显行动迟缓,进食减少,皮褶变薄。而另外3个治疗组裸鼠,活动尚可,进食量相对模型组较多,皮褶较前变化不明显。接种第31天时裸鼠开始死亡。
2.2 裸鼠瘤块体积记录生理盐水组(模型组)瘤块体积增大明显,并于第27天达到高峰,之后有缓慢回落;CTL 组于第21 天达到峰值此后趋势平缓;未致敏DC-CTL 组于第24 天达到峰值后趋势平缓和CTL 组相比瘤块体积缩小,但差异无统计学意义;抗原致敏DC-CTL组第24天瘤块体质达高峰后开始明显下降,第27 天至第30 天下降趋势明显,与其他3 组相比有差异有统计学意义(P<0.05),见表1~2、图1~2。
3.3 裸鼠瘤块重量以及抑瘤率记录第33天处死裸鼠后解剖称重瘤体发现CTL 组、未致敏DC-CTL 组、抗原致敏DC-CTL 组瘤体质量都较模型组低,抑瘤效果明显,特别是抗原致敏DC-CTL 相较于其他组抑瘤率明显提升,瘤块质量明显下降,差异有统计学意义(P<0.05),见表2。
表1 不同处理组不同天数裸鼠瘤体积的变化(±s,mm3)
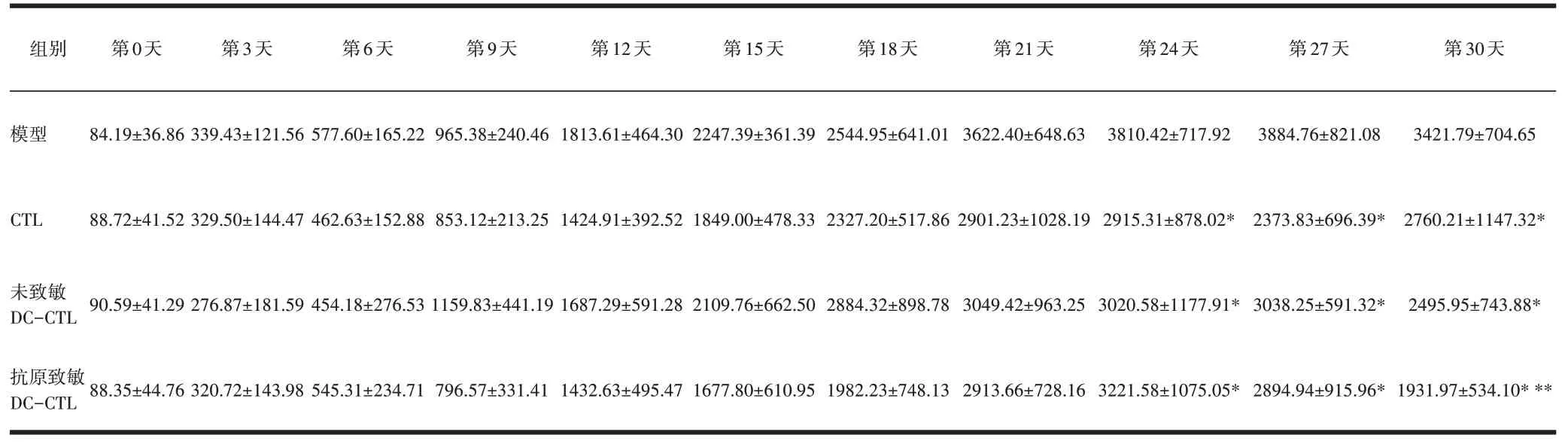
表1 不同处理组不同天数裸鼠瘤体积的变化(±s,mm3)
?
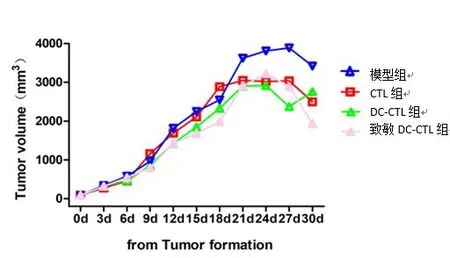
图1 瘤块体积变化折线图
表2 不同处理组对裸鼠瘤块重量的作用分析(±s,n=40)
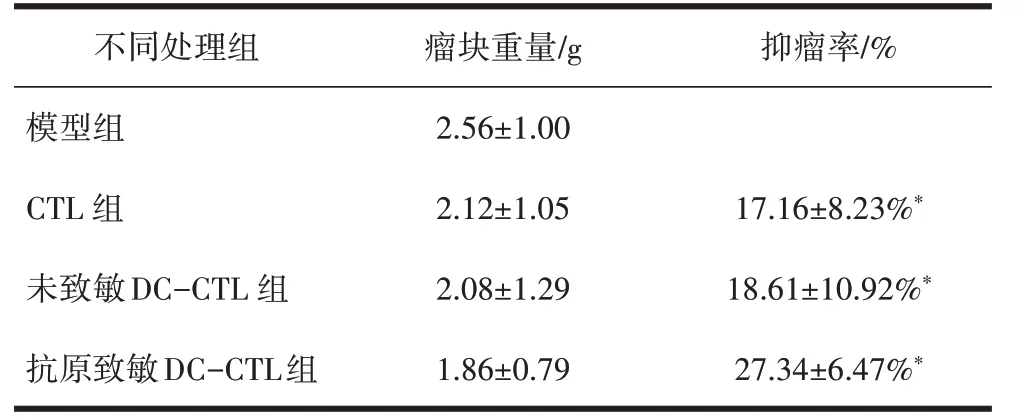
表2 不同处理组对裸鼠瘤块重量的作用分析(±s,n=40)
注:与模型组比较,*P <0.05。
?
2.4 各组裸鼠生存期比较模型组从接种肿瘤起第31 天开始死亡,至第48 天全部死亡,中位生存期(38±3.68)d;CTL 组在第39 天开始死亡,至第59 天全部死亡,中位生存期(44±3.16) d;DC-CTL 组第33 天开始死亡,至第58天全部死亡,中位生存期(48±3.69)d;抗原致敏DC-CTL 组第36 天开始死亡,至第56 天全部死亡,中位生存期(50±9.86) d。3 个治疗组与模型组比较差异有统计学意义(P<0.05),但CTL组与未致敏DC-CTL 组比较差异无统计学意义(P>0.05),抗原致敏DC-CTL 组与其它两个治疗组比较差异有统计学意义(P<0.05),见图3。
2.5 裸鼠移植瘤组织病理学检查石蜡常规切片经HE 染色后,可见肿瘤细胞呈卵圆形,核大小不一,核浆比例大,可见瘤巨细胞,核仁清晰,核分裂像易见,伴有坏死,具有典型的肿瘤细胞特征对比模型组,3个治疗组都发现较多的间质炎细胞,以淋巴细胞为主,特别是抗原致敏DC-CTL 组,可见大片的肿瘤组织坏死和弥漫成片的淋巴细胞,见图3~4。
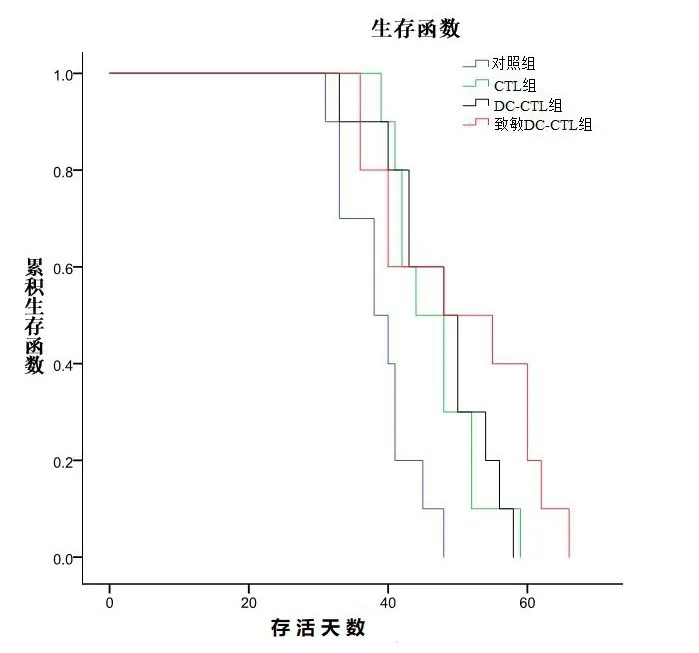
图2 4组移植瘤裸鼠生存曲线
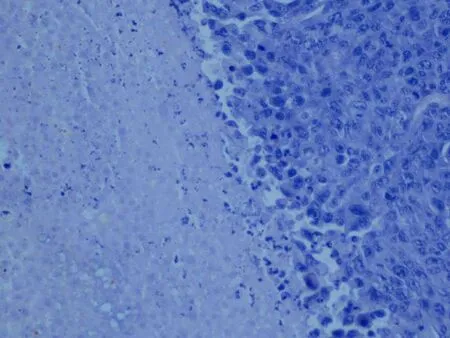
图3 肿瘤组织大量坏死
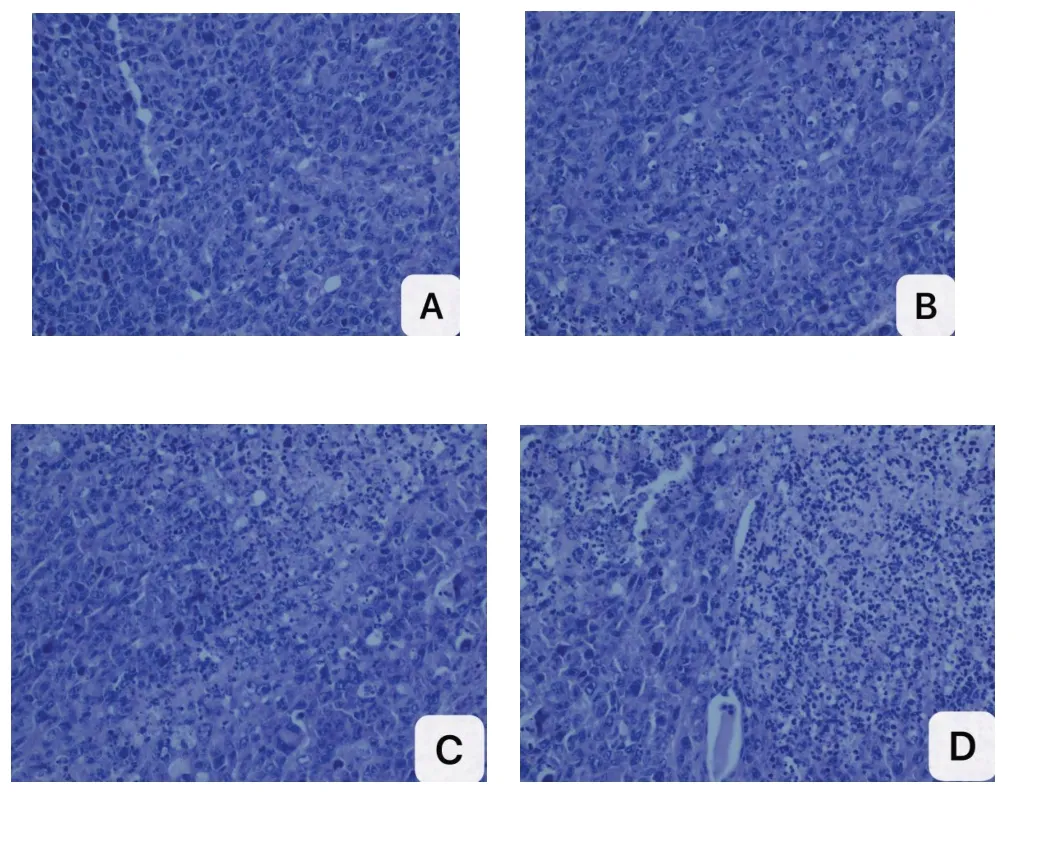
图4 4组移植瘤病理HE染色
3 讨论
近年肿瘤免疫治疗取得显著的进步,嵌合抗原受体T 细胞(CAR-T)疗法在血液病治疗方面取得了明显的效果,但是在治疗实体瘤方面总是遇到重重阻碍[4-5]。肿瘤浸润淋巴细胞,作为治疗实体瘤效果显著的免疫治疗方式越来越受到人们的热捧,但对于小细胞肺癌而言,提取肿瘤组织和肿瘤浸润淋巴细胞是非常困难的事。本研究选择DC 疫苗与CTL细胞相结合的方式,肿瘤细胞与树突状细胞的融合疫苗可表达恶性肿瘤细胞的所有抗原并产生多克隆的细胞毒性T 淋巴细胞,从而诱导机体产生肿瘤特异性免疫反应。肿瘤疫苗还能通过表达组织相容性抗原II、共刺激因子以及黏附因子等的方式为肿瘤免疫提供第二信号,最终促使细胞产生抗肿瘤特异性免疫应答[6]。
本研究显示,治疗结束后CTL 组、DC-CTL 组和抗原致敏DC-CTL 组裸鼠肿瘤体积和质量均有下降,特别是抗原致敏DC-CTL 组较模型组下降明显,抑瘤率达(27.34±6.48)%,差异有统计学意义(P<0.05)。从生存期观察到,模型组中位生存期(38±3.69)d;3 个治疗组与模型组比较都有统计学差异(P<0.05),但CTL 组与未致敏DC-CTL 组比较差异无统计学意义,抗原致敏DC-CTL 组与其它2 个治疗组比较生存期更长(P<0.05)。病理切片观察3 个治疗组都发现较多的间质炎细胞,以淋巴细胞为主,特别是抗原致敏DC-CTL 组,可见大片的肿瘤组织坏死和弥漫成片的淋巴细胞。Wang 等[7]对包含94 例SCLC 的肺神经内分泌肿瘤标本进行分析,显示较高的CD8+T淋巴细胞数量与缺乏血管侵犯、组织学类型、阴性淋巴结转移和较低的临床分期相关,基质中较多CD8+T淋巴细胞是改善总生存期和无病生存期的独立预后因素。此外,其他科研成果发现CD4+T、CD8+T 淋巴细胞均能有效提升长期预后生存质量[8]。本研究虽然没有对病理标本中的淋巴细胞进行分型,但在抗原致敏DCCTL 组瘤体中淋巴细胞比例明显比模型组和其他治疗组多,这样的病理结果与上述报道一致,也提示这是抗原致敏DC-CTL 抑瘤效果明显且生存期长的机制。已有研究证实CIK 治疗能延长前列腺癌裸鼠皮下移植瘤模型的生存期[9]。本研究发现,3 个治疗组特别是抗原致敏DC-CTL 组裸鼠不但生存时间明显延长,在肿瘤晚期也能表现出较好的精神状态和食欲。
综上,致敏DC-CTL 细胞具有较强的抗肿瘤特异性和杀伤作用,为小细胞肺癌的综合治疗提供了理论依据。
