异叶青兰总黄酮通过调节RAAS系统抑制高血压大鼠心肌肥厚的研究
2021-01-30程路峰杨淑梅萨迪克诺莫诺夫
何 雯,程路峰,杨淑梅,闫 冬,蒋 红,萨迪克·诺莫诺夫
(1成都中医药大学附属第五人民医院,成都611130;新疆医科大学2第五附属医院药学部,3国际教育学院,4基础医学院,5护理学院,乌鲁木齐830011;6中国科学院新疆理化技术研究所资源化学研究室,乌鲁木齐830011)
高血压是一种逐渐进行发展的慢性疾病,国内外大量纵向随访资料证实,高血压将导致心、脑、肾和血管的病变,相应的损伤导致脑卒中、充血性心力衰竭、慢性肾功能衰竭、主动脉夹层等严重并发症,不仅致残、致死率高,而且严重消耗医疗和社会资源。同时,高血压又是动脉粥样硬化、冠心病、周围动脉栓塞性疾病的最重要危险因素。根据已有的研究数据,我国18岁以上成年人有2.45亿人患高血压,而高血压前期的比例更是达到41.3%,人数达到4.35亿。高血压患者知晓率仅为46.7%,控制率为40.7%,达标率仅为15.3%[1]。
高血压是由多种因素参与使正常血压调节机制失代偿的复杂过程,其中最为重要的是RAAS 的激活。RAAS 是调节血压和钠/水内环境稳定的一个重要途径,由肾素、血管紧张素原(angiotensinogen)、血管紧张素转化酶(angiotensin-convertingenzyme,ACE)、血管紧张素(angiotensin,Ang)及其相应的受体构成。在病理条件下,RAAS 是引起高血压形成的首要因素。心肌肥厚是高血压最常见的靶器官损害,左室肥厚(left ventricular hypertrophy,LVH)是心脏对慢性压力和(或)容量负荷的反应,同时也是心血管疾病非常重要的独立危险因素之一。已有研究分析了1990-2017 年中国34 个省份(包括港澳台)居民的死亡原因,缺血性心脏病位列第2 位,高血压性心脏病位列第22 位,每十万人寿命损失年数达到了312年[2]。
异叶青兰(Dracocephalum heterophyllum Benth.)对高血压、支气管炎等疾病均有功效[3-5]。本课题组前期对新疆克孜勒苏柯尔克孜自治州阿克陶县采集的异叶青兰全草的成分进行研究,提取分离出黄酮、萜类及苷类等化合物,其中黄酮包括木犀草素、香叶木素、猫眼草黄素、山柰酚等[6-8];追踪异叶青兰总黄酮(Dracocephalum heterophyllum Benth. Flavone,DHBF)为其有效部位,对DHBF 进行了提取、纯化工艺的研究[9],证实了DHBF 对AngⅡ和NE 诱导的心肌肥大细胞有保护作用[10-11]。本实验拟从经典的肾素血管紧张素醛固酮系统(renin-angiotensin-aldosterone system,RAAS)入手,观察DHBF 对高血压大鼠心肌肥厚、血流动力学参数及RAAS的调节,以期阐述DHBF的作用机制,为异叶青兰的开发提供数据支持。
1 材料与方法
1.1 药品、试剂及仪器异叶青兰总黄酮(DHBF),新疆阿克陶县塔克村收集,由中国科学院新疆理化技术研究所提供,AB-8 大孔吸附树脂纯化。卡托普利(中美上海施贵宝制药有限公司),PowerLab 四信道生理信号采集处理系统(澳大利亚埃德仪器),血管紧张素Ⅱ(AngⅡ)、醛固酮(ALD)放射免疫试剂盒(北京北方生物技术研究所),放射免疫γ 计数器(GC-2016),逆转录酶试剂盒(Thermo),定量PCR 试剂盒(ABI),逆转录仪(Bio-RAD),定量PCR 仪(ABI 7500),血管紧张素受体1(AT1)(1E10-1A9)、血管紧张素受体2(AT2)(ab19134)抗体(Abcam),BCA 蛋白定量试剂盒(天根,PA115-02)。
1.2 实验动物雄性SD 大鼠,体重180~200 g,购自新疆医科大学实验动物中心,许可证号: SCXK(新)2010-0001。实验期间,大鼠饲养在SPF环境中,许可证号:SCXK(新)2010-0003。
1.3 方法
1.3.1 模型建立和给药剂量 2K1L 手术与前期课题组手术方法一致,钝性分离大鼠左侧肾动脉血管,套内径为0.2 mm 的U 型银夹。假手术组只需分离左侧肾动脉血管,不套U 型银夹[1,10]。除假手术组外,按收缩压水平将造模成功的大鼠随机分为模型组(Model)、卡托普利组(Captopril,20 mg/kg)、异叶青兰总黄酮低剂量组(DHBF-L 组,300 mg/kg)、异叶青兰总黄酮高剂量组(DHBF-H 组,600 mg/kg),每组10 只。以灌胃方式给药,模型组和假手术组给予等体积的蒸馏水作对照,每天给药1次,连续6周。
1.3.2 血流动力学指标测定 实验6周后,在麻醉(3%戊巴比妥钠,45 mg/kg)状态下行颈动脉插管,通过压力换能器,将信号输入至Powerlab 生物信号处理系统,稳定后记录分析下列血流动力学参数:收缩压(SBP)、舒张压(DBP)、平均动脉压(MBP)、左室收缩压(LVSP)、左室舒张末期压(LVEDP)、收缩时间(SD)、舒张时间(DD)、收缩指数(CI)、室内压最大上升速率(+dp/dtmax)、室内压最大下降速率(-dp/dtmax)[10]。
1.3.3 组织学检查 将左心室从心尖至心底切为每片厚度约1.5 mm 的5 个切片,中间切片固定于10%甲醛,石蜡包埋,切为4 μm 厚切片, 行HE 染色观察左心室心肌细胞大小。心肌细胞横截面积测定:心脏HE 染色切片于摄影显微镜下拍照(×200),每个标本取5 个视野,每一视野取10 个胞核位于中央的垂直切面的心肌细胞,运用HMIAS-2000 医学图文分析软件,测量大鼠心肌细胞的横截面积(cross-sectional area of cardiac myocyte,CSA),取其均值。
1.3.4 荧光实时定量PCR 检测大鼠心肌组织AT1、AT2 mRNA 表达 提取心肌组织总RNA,按逆转录试剂盒说明书及引物反应条件进行逆转录和目的基因的扩增,检测其AT1 和AT2 基因的表达。各种引物序列及扩增产物长度见表1。PCR 扩增反应条件为:50℃2 min UDG 灭活,95℃2min,95℃15sec(变性),60℃1 min(退火/延伸),40 个循环。β-actin 为内参照,分别以相应基因与β-actin 光密度表示该基因相对表达水平。
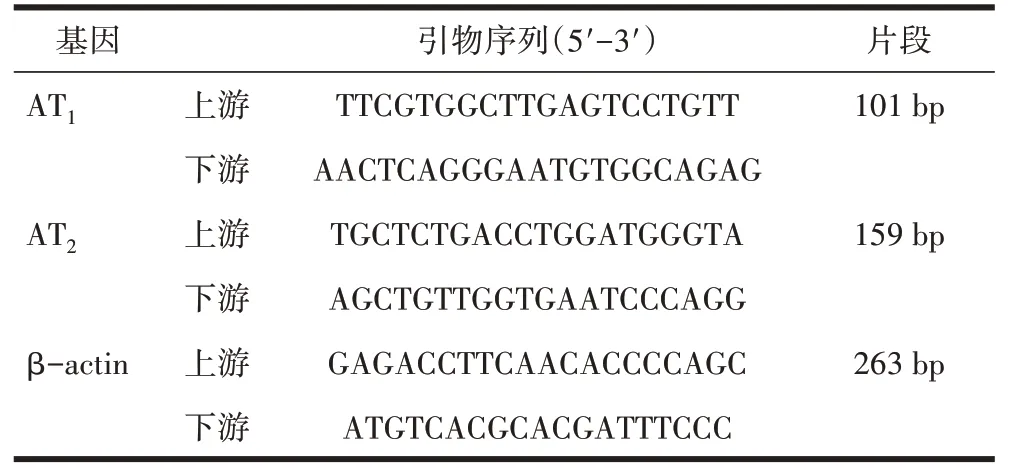
表1 PCR 引物的序列和产物长度
1.3.5 Western blot 检测AT1、AT2蛋白的表达 心脏组织经RIPA 裂解,SDS-聚丙烯酰胺凝胶电泳后半干转运至PVDF 膜上,加5%脱脂奶粉封闭过夜,一抗与转移膜反应2 h,TBST 洗膜5 min×3 次。二抗室温孵育2 h,TBST 洗膜5 min×3 次,PBS 洗膜1 次;采用ImageJ凝胶图像分析软件分析。
1.4 统计学处理采用SPSS 17.0 软件One-Way ANOVA方法进行组间比较,先行方差齐性检验,方差齐则采用LSD检验,方差不齐则采用Dunnett"s T3 方法。计量资料以均数±标准差(-x±s)表示,以P<0.05为差异有统计学意义。
2 结果
2.1 DHBF 对血压的影响模型组6 周血压与假手术组相比明显升高(P<0.01),且6 周内保持稳定,说明模型成立且稳定。与模型组比较,异叶青兰总黄酮灌胃给药,低剂量组从给药第5 周明显下降,第5周,第6周分别下降12.3%,13.5%(P<0.05);高剂量组第3周起,尾动脉收缩压明显下降,与给药前相比,第3周至第6周分别下降了10.5%、14.6%、17.5%、20.5%(P<0.05);卡 托 普 利 组3~6 周 分 别 下 降27.6%、30.0%、32.9%、33.5%。见图1。
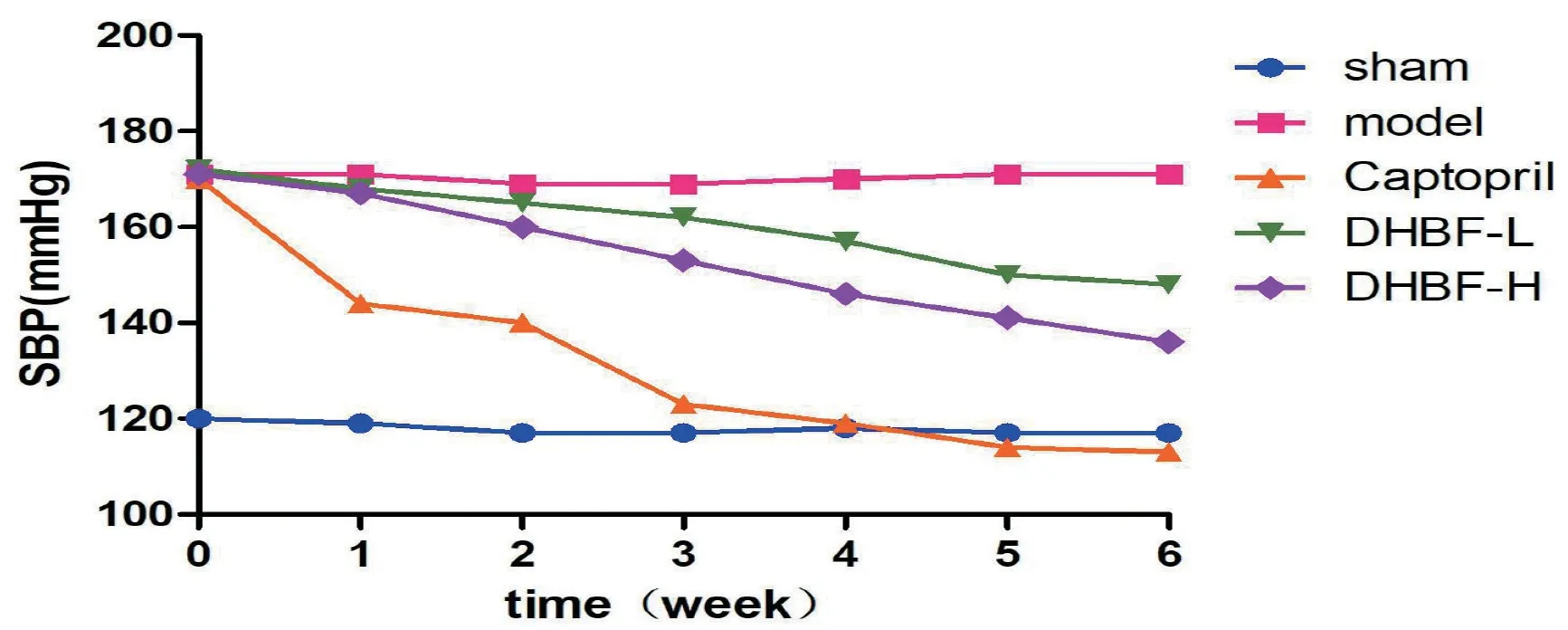
图1 各组大鼠血压变化曲线
2.2 DHBF 对高血压大鼠血流动力学的影响与假手术组相比,模型组SBP、DBP、LVSP、LVEDP 都升高(P<0.01);+dp/dtmax/LVSP 和-dp/dtmax/LVSP 升高(P<0.01);DD缩短(P<0.01);与模型组相比,DHBF-L组LVSP、LVEDP 都降低(P<0.05),+dp/dtmax/LVSP降低(P<0.05);DHBF-H 组SBP、LVSP、LVEDP 都降低(P<0.01);DD 延长(P<0.05);+dp/dtmax/LVSP 降低(P<0.01);卡托普利组SBP、DBP、LVSP、LVEDP 都降低(P<0.05);DD 延长(P<0.05);+dp/dtmax/LVSP降低(P<0.01),-dp/dtmax/LVSP 降低(P<0.05),见表2。
表2 异叶青兰总黄酮对高血压大鼠血流动力学的影响(±s,n=8)
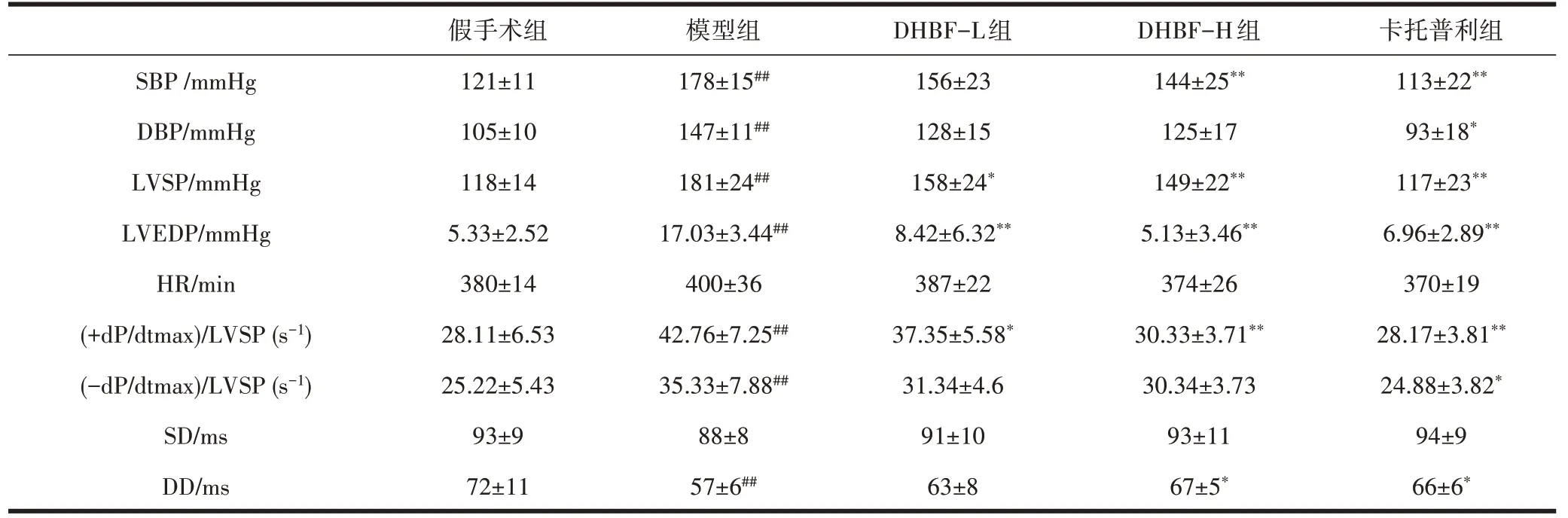
表2 异叶青兰总黄酮对高血压大鼠血流动力学的影响(±s,n=8)
注:与假手术组相比,#P<0.05,##P<0.01;与模型组相比,*P<0.05,**P<0.01。
?
2.3 DHBF 对高血压大鼠左心室心肌的影响与假手术组相比,模型组心肌细胞明显增大,单位面积内心肌细胞数量减少,出现炎症细胞浸润明显增多。其中模型组比假手术组左心室心肌细胞横截面积(CSA)增大了135.5%(P<0.01),DHBF 低、高剂量组心肌细胞横截面积则分别显减小了39.2%和43.2%(P<0.01),卡托普利组减少了23.6%(P<0.01)。
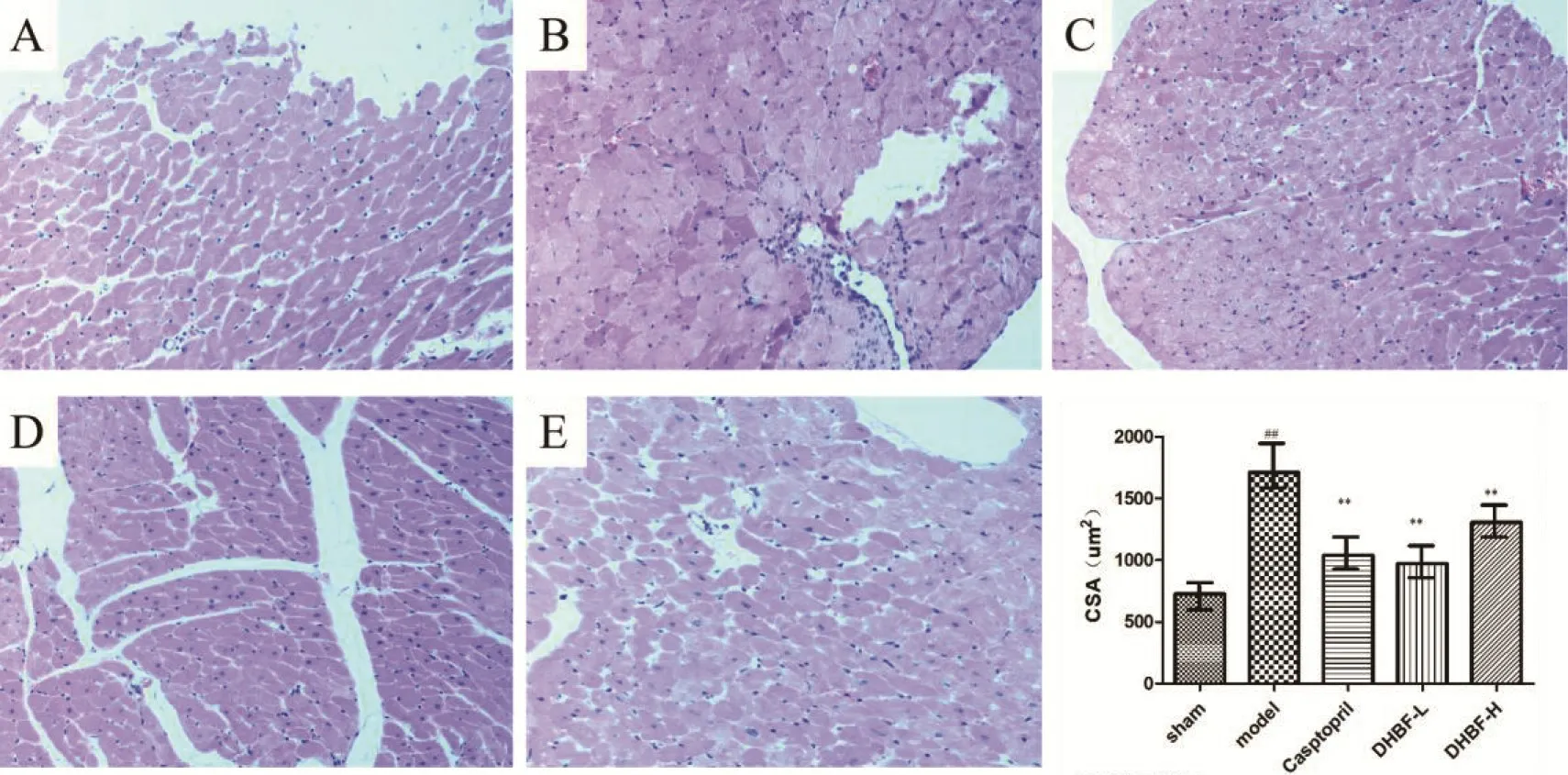
图2 各组大鼠左心室心肌病理结果(HE,×200)
2.4 DHBF 对高血压大鼠AngⅡ、ALD 水平的影响与假手术组比较,模型组心脏、肾脏AngⅡ水平分别升高了40.6%(P<0.01)和7.8%(P<0.05)、ALD 升高了73.9%;与模型组相比,DHBF 各组心脏AngⅡ分别增高了3.1%和8.1%(P>0.05),DHBF-L 组肾脏AngⅡ、ALD分别下降了2.4%和10.8%(P>0.05),DHBF-H 组分别下降了6.4%(P<0.05)和27.5%(P<0.01),卡托普利组心脏、肾脏AngⅡ、ALD 分别降低25.2%、6.4%、40.0%(P<0.01),见表3。
2.5 DHBF 对高血压大鼠AT1a、AT2 mRNA 相对表达量的影响与假手术组相比较,模型组心脏组织中AT1a、AT2 的mRNA 的相对表达量分别增加了245.7%和95.4%(P<0.01);与模型组相比较,DHBFL 组心脏AT1a、AT2 的mRNA 的相对表达量分别下降了21.2%和36.5%,差异无统计学意义,DHBF-H组AT1a 和AT2 mRNA 的相对表达量呈下降趋势,分别下降了62.8%(P<0.01)和31.3%(P>0.05),卡托普利组分别下降了73.6%(P<0.01)和30.3%(P>0.05),见图3。
表3 异叶青兰总黄酮对高血压大鼠Ang Ⅱ、ALD 的影响(±s,n=8)
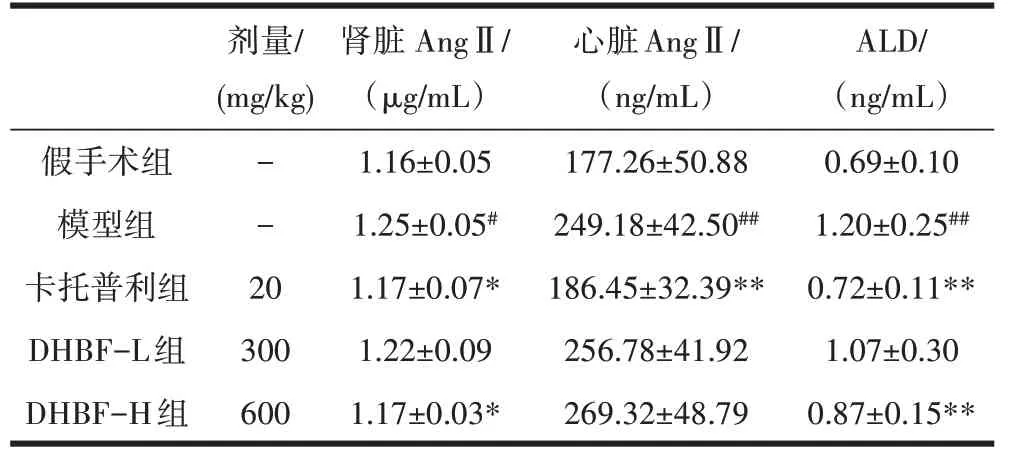
表3 异叶青兰总黄酮对高血压大鼠Ang Ⅱ、ALD 的影响(±s,n=8)
注:和假手术组相比,#P<0.05, ##P<0.01;和模型组相比,*P<0.05, **P<0.01。
?
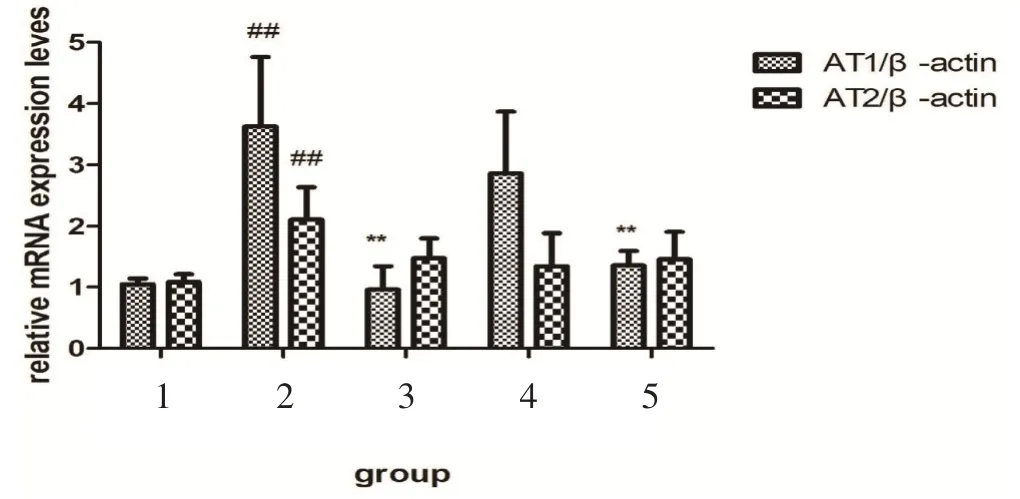
图3 异叶青兰总黄酮对AT1a、AT2 mRNA的相对表达量的影响
2.6 DHBF对高血压大鼠心脏组织中AT1、AT2蛋白表达的影响与假手术组相比较,模型组心脏组织中AT1、AT2 的蛋白表达分别明显升高(P<0.01);与模型组相比较,DHBF-L组心脏AT1、AT2的蛋白表达有所下降(P>0.05),DHBF-H 组AT1的蛋白表达明显下降(P<0.01),AT2 的蛋白表达呈下降趋势(P>0.05)。见图4。
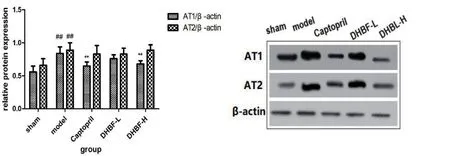
图4 异叶青兰总黄酮对AT1、AT2 蛋白表达的影响
3 讨论
RAAS 在高血压发生发展过程中至关重要,也是人们持续研究的方向[12],RAAS 可以分为由特定器官产生并分泌至血液循环的循环RAAS 和由某些组织产生并在局部起作用的组织RAAS。在心、肾、脑、血管、等组织中,AngⅠ除了可以通过ACE 途径产生AngⅡ以外,还可以通过糜蛋白酶、张力素、组织蛋白酶G 途径(非ACE 途径)产生AngⅡ。AngⅡ是RAAS中最主要的因素,其主要通过与细胞膜上相应的受体结合继而发生收缩血管,激活交感神经系统,促进心肌细胞增生等。本实验主要考察组织中AngⅡ的水平,DHBF未降低心脏组织的AngⅡ(与卡托普利不同),推断可能通过直接阻断AT1 受体表达从而抑制其后续信号激活与信号转导。AngⅡ可通过非ACE途径产生,ARB 也可以使AngⅡ水平升高,致使应用ACEIs/ARBs 时醛固酮逃逸,逃逸的醛固酮进一步诱导心肌间质纤维化及心肌肥厚,加重心室重构及心力衰竭(HF)进展[13]。体外实验证实ALD 诱导心肌纤维细胞促进胶原的合成;在动物实验中,醛固酮拮抗剂螺内酯可预防心肌间质胶原的分泌。DHBF 能够降低ALD 的水平,也是其抑制心肌肥厚的一个重要因素,也是天然产物多靶点的一个优势。
高血压左室心肌病变的典型表现是心室重构。血管紧张素Ⅱ通过对心肌的直接作用和间接作用,调节心脏收缩力,进而引起心肌细胞肥大和心脏非心肌细胞增生,两种作用均通过AT1 受体介导[14]。AT1 的表达与心肌纤维化直接相关[15]。AT2 受体的表达与生长状态和生长因素有关,在胚胎和胎儿发育期大量表达,出生后表达下降;但在某些病理情况下AT2 受体的表达将会上调[16]。AT2 受体调节血管舒张和改善血管重塑作用与其参与缓激肽-NOcGMP 链式连锁反应和刺激平滑肌细胞凋亡有关[17]。本实验结果中,DHBF 可以降低高血压大鼠的血压,但降压作用不及阳性对照药卡托普利。病理结果显示DHBF 能抑制高血压大鼠的心肌肥厚,这与之前的病理及心脏超声检查结果一致[18]。DHBF 抑制心肌肥厚不仅仅与其降低血压有关,DHBF 能够使高血压大鼠心脏AT1a的表达下调,在之前的研究中,我们观察到DHBF 对炎症因子TNF-α 和IL-β 都有抑制作用[19]。TNF-α 和IL-β 都能增加AT1 受体的表达,它们之间的效应是叠加的。AngⅡ通过AT1 受体激活NF-κB,并因此增加促炎因子的转录,因此,我们推测DHBF 可能部分通过对炎症因子的抑制作用,从而阻断AT1受体表达。
本课题组前期研究证实DHBF 对AngⅡ诱导的心肌细胞肥大有明显的抑制作用[20],结合本实验结果,推断DHBF 可能的抑制心肌肥厚的机制是一方面通过抑制RAAS 系统,一方面调节炎症因子[21],从而抑制心肌细胞蛋白合成和肌球蛋白基因的表达[10];抑制血管内皮细胞收缩、合成和分泌ET[21],从而抑制过度增强的心肌收缩力,抑制对心室肌细胞和成纤维细胞的促生长作用,调节基质金属蛋白酶的比例[18],抑制基底膜上的Ⅳ型胶原的降解,抑制冠状动脉的通透性增加,抑制如胰岛素样生长因子、成纤维细胞生长因子等多种生长因子的增加,抑制相应的蛋白激酶的激活等一系列信号转导,抑制c-myc、c-fos、cjun 等原癌基因的表达[10],抑制心肌细胞DNA 的复制,RNA 和蛋白质合成,从而抑制心肌肥厚。
