二氧化氯气体对葡萄链格孢菌的抑制作用
2021-01-29康慧芳乔勇进刘晨霞张怡孙大鹏仝潇洋
康慧芳,乔勇进,刘晨霞,张怡,孙大鹏,仝潇洋
1(上海市农业科学院,农产品保鲜加工研究中心,上海, 201403)2(上海师范大学 生命科学学院,上海, 200235)3(上海农产品保鲜加工工程技术研究中心,上海, 201403)4(内蒙古农业大学 食品科学与工程学院, 内蒙古 呼和浩特,010018)
葡萄为葡萄科(Vitaceae)葡萄属植物,落叶藤本,果实营养丰富、味甜多汁、富含香味,集食疗价值、医用价值[1]、美容价值和商业价值于一身,深受广大消费者青睐。然而葡萄是不耐贮藏水果之一,果实皮薄肉软,采后极易受病原微生物侵染[2],由此造成了巨大的经济损失。其中,交链孢霉腐病是葡萄果实最为突出的采后病害之一,主要致病菌为链格菌(Alternariaalternata),其对生态环境的适应能力强,生长繁殖快,严重影响寄主的质膜透性、酶活性、激素平衡及其他生理代谢过程,从而造成果实大量腐烂[3-4]。
二氧化氯气体(ClO2)是一种安全高效的氧化性灭菌消毒剂,目前已被众多国家广泛应用于食品生产、饮用水、医疗器械、室内污染、公共卫生等方面的消毒杀菌[5-9]。目前已有大量研究表明,ClO2可以抑制或灭活细菌或真菌,可用于果蔬的保鲜,而关于ClO2对链格孢菌的研究鲜有报道。
本文将采用不同浓度的ClO2对离体链格孢菌和活体链格孢菌处理不同的时间,以不做任何处理作为对照处理,探索ClO2对葡萄链格孢菌的影响。通过测定与菌体相关的指标,研究ClO2对链格孢菌的抑制作用及抑菌机理,并在葡萄果实上接种验证,旨在为ClO2在葡萄贮藏保鲜中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
实验所用的葡萄品种为“巨峰”,购于上海市奉贤区嘉园路87号水果店,挑选色泽、大小一致,且无机械损伤、无病虫害的果实,购买当天装在水果泡沫箱中运回冷库预冷并贮藏于(4±0.5)℃的冷库中。葡萄链格孢菌来源于华东师范大学生命科学学院,马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基中,4 ℃冰箱保存。
稳定性ClO2溶液(氯酸盐溶液及柠檬酸颗粒)购于国药化学试剂有限公司;ClO2母液的配制:取氯酸盐溶液10.0 mL,加入1.0 g活化剂,反应2 min后加入蒸馏水定容至1 000 mL,即为ClO2母液,现用现配。
乙酸、无水乙酸钠、邻苯二酚、H2O2、愈创木酚、吐温-80、PDA培养基、无水乙醇、聚乙二醇(polyethylene glycol, PEG)、聚乙烯吡咯烷酮(polyvinyl pyrrolidone, PVPP)、Triton X-100(均为分析纯),国药集团化学试剂有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、丙二醛(malondialdehyde,MDA)试剂盒,南京建成科技有限公司。
1.2 仪器与设备
Ultrospec 3300pro酶标仪,美国安马西亚公司;HVE-50高压蒸汽灭菌锅,日本托米公司;CA-1480超净工作台,上海上净净化设备有限公司;D37520 Osterode高速冷冻离心机,德国Biofuge公司;DHG-9240A电热恒温鼓风干燥箱,上海益恒实验仪器有限公司;打浆机,广东美的生活电器制造有限公司;SPX-250 B-Z生化培养箱,上海博讯实业有限公司医疗设备厂;XB-K-25血球计数板,上海求精生化仪器有限公司;IX71-A21PH倒置显微镜,日本奥林巴斯有限公司;GT-903泵吸式二氧化氯检测仪,深圳市科尔诺电子科技有限公司;CRR-001高精度配气仪,北京康尔兴科技发展有限公司。
1.3 试验方法
1.3.1 孢子悬浮液的制备
采用LACHHAB等[10]的方法,将链格孢菌接种在PDA培养基上,在环境为(25±1)℃恒温培养箱中培养7 d待菌丝长出,再用直径为0.6 cm的打孔器在培养皿边缘补位取5个菌碟置于加入10 mL含0.05%(体积分数)吐温-80无菌水的50 mL小烧杯中, 充分搅拌10 min洗孢子,经双层纱布过滤至另一个离心管中,再加入5 mL无菌水,用红血球计数板计数,用无菌水将菌悬液中孢子浓度调整至1×106个/mL,备用。
1.3.2 实验处理
1.3.2.1 实验原理
ClO2处理葡萄链格孢菌的离体菌和活体菌的操作原理如下:将ClO2母液配制好倒置于透明塑料箱中密封放置一段时间,待气体大量产生时接通塑料管道,将气体缓慢输入配气仪,并通过调节配气比例,输出连续、稳定的标准气体浓度,并将气体输入到含有链格孢菌菌悬液的PDA培养基或者接种了链格孢菌葡萄的密闭塑料箱中,同时塑料箱的另一端用塑料管连接ClO2测定仪,当测定仪达到所需浓度时顷刻关闭配气仪并启动计时表。操作过程均在超净工作台进行,且操作前用75%(体积分数)酒精将塑料箱、高精度配气仪及ClO2测定仪擦拭3遍,后于超净工作台紫外杀菌过夜。另外在实验前要根据所需气体浓度,不断尝试并设定可短时间内达到该气体浓度的配气比例为正式试验做准备。ClO2浓度计算如公式(1)所示,公式(1)由深圳市科尔诺电子科技有限公司提供。
ClO2浓度=配气仪显示值(ppm)×67.46×22.4
(1)
式中:ClO2浓度单位为mg/m3,1 mg/m3=1 μg/L;67.46为ClO2分子质量;22.4为特定系数。
1.3.2.2 离体实验
取20 μL菌悬液滴在PDA培养基中心,室温条件下放置4 h后放入消毒特制密闭箱中,在室温(25±1)℃、空气湿度为85%的条件下通入ClO2,使箱内ClO2浓度分别达到1.5、3.0、4.5、6.0、7.5、9.0 μg/L,且处理时间分别为10、20、30 min,然后置于(25±1)℃的生化培养箱中培养,以不做任何处理作为对照处理,每天测定1组数据,直至对照组(CK组)菌落长满培养皿。以6个培养皿为1个处理,每个处理设计3个重复。
1.3.2.3 活体接种实验
选择外观整齐、无病虫害和机械损伤的番茄果实,用自来水将果面冲洗干净,然后用0.2%(体积分数)的次氯酸钠溶液浸泡2 min,接着用75%(体积分数)酒精浸泡1 min,再用无菌水冲洗3次,晾干后用无菌剪刀剪下葡萄果实(保留果梗)后,用直径2 mm的灭菌接种针在果实赤道部刺伤(深度3 mm),滴入10 μL的菌悬液,室温条件(20±1)℃下放置在上述特制密闭箱中4 h后,分别用3.0、6.0、9.0 μg/L的ClO2处理30 min,以在密闭箱中不通入ClO2为对照处理。每2 d测定1组数据,第10天时测定其落果率、果梗腐烂率以及失重率3项指标。每个处理组取200粒葡萄,设置3个重复。
1.3.3 指标测定
1.3.3.1 ClO2对链格孢菌菌丝生长的抑制作用
用十字交叉法统计每天链格孢菌的菌落直径(cm),用第6天时的菌落直径来计算菌丝生长抑制率。菌落生长抑制率计算如公式(2)所示:
菌落生长抑制率/%
(2)
1.3.3.2 链格孢菌菌丝状态倒置显微镜观察
分别在PDA培养基中滴入20 μL浓度为1×106个/mL的链格孢菌菌悬液,超净工作台放置4 h后通入质量浓度为1.5、3.0、4.5、6.0、7.5、9.0 μg/L的ClO2处理10、20、30 min,不做任何处理设为对照组(CK组),放置在25 ℃的恒温培养箱中培养。24 h后用无菌刀在中央位置取2 cm×2 cm×2 cm的培养基小块,制成玻片在倒置显微镜下观察并拍照,每个玻片取不同的7个视野观察并拍照,每组设置3个重复。
1.3.3.3 ClO2对链格孢菌芽管伸长的抑制作用
将离体菌如1.3.3.2处理,25 ℃培养箱培养24 h后,在倒置显微镜下观察并用显微镜上的测量尺测量每组芽管的长度(μm)并记录,计算芽管生长抑制率。芽管生长抑制率计算如公式(3)所示:
芽管伸长抑制率/%
(3)
1.3.3.4 ClO2对链格孢菌孢子萌发的抑制作用
将上述培养6 d后的链格孢菌用直径为0.6 cm的打孔器在培养皿边缘取3个菌碟,无菌水洗孢子并用托马计数池进行计数,每组处理重复3次,通过公式(4)计算孢子萌发抑制率:
(4)
1.3.3.5 ClO2体对葡萄果实病害和贮藏品质的影响
每3 d统计病斑直径及病斑率,病斑直径采用十字交叉法,取平均值;病斑直径若>0.5 mm,则确定为发病,发病率计算如公式(5)所示:

(5)
1.3.3.6 抗性酶活力的测定
过氧化物酶(peroxidase,POD)活性采用愈创木酚法测定;多酚氧化酶(polyphenol oxidase,PPO)活性采用邻苯二酚比色法测定;MDA含量、CAT、SOD活性采用试剂盒测定。
1.4 数据处理
实验数据运用Excel 2007和 Origin 8.0 软件对数据进行处理分析,P<0.05为差异显著,P<0.01为差异极显著,P>0.05为差异不显著。
2 结果与分析
2.1 ClO2对链格孢菌菌丝体的影响
由表1可知,与对照组相比,各浓度ClO2处理对链格孢菌菌丝生长均有不同程度的抑制作用,且随着ClO2浓度的增加及时间的延长,对链格孢菌菌丝生长的抑制效果也逐渐增强,其中9.0 μg/L ClO2处理组的抑制率显著大于其他各组(P<0.05),培养第6天, 9.0 μg/L ClO2处理10 min和20 min时菌丝抑制率分别达到50.13%和84.88%,而9.0 μg/L ClO2处理30 min的培养皿从第1天~第6天,均未见菌丝长出,可能在滴取孢子悬浮液后并进行气体处理时,9.0 μg/L ClO2在30 min内将链格孢菌的孢子全部杀死,因此在培养过程中,没有孢子可以萌发乃至长出菌丝。

表1 ClO2对链格孢菌菌落生长的抑制作用
2.2 ClO2对链格孢菌芽管伸长的抑制作用
由图1可知,滴有链格孢菌孢子液的培养皿经不同浓度ClO2处理并培养24 h后,与对照组相比,ClO2处理对链格孢菌芽管伸长均有不同程度的抑制作用。随着ClO2浓度的增加和时间的延长,芽管伸长抑制率基本呈上升趋势,其中9.0 μg/L ClO2处理10 min时,芽管伸长抑制率高达87.59%,显著高于其他各组(P<0.05),而9.0 μg/L ClO2处理20、30 min时均未有孢子萌发,未见芽管伸长。
2.3 ClO2对链格孢菌孢子萌发的抑制作用
如图2所示,培养皿经不同浓度ClO2处理并在28 ℃生化培养箱中培养6 d后,经0.05%(体积分数)吐温-80和无菌水清洗并观察计算,发现ClO2处理组对链格孢菌孢子萌发均有不同程度的抑制作用,且链格孢菌孢子萌发抑制率和ClO2浓度以及处理时间基本成正比,ClO2浓度越大,处理时间越长,链格孢菌的孢子萌发抑制率越大,其中9.0 μg/L ClO2处理20 min,抑制率高达96.67%,显著高于其他处理组(P<0.05),而9.0 μg/L ClO2处理30 min时,6 d内均未见菌丝生长,链格孢菌孢子萌发抑制率是100%。
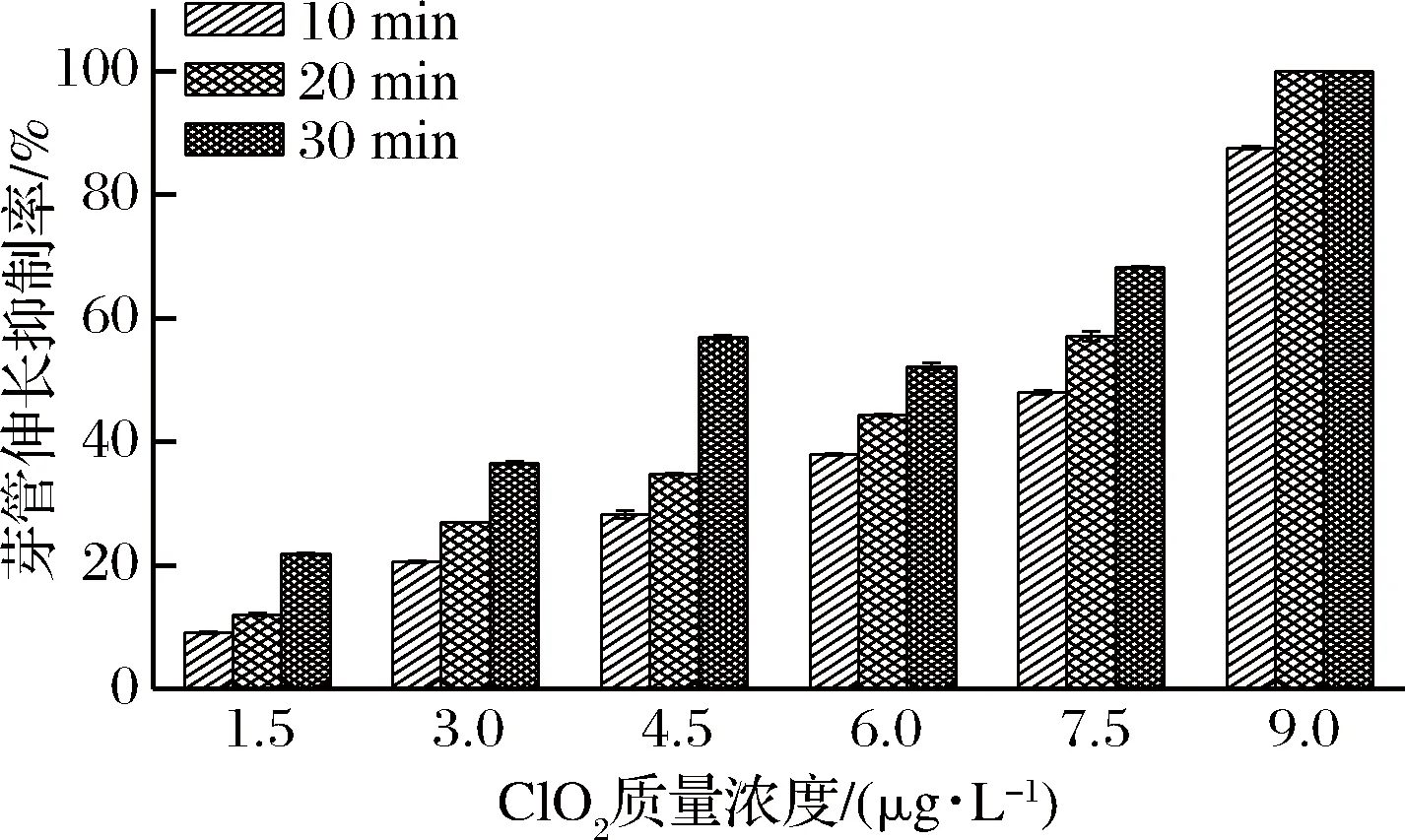
图1 ClO2对链格孢菌芽管伸长的抑制作用

图2 ClO2对链格孢菌孢子萌发的抑制效果
2.4 ClO2对链格孢菌菌丝形态的影响
如图3所示,与对照组相比,经ClO2处理培养的链格孢菌菌丝密集程度显著下降,且ClO2处理组的菌丝表面粗糙且出现沟壑。而对照组的菌丝相当密集,有很多孢子在菌丝间长出,边缘菌丝稀疏处可以观察到菌丝表面光滑,紧密环绕。由此说明ClO2处理对链格孢菌孢子有一定失活效果,且对菌丝造成了很大损伤,高浓度可能会造成菌丝断链。
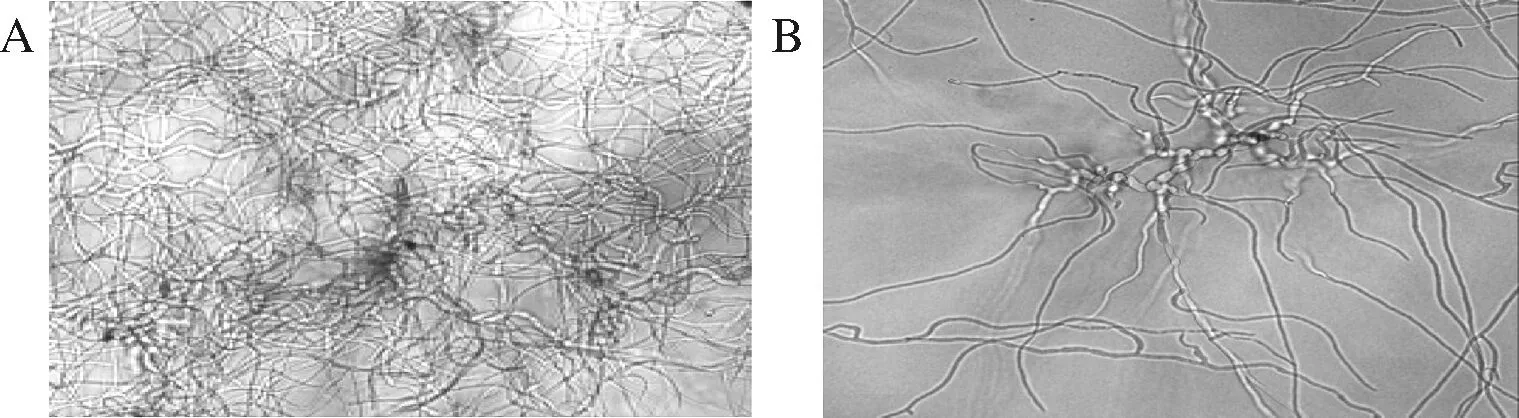
A-对照处理;B-9.0 μg/L ClO2处理-10 min
2.5 ClO2对葡萄果实发病率的影响
如图4所示,各组葡萄接种链格孢菌后逐渐开始染病,接种第2天~第8天,ClO2处理组的果实发病率显著低于对照组(P<0.05),接种第10天,CK组和3.0 μg/L ClO2处理组发病率均达到100%,而9.0 μg/L ClO2处理30 min时仅为47.71%,显著低于其他各组(P<0.05),综上说明质量浓度为9.0 μg/L的ClO2处理30 min能显著降低葡萄采后交链孢霉腐病的发病率。
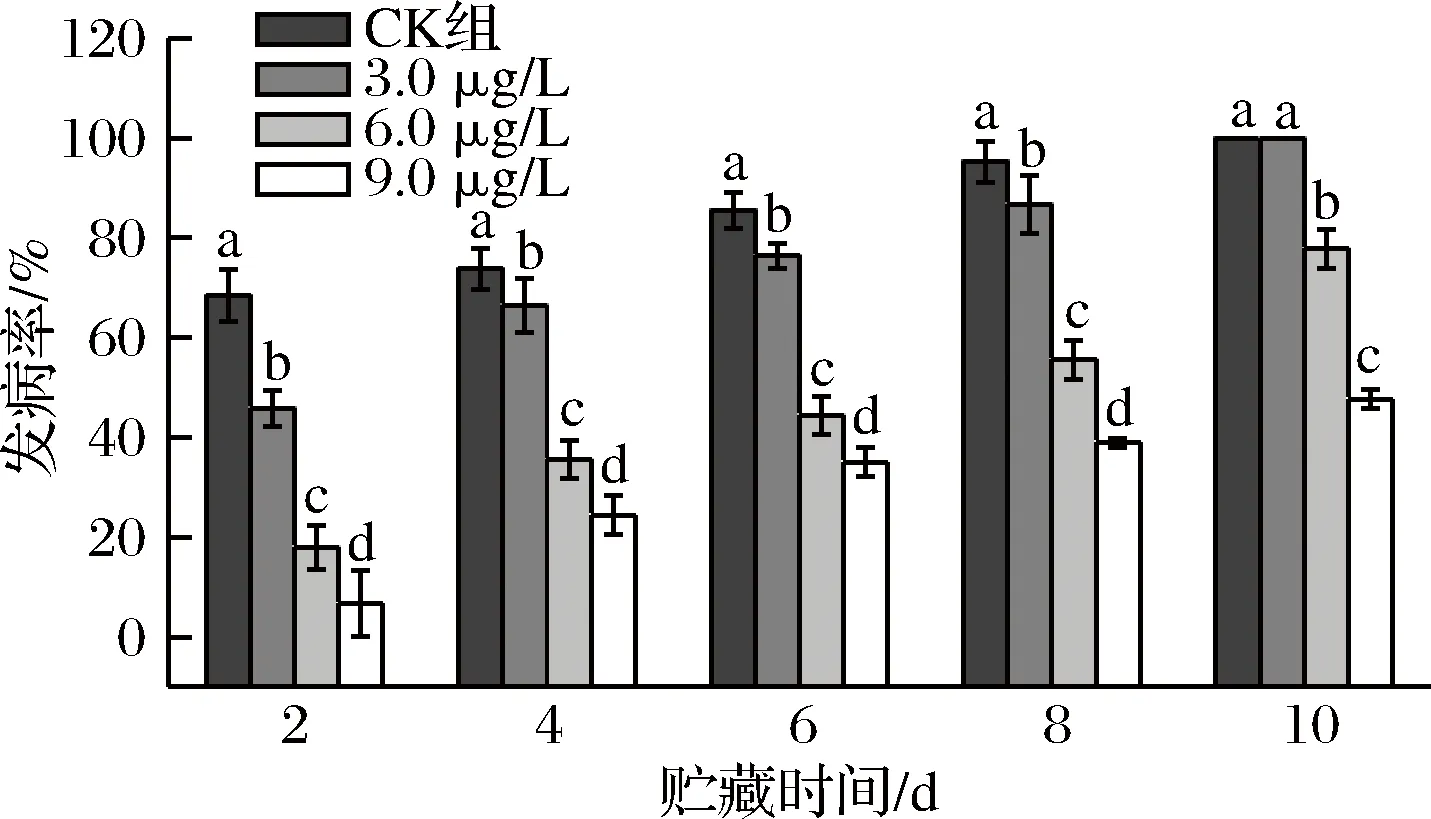
图4 ClO2对葡萄发病率的影响
2.6 ClO2对葡萄果实中MDA含量的影响
如图5所示,接种链格孢菌后,葡萄果实内的MDA含量均呈上升趋势,这是由于果实损伤导致。经ClO2处理的果实MDA含量均低于对照处理,从第2天开始,9.0 μg/L ClO2处理30 min时果实中的MDA含量均显著低于其他各组(p<0.05),贮藏至第10天,9.0 μg/L 30 min处理组的MDA含量仅为 9.84 nmol/g,低于对照组4.83 nmol/g。说明经质量浓度为9.0 μg/L的ClO2处理葡萄能有效减缓果实内部自由基对细胞膜的损伤。
2.7 ClO2体对葡萄果实中POD和PPO活性的影响
由图6-A可知,葡萄接种链格孢菌后,贮藏期间各组果实的POD活性均呈先上升后下降的趋势,对照组和9.0 μg/L ClO230 min处理组的POD活性在贮藏第4天达到高峰,而6.0 μg/L和9.0 μg/L ClO230 min处理组的POD活性均在第6天才达到高峰,且后者POD活性峰值显著大于前者(P<0.01),9.0 μg/L ClO230 min处理组的POD活性值显著大于其他各组(P<0.05),贮藏至第10天,该处理组的POD活性值为0.45 U/g,是对照组的2.14倍,说明9.0 μg/L ClO230 min 处理组能促使果实保持较高的POD活性。
由图6-B可知,各组果实中的PPO活性均在上升和下降中来回波动,前4 d贮藏期间,各组果实的PPO活性值基本趋于下降趋势,其中9.0 μg/L ClO230 min 处理组的PPO活性显著大于其他各组(P<0.01),第4天开始,各组PPO活性值均逐渐上升,第8天,9.0 μg/L ClO2处理组达到了最大值,PPO活性值为3.81 U/g,是对照组的3.97倍,接着出现下降趋势,但贮藏至第10天,9.0 μg/L ClO2处理组的PPO活性值依然居于首位,达到 2.61 U/g。综上说明经质量浓度为9.0 μg/L的ClO2处理能够更快的诱导果实PPO活力的上升,并促使PPO活力保持较高水平。
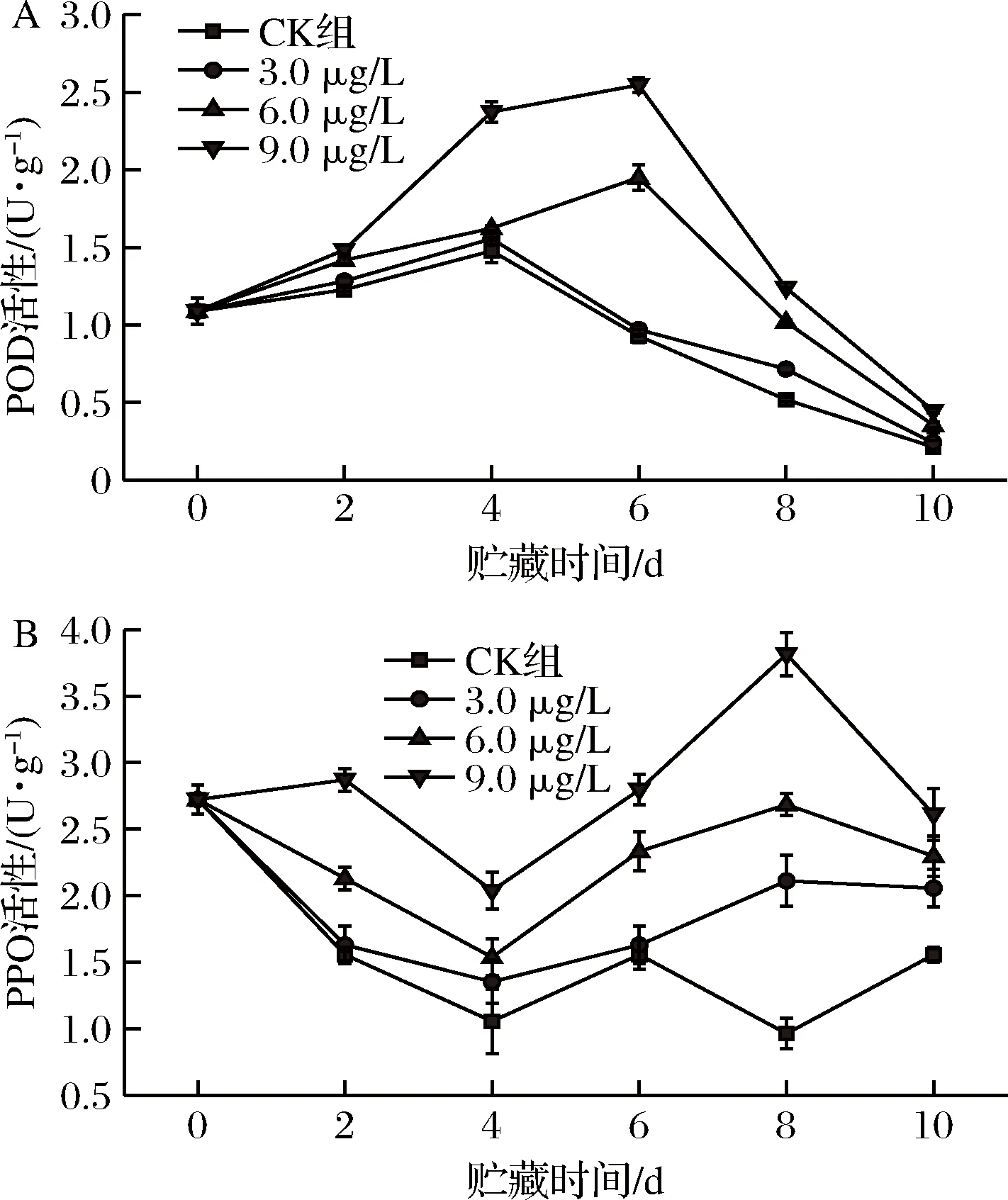
A-POD活性;B-PPO活性
2.8 ClO2对葡萄果实中 CAT和SOD活性的影响
SOD是浆果中普遍存在的抗氧化酶类,它能将超氧阴离子歧化为H2O2和O2,从而起到清除活性氧、维持活性氧平衡、保护膜结构的作用[11-12]。如图7-A所示,接种链格孢菌后,各组果实SOD活性均呈先下降后上升,后期回降的趋势,而9.0 μg/L ClO230 min 处理组的活性值一直显著高于其他各组(P<0.05)。贮藏前6 d,各组SOD活性值均呈下降趋势,其中9.0 μg/L ClO230 min 处理组的活性值一直居于首位,第8天,各组SOD活性值均出现峰值,其中9.0 μg/L ClO230 min 处理组的SOD活性值最高,为43.86 U/g,是对照组的1.37倍。贮藏至第10天,9.0 μg/L ClO230 min 处理组的SOD活性值依然居于首位,为33.89 U/g,显著高于其他各组(P<0.01)。综上说明果实经质量浓度为9.0 μg/L的ClO2处理30 min时能保持较高的SOD活性。
CAT 是果实后熟衰老中的保护性酶类,它能催化果蔬体内积累的H2O2分解,从而减少H2O2对果蔬组织造成的伤害[13-14]。由图7-B可知,夏黑葡萄接种链格孢菌后,各组果实CAT活性均在下降与上升的趋势之间波动,贮藏第6天,各组CAT活性达到了峰值,其中9.0 μg/L ClO230 min处理组的CAT活性值显著高于其他各组(P<0.01),第6天开始各组CAT活性值开始下降,其中9.0 μg/L ClO230 min处理组下降速度相对比较缓慢,而第8天后开始上升,贮藏到第10天,9.0 μg/L ClO230 min处理组的CAT活性值依然居于首位,值为2.69 U/g,高于对照组0.96 U/g。由此表明,应用9.0 μg/L的ClO2处理夏黑葡萄30 min,能够有效减缓H2O2的清除效率,延缓CAT活性的降低。
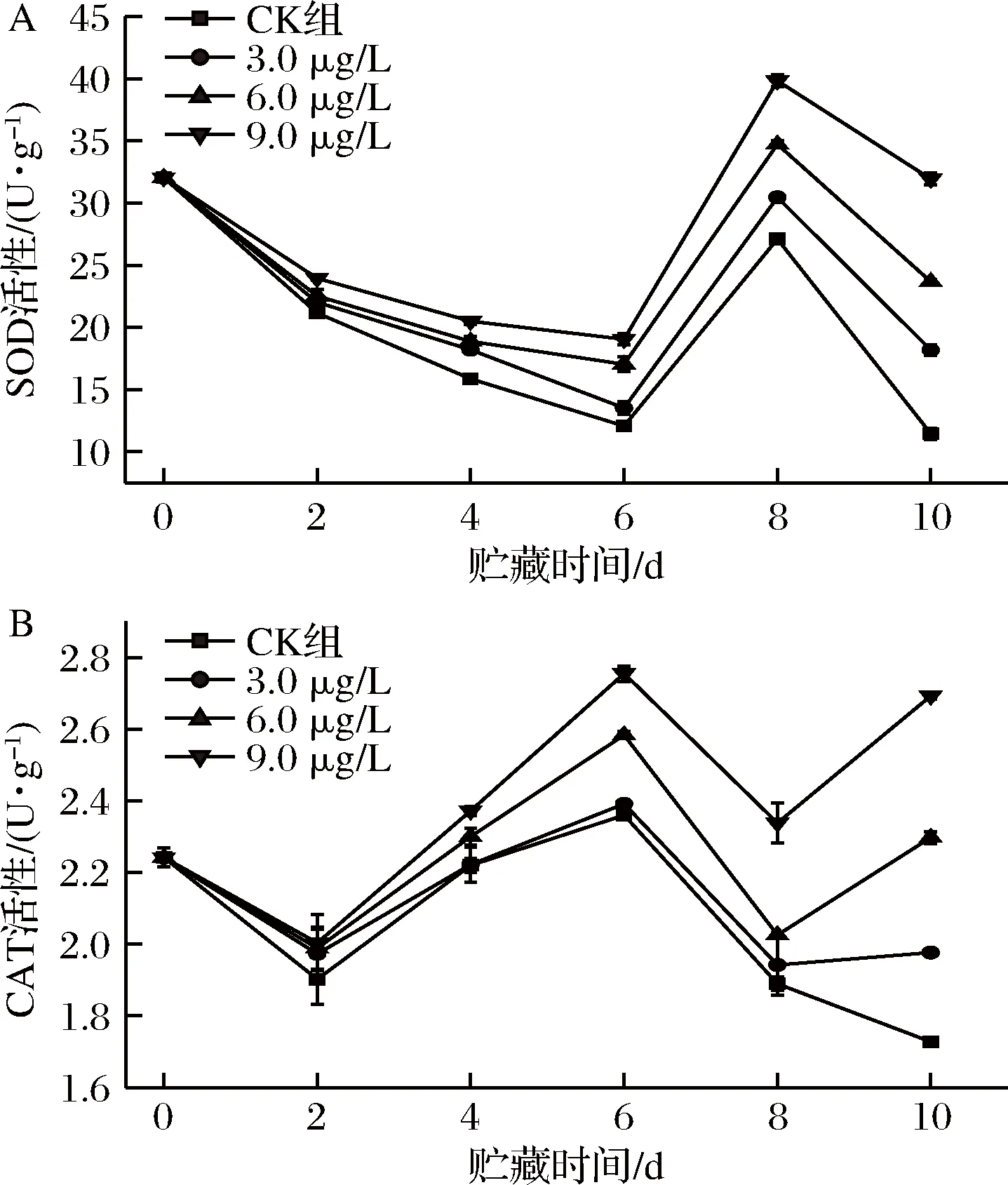
A-SOD活性;B-CAT活性
3 讨论
研究不同浓度ClO2对离体链格孢菌的抑制效果,结果表明ClO2浓度越大,处理时间越长,抑制效果越好。韦明肯等[15]研究发现ClO2可以氧化氨基酸使蛋白质变性,进而对果蔬起到杀菌消毒的作用。本实验采用菌丝生长速率法和孢子萌发法测定了不同浓度ClO2对链格孢菌的影响,结果发现,随着ClO2浓度的增大和时间的延长,离体链格孢菌的抑制效果越来越好,9.0 μg/L的ClO2处理离体菌10 min时,芽管伸长抑制率为87.58%,孢子萌发抑制率为88.33%,菌落生长抑制率高达50.13%,各项指标都显著高于其他各组(P<0.05),且在高倍显微镜下观察,链格孢菌菌丝内部细胞质凝集,菌丝空洞化、发黑变粗、萎缩,而9.0 μg/L的ClO2处理30 min时,整个培养期间都未见菌丝长出。由此可见在起初处理时间内,9.0 μg/L的ClO2杀死了链格孢菌的孢子,导致后期没有孢子萌发乃至菌丝长出。
病原菌侵染葡萄浆果后,SOD、CAT、POD以及电子传递相关的PPO等组成了一个有效的活性氧自由基清除系统,能有效维持自由基在植物体内产生和清除的动态平衡,保持膜结构的完整性,增强果实抵抗病害的能力[16-17]。9.0 μg/L ClO2密闭熏蒸接种后的葡萄果实30 min,能够在贮藏期间有效保持较高的PPO和POD活性,贮藏到第10天,PPO活性值是对照组的1.67倍,POD活性值是对照组的2.10倍。研究结果与集贤等[18]研究ClO2溶液对接种灰霉菌的采后葡萄进行处理,可增强果实抗性这一结果类似。且9.0 μg/L ClO2处理组能够有效减缓果实内部自由基对细胞膜的损伤,这一结果与前面果实贮藏期间能保持较好的抗氧化性结果相互对应。另外,9.0 μg/L ClO2处理组可以有效抑制果实CAT活性的降低和果实腐烂率的升高,贮藏到第10天,CAT活性值高于对照组0.96 U/g。同时,9.0 μg/L ClO2处理组还能够保持较高的SOD活性,对抗与阻断因氧自由基对果实细胞造成的损害,并及时修复果实受损细胞,延缓交链孢霉腐病对浆果的损害。
4 结论
ClO2能够有效抑制离体链格孢菌的菌丝生长、芽管伸长以及孢子萌发,并对链格孢菌菌丝造成损伤,且ClO2浓度越高,处理时间越长,抑菌效果越好。当链格孢菌的孢子浓度为1×106个/mL时,9.0 μg/L ClO2处理30 min可完全抑制孢子的萌发。
ClO2处理降低了接种链格孢菌葡萄果的发病率,减少了果实内MDA含量的积累,维持了较高的PPO和POD活性,且CAT和SOD活性在接种病原菌后一直保持显著高于对照组的水平,有效维持自由基在植物体内产生和清除的动态平衡,增强果实抵抗链格孢菌的侵染能力,其中效果最好的处理组是9.0 μg/L ClO2处理30 min。
