UHPLC/Q-Orbitrap-MS结合化学计量学方法研究酸枣仁入血成分
2021-01-29武锦春杜晨晖秦雪梅
武锦春,杜晨晖,秦雪梅,闫 艳*
(1.山西大学 中医药现代研究中心,山西 太原 030006;2.山西中医药大学 中药学院,山西 晋中 030619)
中药的精髓在于多组分、多环节协同发挥效应。多数情况下,中药需要吸收入血,通过代谢转化生成活性产物后才能发挥整体药效作用。因此,选取有效成分时,应与药效和代谢关联分析才更精准、全面[1]。此外,当机体处于不同状态下药物的分布及消除明显不同[2],因此考察病理状态下中药成分在体内的吸收、代谢等过程更有意义。中药的化学成分复杂,加之内源性成分的干扰使得检测和鉴定药源性代谢物十分困难。经典的体内代谢产物鉴别方法是通过比较空白样品和给药后样品的色谱图,从复杂的背景中提取低响应的药源性代谢产物的信号,但该方法周期长、成本高。化学计量学具有大数据运算的优势,能在不损失信息的情况下,通过变换和构造模型,使复杂数据简单化[3-4]。将化学计量学的主成分分析(PCA)、偏最小二乘判别分析(PLS-DA)和正交偏最小二乘判别分析(OPLS-DA)应用于中药体内代谢产物的鉴别分析中,将大大加快从化学测量数据中最大限度提取有用化学信息的速度,提高鉴别准确性。
酸枣仁为鼠李科植物酸枣ZiziphusjujubaMill.var.spinosa(Bunge) Hu ex H.F.Chou的干燥成熟种子,具有养心补肝、宁心安神、敛汗、生津之功效[5],是中医治疗失眠之要药。药理学研究表明,酸枣仁水提物具有镇静催眠、抗焦虑性抑郁等作用[6-7];其醇提物具有抗心律失常、抗心肌缺血等作用[8]。植物化学研究表明,酸枣仁本底化学成分基本清晰,主要含有皂苷类、黄酮类、生物碱类和脂肪酸类成分[9]。酸枣仁体内代谢研究虽有报道,但多集中于酸枣仁总黄酮部位或几个主要单体化合物的研究[10-12]。本课题组前期采用超高效液相色谱-静电场轨道离子阱质谱(UHPLC/Q-Orbitrap-MS)研究了正常大鼠灌胃酸枣仁水提物后的入血成分[13],然而对于失眠模型大鼠口服给予酸枣仁水提物的入血成分研究尚属空白。
高分辨质谱仪能获得准确、丰富的数据信息,同时利用化学计量学大数据运算的优势,可使复杂信息简单化,能够快速、准确识别目标成分。因此,本文采用UHPLC/Q-Orbitrap-MS结合化学计量学方法,研究对氯苯丙氨酸(PCPA)诱导的失眠模型大鼠口服给予酸枣仁水提物后的入血成分。通过对比模型组与给药组大鼠血清样品的色谱数据,并结合PCA和OPLS-DA等化学计量学方法发现并识别入血成分。该方法可快速、全面地检测潜在药物入血成分,为进一步阐明酸枣仁药效物质基础及进行质量控制提供参考依据。
1 实验部分
1.1 仪器、试剂与材料
Thermo fisher U3000超高效液相色谱仪,配置在线脱气机、四元梯度泵(HPG-3400RS)、柱温箱(TCC-3000RS)、自动进样器(WPS-3000TRS),Thermo ScientificTMQ ExactiveTMFocus质谱仪(德国Thermo公司);全自动氮吹浓缩仪(TV1603N21312,英国Biotage公司)。
乙腈(质谱级,西班牙Fisher公司),甲酸、甲醇(色谱级,德国Merck公司);实验用水为Milli-Q超纯水;其它试剂均为分析纯。
乌药碱(批号HC225036198)、木兰花碱(批号20160710)、维采宁Ⅱ(批号 HV187847198)、6‴-阿魏酰斯皮诺素(批号20160303)、斯皮诺素(批号20160314)、酸枣仁皂苷A(批号20160315)均购于宝鸡市辰光生物科技有限公司;酸枣仁皂苷B(批号20170210)购于南京春秋生物工程有限公司。经高效液相色谱(HPLC)归一化法测得对照品的质量分数均大于98%。
酸枣仁饮片购自山西振东道地药材有限公司(批号:20161108)。经山西中医药大学中药鉴定教研室杜晨晖副教授鉴定为鼠李科植物酸枣ZiziphusjujubaMill.var.spinosa(Bunge) Hu ex H.F.Chou 的干燥成熟种子,留样于山西大学中医药现代研究中心冷库。健康雄性SD大鼠(180~220 g),购于北京维通利华实验动物技术有限公司(SCXK京2016-0006)。
1.2 酸枣仁水提物的制备
酸枣仁(ZSS)水提物的制备参考课题组前期方法[14],取酸枣仁样品约100 g,粉碎(60%过1号药典筛),精密称定,加10倍量水,浸泡30 min,加热至沸,回流提取2 h,过滤。滤渣再加8倍量水,继续回流提取2 h,过滤,合并滤液,减压浓缩至0.5 g/mL(生药量计),冷冻干燥,得酸枣仁水提物冻干粉。
1.3 动物造模与给药
24只SD大鼠在室温22~24 ℃,相对湿度55%~65%的环境中适应性饲养1周后,随机分为2组:空白组(NC,n=6),模型组(IM,n=18)。模型组18只大鼠连续3 d腹腔注射PCPA混悬液400 mg/kg(0.5%羧甲基纤维素钠,0.5%CMC-Na)[15]。于第二天末注射后眼眶取血,NC组大鼠同法眼眶采血,离心(3 500 r/min,4 ℃,10 min),得血清。采用液相色谱-串联质谱(LC-MS/MS)法[16]测定血清中5-羟色胺(5-HT)的质量浓度。将18只造模成功大鼠随机分为3组,分别为IM组、给药(IM+ZSS)2 h组和4 h组。后两组于PCPA腹腔注射第三天后1 h开始给药(30 g/kg ZSS),连续给药5 d,每天2次,末次给药前禁食12 h(自由饮水)。NC组和IM组给予等体积的0.5%CMC-Na溶液。
1.4 样品采集及制备
IM组和NC组大鼠于末次给予0.5%CMC-Na溶液1 h后腹主动脉取血,IM+ZSS组大鼠分别于给药后2 h和4 h腹主动脉取血,离心(3 500 r/min,4 ℃,15 min),收集上清液,得血清样品,-80 ℃冷冻保存备用。
分别取2 h和4 h含药血清样品各100 μL等体积混合,其他组血清样品各取200 μL于1.5 mL EP管中,分别加入600 μL甲醇,涡旋混匀3 min,离心(13 000 r/min,4 ℃,10 min),转移上清液上样于Oasis PRIME HLB 96孔μElution提取板(Waters公司)进行抽滤,收集滤液。氮气吹干(37 ℃),残渣加100 μL初始流动相复溶,离心(13 000 r/min,4 ℃,10 min),转移上清液于内衬管中待分析。
质控(QC)样本的制备为随机抽取模型组和给药组的血清样品各2个,分别精密吸取50 μL制成混合样本,按照以上处理制备QC样本。
1.5 UHPLC/Q-Orbitrap-MS分析条件
1.5.1 色谱条件色谱柱为ACQUITY UPLC®HSS T3柱(150 mm×2.1 mm,1.8 μm),流动相为0.1%甲酸水(A)-乙腈(B)。洗脱梯度:0~8 min,5%~17%B;8~10 min,17%B;10~11 min,17%~18%B;11~12 min,18%~20%B;12~17 min,20%~23%B;17~22 min,23%~33%B;22~30 min,33%~60%B;30~32 min,60%~100%B;32~34 min,100%B;34~36 min,100%~5%B;36~40 min,5%B。流速为0.3 mL/min;柱温为40 ℃;进样量为3 μL。
1.5.2 质谱条件离子源:电喷雾电离(ESI)源;正、负离子切换扫描;工作模式:全扫描-数据依赖二级扫描(Full MS-ddMS2);质谱参数为:鞘气流速:30 arb(ESI+)、35 arb(ESI-);辅助气流速:10 arb;喷雾电压:3.5 kV(ESI+)、3.0 kV(ESI-);正离子模式下的归一化裂解能量(NCE)为20%、30%、50%,负离子模式下NCE为30%、45%、60%。毛细管温度:320 ℃;离子源温度:350 ℃;一级质量分辨率:70 000;扫描范围:m/z100~1 500;动态排除持续时间:8 s。
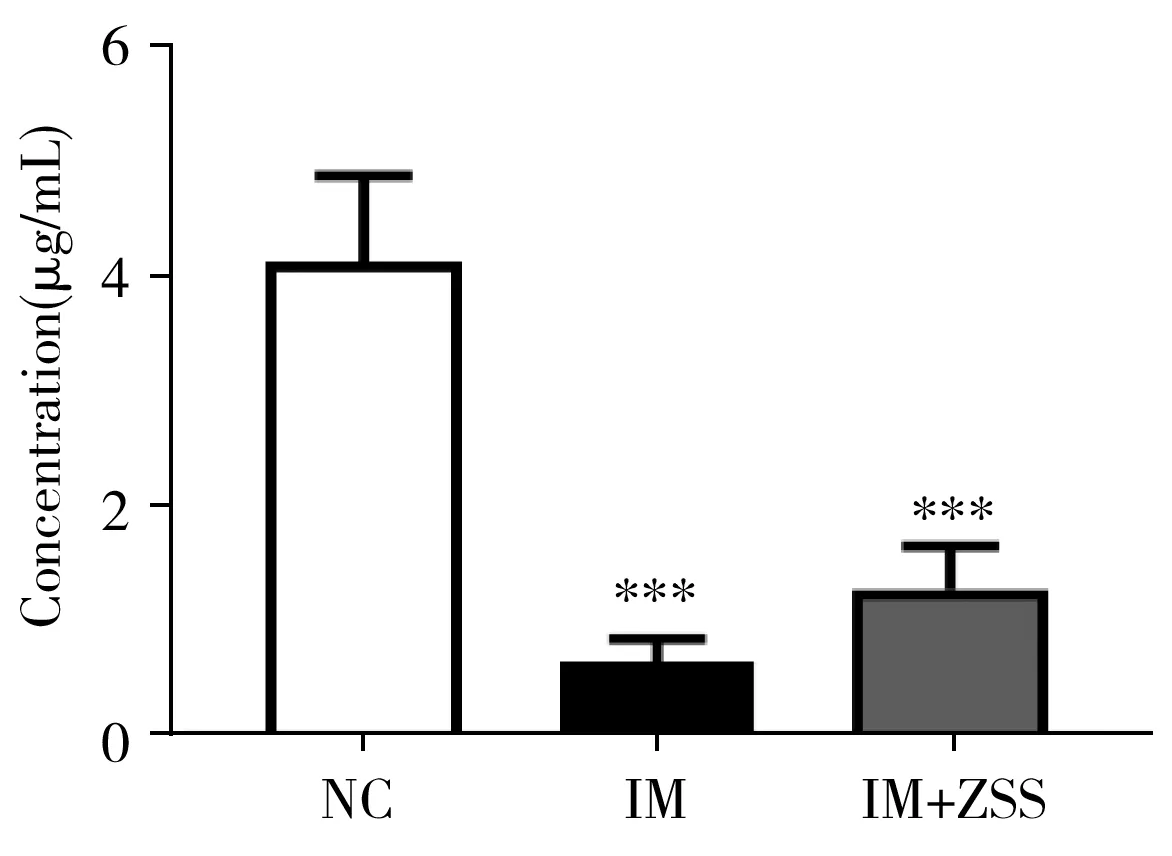
图1 各组大鼠血清中5-HT的质量浓度(n=6)Fig.1 The concentration of 5-HT in rat serum from each group (n=6) NC:normal control,IM:insomnia model,IM+ZSS: dosed group;***:significant difference
1.6 多元统计分析
LC-MS采集的原始数据经Thermo自带Compound Discoverer (CD) 3.0软件中Workflow TemplatesMetabolomicsUntargeted Metabolomics with Statistics Detect Unknowns with ID using Online Databases and mzLogic模块进行预处理。Workflow设置如下:Min Precursor Mass:100 Da,Max Precursor Mass:1 500 Da;S/NThreshold:1.5;Mass Tolerance:5 ppm;Min Peak Intensity:50 000;Max Element Counts:C90、H190、N10、Na2、O90、P3、S5;RT Tolerance:0.5 min;Ions:[M+H]+、[M+Na]+、[2M+H]+或[M-H]-、[2M-H]-、[M+FA-H]-、[2M+FA-H]-。经过软件进行峰提取、峰对齐、峰校准后得到一个保留时间、质荷比和强度的三维数据矩阵。对数据集的空缺值采用“80%原则”进行删减[17]。空缺值用该组最小值的1/5进行填充,并进行SUM归一化,数据导入SIMCA-P 14.0软件(Umetrics AB)进行标准化后,进行PCA和OPLS-DA等多变量分析,通过OPLS-DA的变量投影重要性分析(VIP)和S-plot图比较模型组与模型给药组的差异离子,结合VIP>1发现差异性的药源性代谢物。
2 结果与讨论
2.1 失眠大鼠模型的复制
与NC组大鼠相比,IM组大鼠表现为兴奋性增强,呈现易激怒、好争斗的状态;毛色暗淡、无光泽,脱毛现象明显;粪便呈灰黄色、质地软,排尿增多。各组大鼠血清中5-HT的质量浓度如图1所示,与NC组相比,IM组大鼠血清中5-HT的质量浓度显著降低,表明模型复制成功;与IM组相比,给予ZSS水提物(30 g/kg)后,IM+ZSS组大鼠血清中5-HT的质量浓度显著升高。结果表明,ZSS水提物(30 g/kg)可改善大鼠血清中5-HT的质量浓度,从而改善失眠。
2.2 直观分析与多变量统计分析
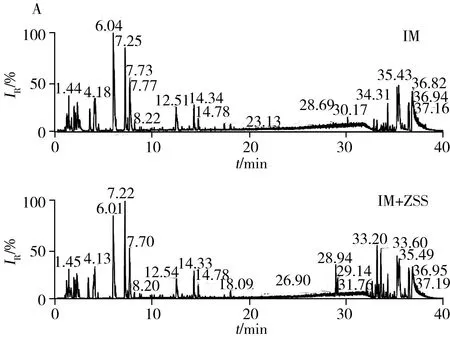
采用UHPLC/Q-Orbitrap-MS分析得到IM组和IM+ZSS组血清样本的基峰离子图见图2。利用CD软件对原始数据进行预处理,从正离子数据集提取46 644个信号离子,负离子数据集提取41 901个信号离子。
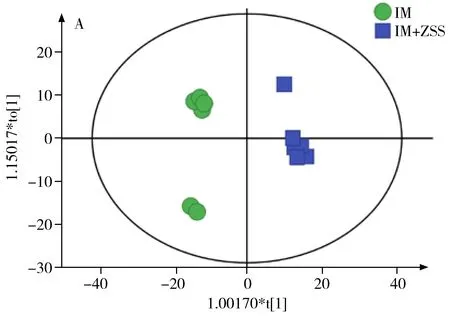
PCA是一种无监督的模式识别方法,能够真实地反映原始数据的分组情况。QC组、IM组及IM+ZSS组大鼠血清样本的PCA聚类得分图如图3所示,在正、负离子模式下,QC组、IM组和IM+ZSS组明显聚成3类。QC样品聚类良好,说明实验数据质量好。此外,IM组和IM+ZSS组沿t[2]轴分开,表明服用ZSS水提物是造成样品分类的主要原因。

根据来源,代谢指纹谱的变量理论上可分为3类:吸收的成分,新产生成分,药物干预改变的内源性代谢物。外源性成分及其代谢物仅出现在药物处理的样品中,所以当使用代谢组学技术时,药物处理模型组和模型对照组的差异主要来自外源性成分及其代谢物[18]。因此,为进一步找出IM+ZSS组相对于IM组的差异性药源成分,采用有监督的OPLS-DA对两组样本进行分析。
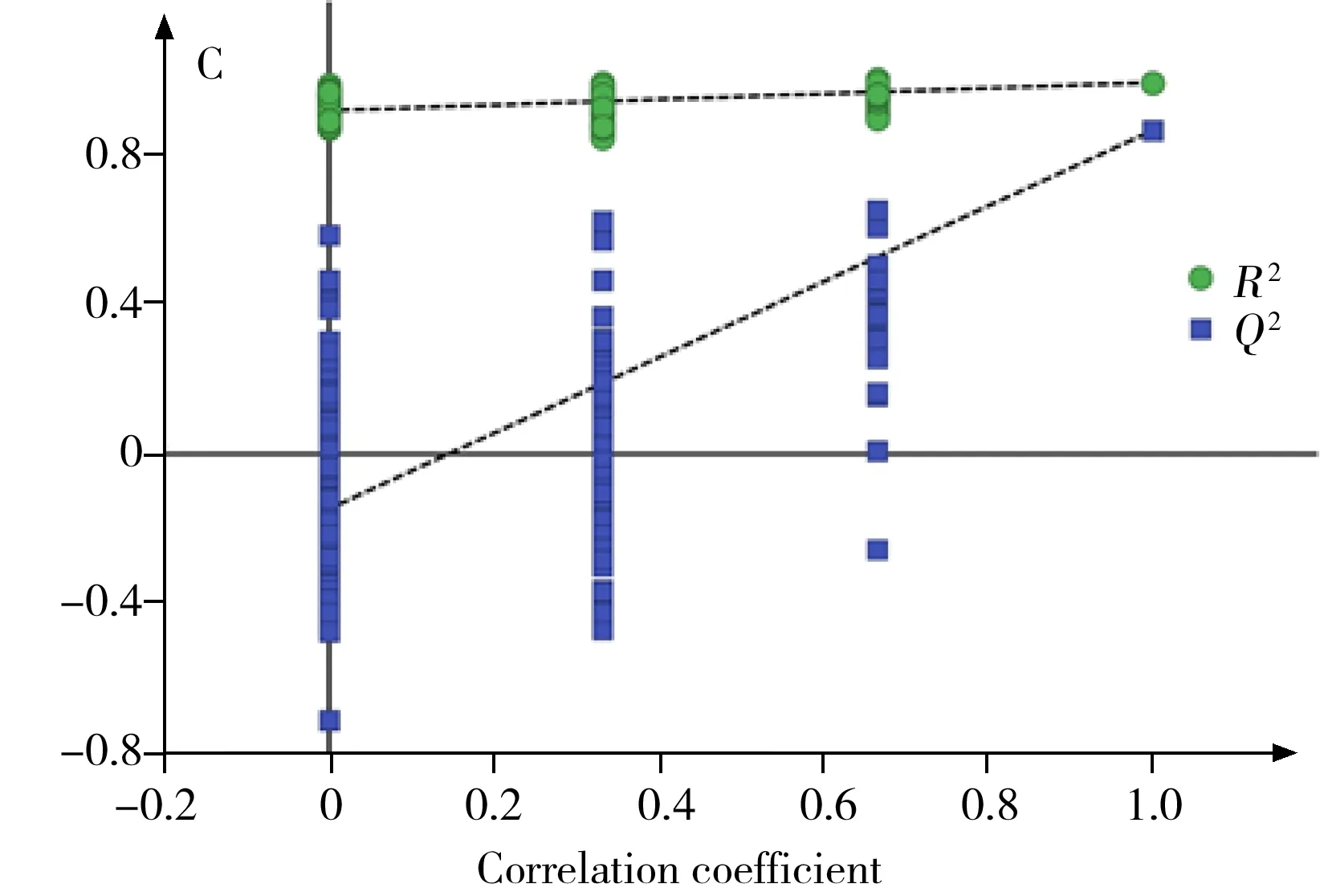
如图4A和4B所示,在正、负离子模式下,IM组与IM+ZSS组均可沿t[1]轴分开,R2X(cum,predictive+orthogonal)值分别为0.450和0.461,表明模型分别累积概括了PC1、PC2两种整体信息的45.0%和46.1%。R2Y(cum)值均为1,表明模型可解释因变量100%的变异信息。Q2(cum)值分别为0.858和0.904,表明模型可预测准确程度分别为85.8%和90.4%。用排列验证和交叉验证方差分析(CV-ANOVA)对模型进行验证。如图4C和4D所示,在正、负离子模式下,模型经200次置换检验,Q2点的回归线与Y轴交于负轴。此外,CV-ANOVA的p值分别为0.004 29和0.005 15(p<0.05),表明所建模型有效。如图4E和4F所示,在正、负离子模式下,S-plot图中代谢物距原点越远,对分组差异贡献 (VIP) 越大。

2.3 代谢产物的鉴别
将OPLS-DA模型所对应的S-plot载荷图和VIP>1作为酸枣仁水提物口服给予失眠模型大鼠后药源性入血原型成分和代谢产物的筛选标准。结果从正离子数据矩阵中提取出586个差异离子,负离子数据矩阵中提取出496个差异离子。这些离子应是酸枣仁外源性代谢物组的成分(原型成分或代谢产物),或是服用酸枣仁引起浓度改变的内源性成分。然而,酸枣仁原型成分及其代谢产物只能在服药后的样品中检出,而在模型对照组的样品未检出,内源性成分则在两组均能够检出,只是浓度有改变。通过对比模型对照组,在正离子模式下提取出61个潜在药源性物质;在负离子模式下提取出50个潜在药源性物质。最终,在正离子模式下共鉴定7个差异药源性代谢物,在负离子模式下共鉴定13个差异药源性代谢物,包括11个原型成分及9个代谢产物(见表1)。其中,将乌药碱、维采宁Ⅱ、木兰花碱、斯皮诺素、6‴-阿魏酰斯皮诺素、酸枣仁皂苷A及酸枣仁皂苷B与对照品比较进行鉴别。
2.3.1 生物碱及其代谢产物乌药碱为酸枣仁中含量较高的苄基异喹啉类生物碱[14]。如表1所示,正离子模式下,乌药碱(2号化合物)产生m/z286.141 45的分子离子峰,丢失NH3中性分子生成m/z269.12;m/z269.12相继丢失CH3OH和CO生成碎片离子m/z237.09和209.10,或相继丢失C6H6O、CH4O生成碎片离子m/z175.07、143.05。1号化合物与乌药碱具有相同的二级碎片,参考文献[19],推断其为6-葡萄糖乌药碱。正离子模式下,MA1和MA2分别产生m/z462.174 59和m/z462.175 51的分子离子峰,较乌药碱的分子量增加了176 Da,且与乌药碱有相同的特征碎片离子,推测两个化合物均为乌药碱的葡萄糖醛酸化产物。
木兰花碱为酸枣仁中的阿朴菲类异喹啉生物碱。如表1所示,正离子模式下,木兰花碱(4号化合物)产生m/z342.169 37的准分子离子峰,其脱掉(CH3)2NH中性分子生成m/z297.11的碎片离子。m/z297.11通过中性丢失CH3,生成碎片离子m/z282.06,或相继中性丢失CH3OH及CO分子生成碎片离子m/z265.09和m/z237.09。MA3产生m/z314.138 64的分子离子峰,比木兰花碱少了28 Da,且产生和木兰花碱相同的上述碎片离子,结合文献报道[20],初步推断MA3是木兰花碱去二甲基的产物。

表1 UHPLC/Q-Orbitrap-MS鉴定酸枣仁水提物灌胃的失眠大鼠血清中的原型成分及代谢产物Table 1 Prototype components and metabolites identified in serum of insomnia rats intragastricing administration of water extract of Ziziphi Spinosae Semen by UHPLC/Q-Orbitrap-MS
2.3.2 皂苷及其代谢产物酸枣仁皂苷类成分在负离子模式下响应较高,碎片丰富。负离子模式下,酸枣仁皂苷A(10号化合物)和酸枣仁皂苷B(11号化合物)的裂解规律(见表1)与文献报道一致[21]。失眠模型大鼠血清中未检测到酸枣仁皂苷的代谢产物酸枣仁皂苷元。研究表明,酸枣仁水提物体外经正常人体肠道菌群转化后的肠道菌液中未检测到酸枣仁皂苷元[21]。推测酸枣仁皂苷元可能通过粪便排泄,有待进一步的研究。此外,样品备样方法中,上清液上样于Oasis PRIME HLB 96孔μElution提取板时,75%的甲醇过滤液可能导致极性较弱代谢物的吸附,造成滤液不含或较少含有这些成分,而使酸枣仁皂苷元未被仪器检测到。
2.3.3 黄酮及其代谢产物斯皮诺素(7号化合物)和6‴-阿魏酰斯皮诺素(9号化合物)是以芫花素为母核的6位黄酮碳糖苷类。如表1所示,负离子模式下,斯皮诺素与6‴-阿魏酰斯皮诺素均通过中性丢失C4H8O4、C3H6O3和C2H4O2产生相同的碎片离子。负离子模式下,MF2和MF5均产生m/z283.06的碎片,同时分子离子峰分别比碎片283.06大176 Da和80 Da,因此推测其为芫花素肝肠循环代谢产生的芫花素葡萄糖醛酸化和硫酸酯化的产物。斯皮诺素和6‴-阿魏酰斯皮诺素在肠道发生水解反应生成当药黄素和斯皮诺素,进一步发生裂解反应生成芫花素。负离子模式下,MF6产生分子离子峰253.050 32,结合文献报道[22],推测其为芫花素去甲氧基的产物。
正离子模式下,维采宁Ⅱ(3号化合物)产生m/z595.165 22的分子离子峰,随后裂解产生m/z559.14[M-2H2O]-和457.11[M-H2O-C4H8O4]-的碎片离子,m/z457.11依次丢失中性分子CH2O、H2O分别生成m/z427.10、409.09等一系列典型的黄酮C糖30、60、90、120中性丢失的产物碎片。
异牡荆素(8号化合物)是以芹菜素为母核的6位黄酮碳糖苷类。负离子模式下,其产生m/z431.098 18的分子离子峰,并产生C糖的相同碎片。参考文献[23],推断5号峰为异牡荆素-2″-O-β-D-葡萄糖苷。负离子模式下,MF1和MF4分别产生m/z349.001 74和445.077 91的准分子离子峰,继而分别裂解脱掉80 Da和176 Da,产生碎片离子m/z269.05,因此推断MF1和MF4是芹菜素硫酸酯化和葡萄糖醛酸化的代谢产物。MF3的准分子离子峰为m/z364.999 85,较芹菜素增加了96 Da,且产生碎片离子m/z285.04[M-H-80 Da]-,推断为芹菜素羟基化和硫酸酯化的代谢产物。
综上,与课题组前期研究结果相比[13],正常与失眠模型大鼠血清中均检测到原型成分乌药碱、维采宁Ⅱ、异牡荆素-2″-O-β-D-葡萄糖苷、斯皮诺素、6‴-阿魏酰斯皮诺素、酸枣仁皂苷A和酸枣仁皂苷B。然而,与正常大鼠相比,乌药碱、斯皮诺素、6‴-阿魏酰斯皮诺素、酸枣仁皂苷A和酸枣仁皂苷B的血药浓度在失眠病理状态下发生了明显改变[15]。
由表1可知,与失眠模型大鼠相比,正常大鼠血清中检测到更多的原型成分,如酸李碱、当药黄素、青天葵黄酮J、酸枣仁皂苷H、酸枣仁皂苷G和美洲茶酸。与正常大鼠相比,失眠模型大鼠血清中鉴定到的丰富的代谢产物,多为水解、硫酸化或葡萄糖醛酸化代谢产物。其原因可能为:①睡眠障碍与功能性消化不良、肠易激综合征等肠道疾病有关[24-25]。失眠症患者肠道菌群的数量、组成和多样性发生了变化[26-27]。因此推断失眠引起的肠道消化吸收功能和肠道菌群的改变导致酸枣仁中原型成分的吸收差异,促进了黄酮、生物碱和皂苷的代谢;②大鼠腹腔注射的PCPA通过改变去甲肾上腺素能系统和5-HT能系统影响肝脏细胞色素P450表达[28],进而引起药物代谢的差异。由此可见,正常大鼠血清中原型成分的种类丰富且浓度发生了变化,而失眠模型大鼠血清中代谢产物的种类更为丰富。
3 结 论
本文基于UHPLC/Q-Orbitrap-MS结合化学计量学方法研究了酸枣仁水提物口服给予PCPA诱导失眠大鼠后的入血成分。通过对比模型组与模型给药组血清样品的色谱数据并结合PCA和OPLS-DA的化学计量学方法,共鉴定出20个入血成分,包括11个原型成分及9个代谢产物。该方法有别于传统的直观分析法,能够快速、准确地分析体内的入血成分。此研究结果可为明确酸枣仁的质量标志物提供科学依据。
