不同年份老香黄定量分析及其化学模式识别研究
2021-01-29郭舒臣郑玉忠曾鑫海梁惠芬陈奕东杨应楷董婷霞王怀友詹华强
郭舒臣,郑玉忠,郭 瑞,曾鑫海,梁惠芬,陈奕东,杨应楷, 董婷霞,2,王怀友,詹华强,2*
(1.深圳市可食用及药用资源研究重点实验室 香港科技大学深圳研究院,广东 深圳 518057;2.香港科技大学 生命科学部暨中药研发中心,香港 999077;3.中国药科大学 中药学院,江苏 南京 211198;4.韩山师范学院 食品工程与生物科技学院,广东 潮州 521041;5.广东济公保健食品有限公司,广东 潮安 515638)
老香黄(也称老香橼、佛手香黄)是岭南特有的保健和药用制品,具有增进食欲、理气化痰的功效,可治胃痛、腹胀、呕吐、嗝噎、痰多咳喘等病症[1]。它是由芸香科植物佛手(CitrusmedicaL.var.sarcodactylisSwingle)的果实炮制而成。佛手是我国传统的“药食两用”中药之一[2],但本身味道苦涩辛辣,不宜直接食用,故岭南地区的潮汕乡民以佛手(也称香橼)为原料,经过盐腌、晒干、炊熟、浸中药份液、九蒸九晒,腌制成色黑如漆、口感绵软的老香黄,同时可以久藏不坏,又可以保存药效[3]。佛手的主要化学成分有挥发油类、黄酮类、香豆素类、多糖、氨基酸和无机盐等多种生理活性物质[4],在抗氧化、抗炎[5]、调节免疫、抗肿瘤、降糖、降脂、改善胰岛素抵抗方面发挥着重要的作用[6]。但是目前老香黄多以作坊制作为主,在腌制过程中,工序较为复杂,且无标准的制备方法,导致老香黄成品在化学成分、组成及含量上差异很大,直接影响了老香黄的质量。市场上不同贮藏年份的老香黄,具有功能和品质上的差异[7]。迄今为止,老香黄缺少有效可靠的质量控制及其品质鉴定方法,而建立老香黄的质量评价体系,找到差异性化学标志物去判别不同年份的老香黄成为难点。
目前针对老香黄的成分分析,仅有运用高效液相色谱(HPLC)对2个指标成分进行定量分析的报道[8]。随着液相色谱-质联用技术的高速发展,超高效液相色谱-串联质谱法(UPLC-MS/MS)因具有快速、分离度好、灵敏度高的特点,被广泛应用于多种物质的同时测定[9-10]。本研究以原料佛手中的化学成分为基准,通过文献筛选了21个具有代表性的化学质量标志物[11-12],采用UPLC-MS/MS方法对老香黄中的化学标志物进行快速定性与定量分析。
为了有效快速筛选中药化学标志物,常常采用化学模式识别技术,该技术在中药鉴别、定性表征、质量控制、组效关系等研究中均有广泛应用[13],包括主成分分析(Principal component analysis,PCA)、聚类分析(Hierarchical cluster analysis,HCA)、正交偏最小二乘法判别分析(Orthogonal partial least squares discriminant analysis,OPLS-DA)的分析方法[14]。本研究基于老香黄中各化学标志物的含量结合上述模式识别方法区别不同年份的老香黄,筛选出差异性化学标志物,并进一步采用盲样适用性能力测试结果。
1 实验部分
1.1 仪器与试剂
VGT-2227QTD型数码超声波清洗机(广东固特超声股份有限公司);BSA2245型电子天平(万分之一,德国赛多利斯公司);Milli-QB型超纯水净化系统(美国Millipore公司);A-30型超高效液相色谱-Q-sight型三重四极杆质谱仪(珀金埃尔默仪器有限公司);SAB 225i型电子天平(十万分之一,英国ADAM衡器公司);GL-16G-II 离心机(上海安亭科学仪器厂)。
从广东济公保健食品有限公司收集不同年份(7个年份)的老香黄,包括0年(即老香黄半成品,LXH0_1~6)、3年(储藏3年的老香黄,LXH3_1~6)、5年(LXH5_1~6)、8年(LXH8_1~6)、10年(LXH10_1~6)、15年(LXH15_1~6)、20年(LXH20_1~6),每个样品各6批;同时收集不同厂家、不同年份测定用盲样(Proficiency test,PT)共9批,编号PT_1~PT_9,所有样品均保存于香港科技大学深圳研究院。21种对照品均由四川省维克奇生物科技有限公司提供,其纯度均超过98%,具体的对照品信息见表1。

表1 21种对照品的采购信息Table 1 Commercial informations of 21 kinds of reference substances
1.2 溶液的制备
1.2.1 对照品溶液及其内标溶液的制备分别精密称定21种候选化学标志物适量,置于10 mL容量瓶中,用甲醇稀释至刻度。摇匀,制成质量浓度为1 mg/mL的对照品单标溶液,各取适量溶液,混合成23.80 μg/mL的混合对照品储备液。另取10 mg山柰酚-3-O-芸香糖苷置于容量瓶中,用甲醇稀释至刻度,配制成1 mg/mL的储备液,最终稀释成5 μg/mL的内标溶液。
1.2.2 标准曲线的制备将对照品混标溶液用甲醇稀释成质量浓度分别为0.05、0.09、0.18、0.37、0.74、1.47、2.95、5.95、11.90、23.80 μg/mL的系列标准溶液。
1.2.3 老香黄供试品溶液的制备准确称取不同年份各6批老香黄样品1.00 g,剪碎,置于50 mL具塞锥形瓶中,精密吸取20 mL超纯水,称定重量,浸泡24 h过夜,80 ℃超声 2 h(500 W,40 kHz),放冷,用超纯水补足减失的重量,过滤并收集续滤液;所剩残渣按同样方法再提取1次,合并滤液,12 000 r/min高速离心,4 ℃保存,待分析。
1.3 样品的分析条件
1.3.1 色谱条件色谱柱:Waters ACQUITY UPLC BEH C18(2.1 mm×50 mm,1.7 μm);柱温:30 ℃;流动相:0.1%甲酸水溶液(A)-乙腈(B);梯度洗脱程序:0~2 min,95%~85% A;2~6 min,85% A;6~10 min,85%~47% A;10~12 min,47%~5% A;12~14 min,5%~95% A;14~17 min,95% A;流速:0.3 mL/min;进样量:1 μL。
1.3.2 质谱条件离子源检测模式:ESI+-多反应监测模式(MRM);毛细管电压(Electrospray voltage):5 500 V;干燥气流速:100 L/min;质谱接口温度(HSID temp):280 ℃;雾化气流速:120 L/min;离子源温度(Source temp):450 ℃;待测成分的MRM质谱分析参数见表2。
2 结果与讨论
2.1 化学标志物的选择
参考佛手中化学成分研究的相关文献[8-10],筛选出报道较多或含量较高的21个化合物作为候选化学标志物,其中包括异莨菪亭、东莨菪内酯、6,7-二甲氧基香豆素、5,7-二甲氧基香豆素、水合氧化前胡素、柠檬苦素、诺米林、佛手柑内酯、香叶木素、金圣草素、圣草次苷、7-甲氧基香豆素、野漆树苷、芦丁、橙皮苷、新橙皮苷、甲基橙皮苷、香叶木苷、黄柏酮、7-羟基香豆素、山柰酚。

表2 待测化学标志物的质谱分析参数Table 2 MS parameters of chemical markers for test
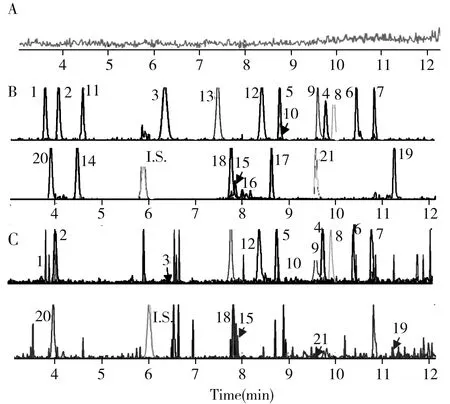
图1 各化学标志物的MRM叠加色谱图Fig.1 MRM overlay chromatograms of chemical markers the peak numbers denoted were the same as those inTable 1; A:blank methanol;B:mix standard(23.80 μg/mL); C:Lao-Xiang-Huang(LXH0_1)
2.2 方法学
2.2.1 成分检定及其专属性精密吸取 “1.2.1”混合对照品溶液(23.80 μg/mL)、供试品溶液(LXH0_1)100 μL,加入100 μL内标,混匀,另取空白甲醇200 μL,按“1.3”条件进行分析,各化学标志物的MRM色谱图见图1。混合的21个化合物峰及其内标峰均得到很好的分离,且无杂峰干扰、峰形良好、基线平稳。在供试品溶液中除内标外,共检出15个化学标志物,并作为有关样品质量的方法学考察指标。
2.2.2 线性关系、定量下限及检出限精密吸取“1.2.2”制备的系列标准溶液各100 μL,加入100 μL内标,混匀,按“1.3”条件进行分析,以对照品系列工作液的质量浓度为横坐标(x),对照品和内标峰面积的比值为纵坐标(y),得到21个化学标志物的标准曲线(见表3)。结果表明,该方法在0.09~23.80 μg/mL范围内线性关系良好,相关系数均大于0.990。以信噪比(S/N)约为10计算各成分的定量下限(LOQ),以S/N≈3计算各成分的检出限(LOD),测得21种化学标志物的定量下限为0.05~0.09 ng,检出限为0.02~0.05 ng(见表3)。
2.2.3 精密度、重复性与稳定性实验精密吸取“1.2.1”混合对照品溶液(23.80 μg/mL),加入内标100 μL,按照“1.3”条件进行分析,连续进样6次,测定各对照品和内标峰面积的比值,计算得21种待测化学标志物的相对标准偏差(RSD)为0.56%~2.1%(见表4),说明仪器的精密度良好。精密称取老香黄0年(LXH0_1)样品6份,每份1.00 g,分别按照“1.2.3”制备供试液,加入100 μL内标,混匀,进样测定,计算得到15种化学标志物含量的RSD为0.31%~2.4%(见表4),表明该方法的重复性良好。取同一老香黄供试品溶液(LXH0_1),加入100 μL内标,混匀,分别在0、2、4、8、12、24 h进样分析,测定15种目标峰面积和内标峰面积的比值RSD为1.1%~2.1%(见表4),表明供试品溶液在24 h中具有良好的稳定性。

表3 21种化学标志物的线性关系、检出限及定量下限Table 3 Linear relations,LODs and LOQs of 21 chemical markers for test
2.2.4 加标回收率实验精密称取已知含量的老香黄0年(LXH0_1)样品0.50 g各6份,分别加入近似等量的样品中可测到的15种对照品,按“1.2.3”制备加标回收供试品溶液,加入100 μL内标,混匀,按照“1.3”条件进行测定,计算回收率及RSD(表4)。15种化学标志物的回收率为92.3%~104%,RSD为0.49%~2.5%。结果表明该方法的准确度和精密度良好,可以满足日常样品的分析要求。
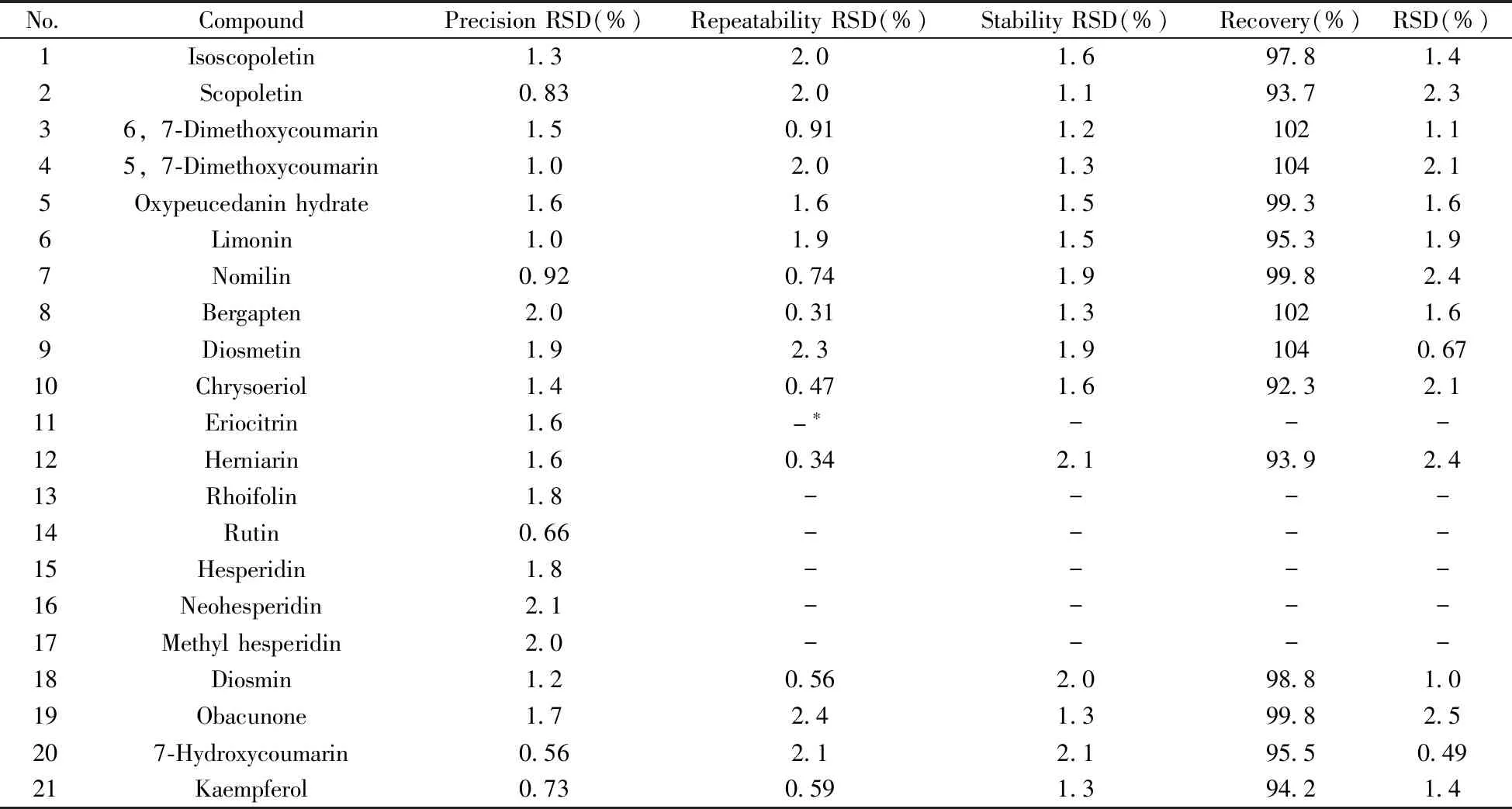
表4 方法的精密度、重复性、稳定性及回收率Table 4 Precision,repeatability,stability and recovery for the method
2.3 不同年份老香黄样品含量测定
取“1.2.3”供试品溶液100 μL,加入内标100 μL混匀,按照“1.3”条件进行分析,以相应的线性关系分析不同年份老香黄样品的15种化学标志物含量(见表5)。结果表明最初加工好的老香黄(LXH0)各标志物含量较高,其中5,7-二甲氧基香豆素、柠檬苦素、诺米林、7-羟基香豆素含量较高,分别为(47.465±1.987)μg/g、(168.562±17.851)μg/g、(216.731±26.217)μg/g和(243.242±31.430)μg/g。实验证实,这些化学标志物含量较高,但随着老黄香腌制时间的增加,复杂的炮制过程造成了化学标志物的流失,含量不同程度降低,可能是各化学标志物在炮制过程中转变为其他二级代谢产物,也可能是经过多道工艺的炮制,特别是盐浸和蒸煮等步骤后导致各标志物严重流失[8]。此外,对于未检出的圣草次苷、野漆树苷、芦丁、橙皮苷、新橙皮苷、甲基橙皮苷6种物质在佛手原料中均有报道,但对比同年期的老香黄成品中未有发现,可能是加工过程中流失至含量低于检出限。
此外,5,7-二甲氧基香豆素是佛手中的主要成分,其含量在佛手果实不同成熟阶段变化很大,因此在样品个体中含量也有较大的差异。表5和表6中,5,7-二甲氧基香豆素的不规律变化应与样品代表性有关。但整体而言,随着储藏时间的增加,与其他成分一致,5,7-二甲氧基香豆素含量呈现逐渐下降的趋势。

表5 不同年份老黄香中15种化学标志物的含量(μg/g,n=6)Table 5 Contents of 15 chemical markers in Lao-Xiang-Huang under different preserved years(μg/g,n=6)
2.4 基于化学标志物的PCA降维分析
主成分分析(PCA)是一种降维思维或将多个指标转化为n个指标的数据处理方法,克服了单一指标的局限性,可筛选出不同组间的显著差异性化学标志物[15]。本研究采用SIMCA14.1软件对不同年份的老香黄中15种化学标志物的含量(C1~C15,编号见表5)进行PCA分析和无监督模式下的聚类分析(HCA),HCA分析采用最短最长平均距离(Single linkage),结果表明前两个主成分的累积贡献率达79.1%,且特征值均大于1,满足主成分的选取要求,可以揭示样品中的大多数差异信息。进一步根据前两个主成分进行PCA得分图、化合物载荷图以及层次聚类分析图的制作(见图2)。PCA结果表明,老香黄0年和20年有明显的区分,其他5个年份并未得到很好的区分(图2A);载荷图显示各成分未获得良好的得分(值大于0.30,表示载荷显著[15])(图2B)。无监督模式下的HCA分析同样显示,除了老香黄0年和20年有很好的聚类,其他年份样品无法很好的聚类在一起(图2C)。为了进一步研究模式识别技术能否将不同年份的老香黄完全区分,后续实验进一步采用OPLS-DA法进行分析。
2.5 基于OPLS-DA分析的差异性化学标志物筛选
正交偏最小二乘判别分析(OPLS-DA)结合了正交信号校正(OSC)和PLS-DA方法,能够将X矩阵信息分解成与Y相关和不相关的两类信息,通过去除与分类信息无关的噪音,提高模型的有效性来筛选差异变量[16]。本研究将7个不同年份的老香黄分为7组,分组同“1.1”一致。通过OPLS-DA分析结果可知,各组均有良好的区分(图3A),且R2X(cum)=0.943,R2Y(cum)=1,Q2(cum)= 0.855,表明模型的解释度和预测度好。

图2 不同年份老香黄的PCA分析结果Fig.2 PCA analysis results of Lao-Xiang-Huang under different preserved years A:PCA plot;B:loading plot;C:HCA dendrogram

图3 不同年份老香黄的OPLS-DA分析结果Fig.3 OPLS-DA analysis results of Lao-Xiang-Huang under different preserved years A:OPLS-DA plot;B:VIP value of detected chemical markers;C:dendrogram of HCA clustering
通过提取OPLS-DA模型中15个变量的重要值(Variable importance in projection,VIP)(图3B),对15个化学标志物含量VIP值大小进行排序,筛选出VIP值大于1的差异化学标志物。结果显示,化学标志物C4(5,7-二甲氧基香豆素)、C12(香叶木苷)、C15(山柰酚)、C13(黄柏酮)、C10(金圣草素)、C6(柠檬苦素)的VIP值均大于1,说明以上6种化学成分对7个贮藏年份的老香黄的分类有显著影响,这些成分是引起变化的主要差异性化学标志物。而其他化学成分的VIP值均小于1,表明对不同年份的老香黄的差异性影响不大。
在OPLS-DA有监督的判别模式条件下,对不同年份的老香黄样品进行HCA聚类分析,参数为最短最长平均距离(Single linkage)。结果显示,不同年份的样品聚类位置不同,且大多数同一年份样品聚为一类,可区分不同年份的老香黄(图3C)。虽然老香黄8年样品有部分差异,但不影响整体的年份聚类,表明在此模式下,不同贮藏年份的老香黄在品质上存在一定差异。
综合分析表5含量结果和筛选的差异标志物,贡献最大的差异化学标志物5,7-二甲氧基香豆素,0年含量为(47.465±1.987)μg/g,3年含量为(17.069±0.542)μg/g,5年含量为(11.073±1.862)μg/g,8年含量为(41.905±2.240)μg/g,10年含量为(21.079±2.270)μg/g,15年含量为(43.267±2.432)μg/g,20年含量为(51.711±1.439)μg/g。该标志物的含量在一定程度上可以体现不同年份的老香黄,进而通过盲样的适用性测试结果进行验证。
2.6 盲样的适用性测试结果验证
在市场上,收集不同厂家不同年份9批样品进行盲样的适用性能力检测(Proficiency test,PT),样品按“1.2.3”进行供试品溶液的制备,取100 μL,加入内标100 μL混匀,按照“1.3”条件进行分析,按照相应的线性关系分析样品中6种差异性化学标志物的含量,结果见表6。通过比对表6和表5中5,7-二甲氧基香豆素含量,判断盲样中各批次的年份,验证所建方法的可靠性。检测表明PT_1~PT_3检测数值落在老香黄3年(LXH3),PT_4~PT_6落在老香黄5年(LXH5),PT_7~PT_9落在老香黄8年(LXH8),分析结果与厂家报告基本一致。进一步分析,盲样中各年份的其他5种成分(香叶木苷、山柰酚、黄柏酮、金圣草素、柠檬苦素)含量在表5各年份老香黄测定的范围之内,表明所建立的方法可靠,有较高的应用价值。
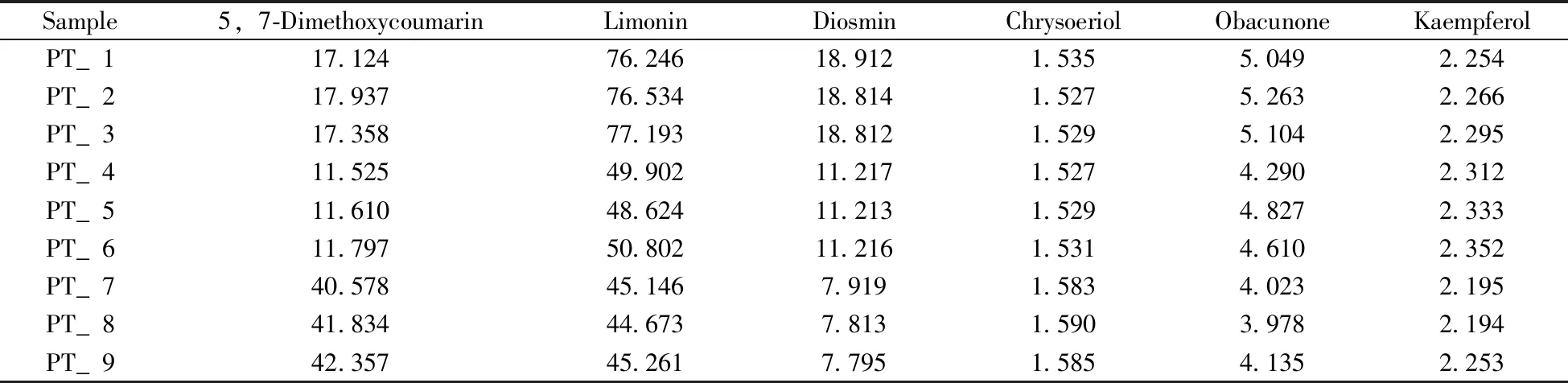
表6 市场上老香黄盲样适用性测试结果(μg/g,n=3)Table 6 Proficiency test in commercially available of Lao-Xiang-Huang samples(μg/g,n=3)
3 结 论
本研究提供了21种与老香黄相关的化学标志物及其内标山柰酚-3-O-芸香糖苷的UPLC-MS/MS检测方法。在该条件下,各化学标志物的提取峰与内标峰无杂峰干扰,峰形良好,基线平稳,且该方法的线性良好,灵敏度高,专属性强,方法学考察结果符合日常分析要求。研究发现:在佛手原料中均有报道的圣草次苷、野漆树苷、芦丁、橙皮苷、新橙皮苷、甲基橙皮苷6种成分未在不同年份的老香黄中检出,可能是在加工过程中流失至低于检出限。进一步结合PCA、HCA、OPLS-DA化学模式识别技术,可以有效判别不同年份的老香黄,找出区分老香黄年份的6种差异化学标志物,其中贡献最大的差异化学标志物为5,7-二甲氧基香豆素,通过该标志物的含量在一定程度上可以判断老香黄的年份。为了验证方法的普适性,经过市场上老香黄盲样适用性测试分析表明,5,7-二甲氧基香豆素含量的检测值对应的老香黄年份与厂家报告基本一致。该研究一方面可通过对多种差异性成分的分析有效地控制老香黄的质量,另一方面可以通过指标性成分含量判断老香黄的大概年份。
