miR-33b靶向Myc对T细胞活化的调控及其在扩张型心肌病中的作用①
2021-01-27史慧颖王淑男霍艳萍刘灿君那静涛
黄 侃 史慧颖 王淑男 霍艳萍 刘灿君 那静涛
(齐齐哈尔医学院附属第三医院心血管二科,齐齐哈尔 161000)
扩张型心肌病(dilated cardiomyopathy,DCM)属于原发性心肌病,其主要特征为心脏收缩功能障碍及左心室扩张,其具有较高的发病率并可导致患者心力衰竭[1]。目前DCM发病机制尚未完全阐明,既往研究认为免疫紊乱、自身免疫心肌炎及炎症损伤等均可导致DCM发生[2]。故而深入探究DCM患者免疫紊乱机制对寻找DCM治疗靶点具有重要意义。CD4+T细胞属于免疫系统重要细胞亚群,研究发现DCM患者心脏组织均发生CD4+T细胞浸润,CD4+T细胞可促使炎症介质释放并引起心肌细胞凋亡进而导致心功能恶化[3]。同时相关报道指出DCM患者外周血中表面活化标记物CD25和CD69表达增加并可促进心衰发生[4]。以上研究表明DCM患者体内存在细胞免疫紊乱并可能促进心功能恶化。
微小RNA(microRNA,miRNA)是一类内源性单链小RNA并可通过调控靶基因表达进而调节基因转录后表达,研究显示miRNA可调控T淋巴细胞发育及分化等过程[5]。研究表明 T细胞活化后微小RNA-33b(miR-33b)表达水平明显降低并可调控机体免疫系统[6]。CD4+T细胞异常活化可引发DCM患者炎症损伤,miR-33b又可调节T细胞活化,但miR-33b与CD4+T细胞在DCM发病机制中的作用关系尚未研究。通过生物信息学软件预测Myc是miR-33b的靶基因,Myc作为多效能转录因子又可被T细胞中细胞因子激活进而参与细胞增殖及分化过程[7]。因此,本研究通过分析miR-33b对T细胞活化的调控作用及其在DCM发生过程中的作用,初步探讨其是否通过靶向调控Myc表达来发挥作用,为进一步揭示DCM患者免疫活化机制提供新思路。
1 材料与方法
1.1材料
1.1.1DCM患者一般资料 收集2015年3月至2016年4月本院收治的45例DCM患者为研究对象,作为DCM组,所有患者均符合WHO原发性扩张性心肌病诊断标准[8]。DCM组患者中男25例,女20例,年龄45~67岁,平均年龄为(52.31±5.52)岁。同时选取同期本院体检中心健康志愿者30例为正常组,其中男18例,女12例,年龄42~70岁,平均年龄为(53.62±6.17)岁。两组受试者年龄、性别等比较差异无统计学意义(P>0.05),具有可比性。纳入标准:DCM患者左心室舒张期末直径高于5.5 cm且右心室射血分数低于45%;未接受类固醇激素等治疗者。排除标准:血性心肌病患者;合并高血压性心脏病及心脏瓣膜病患者;自身免疫性疾病或严重感染者;合并严重内分泌疾病患者。本研究经本院伦理委员会批准,受试者知情且签署同意书。
1.1.2实验材料 人T淋巴细胞白血病细胞Jurkat T购自武汉华连科生物技术有限公司。RPMI1640培养基、胰酶购自杭州仟诺生科技有限公司;双荧光报告检测系统购自美国Promega 公司;双荧光报告检测试剂盒购自北京白奥莱博科技有限公司;胎牛血清购自美国Gibco公司;anti-CD3、anti-CD28、anti-CD4-FITC抗体、anti-CD25-PE抗体、anti-CD69-PE-Cy7抗体购自美国Biolegend公司;白细胞介素-2(IL-2)酶联免疫吸附(ELISA)试剂盒购自美国BD Bio-sciences公司;MTT检测试剂盒购自武汉艾美捷科技有限公司;Lipofectamine2000转染试剂购自美国Invitrogen公司;miR-33b mimic、miR-33b抑制剂(anti-miRNA)及其阴性对照购自上海吉玛基因制药技术有限公司;Myc siRNA及其阴性对照质粒购自广州锐博生物科技有限公司;Trizol试剂与SYBR Green qPCR试剂盒购自日本TaKaRa公司;M-MLV Reverse Transcription Kit试剂盒购自美国Invitrogen公司;兔抗人Myc多克隆抗体、兔抗GAPDH多克隆抗体购自美国Abcam公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG购自中山金桥生物技术有限公司;Western blot所需试剂购自上海西宝生物科技股份有限公司;淋巴细胞分离液购自美国MP Biomedicals公司;红细胞裂解液购自美国eBioscience公司。
1.2方法
1.2.1分离人外周血单个核细胞(PBMCs) 采用肝素钠抗凝试管收集两者受试者外周静脉血5 ml,2 500 r/min离心8 min,收集上层血浆,加入等体积无菌PBS缓冲液,另取10 ml无菌离心管,加入等体积淋巴细胞分离液,缓慢加入外周血,离心机中2 500 r/min离心20 min,取出中间PBMCs层,加入4 ml PBS缓冲液,混匀,1 600 r/min离心6 min,弃上清并收集细胞,加入红细胞裂解液(2 ml),混匀,室温静置2 min,加入PBS缓冲液至8 ml,混匀后离心并收集细胞,采用RPMI1640培养基重悬细胞,调整细胞浓度2×106ml-1,采用免疫磁珠分选法(MACS)分离CD4+T细胞,具体方法参照相关文献[9],收集CD4+T细胞置于4℃冰箱内保存备用。
1.2.2细胞培养及转染 用含有10%胎牛血清、青霉素及链霉素的RPMI1640培养基培养Jurkat T细胞,置于37℃、5%CO2培养箱内培养,2 d更换培养液,待细胞融合至60%~70%时进行传代培养。参照Lipofectamine2000转染试剂说明进行转染,转染前一天将Jurkat T细胞接种至96孔细胞培养板,每孔分别接种2×105个细胞,同时分别将miRNA阴性对照、miR-33b mimic、anti-miRNA及miR-33b抑制剂溶解于OPYI-MEM培养基(50 μl),混匀后加入2 μl Lipofectamine2000转染试剂,混匀后室温孵育20 min,向96孔板中每孔加入100 μl上述miRNA配置混合液,分别为miR-con组、miR-33b组、anti-miR-con组 及anti-miR-33b组。采用小RNA干扰技术沉默Myc表达,分别将Myc siRNA及其阴性对照质粒转染至Jurkat T细胞,转染方法与miR-33b转染方法相同,分别为si-con组、si-Myc组。转染后置于恒温培养箱培养,6 h后更换为RPMI1640完全培养基,继续培养48 h后收集细胞进行检测。
1.2.3qRT-PCR检测miR-33b 、Myc mRNA表达 CD4+细胞与Jurkat T细胞均按照Trizol试剂说明书提取总RNA,利用核酸蛋白分析仪检测RNA浓度及纯度,以A260与A280比值在1.8~2.0之间为RNA浓度测定标准。引物序列:miR-33b正向引物为:5′-ATTCTTTCGAACTGTCTTGG-3′,反向引物为:5′-TTCACCCTCGGCTGTCCTTGACA-3′;Myc正向引物为:5′-AATGAAAAGGCCCCCAAGGTAGTTATCC-3′,反向引物为:5′-GTCGTTTCCGCAACAAGTCCTCTTC-3′。逆转录合成cDNA,qRT-PCR扩增反应,扩增条件为95℃ 5 min,95℃ 30 s,58℃ 30 s,72℃ 30 s,共30次循环,72℃终延伸10 min。qRT-PCR反应均严格按照SYBR Green qPCR试剂盒说明书操作。miR-33b 、Myc 的溶解曲线见图1。
图1 miR-33b与Myc的溶解曲线Fig.1 Dissolution curve of miR-33b and Myc
1.2.4Western blot检测Myc蛋白表达 取各组Jurkat T细胞及CD4+细胞,加入蛋白裂解液提取细胞总蛋白,经电泳分离蛋白,转膜,脱脂奶粉封闭60 min,分别加入Myc(1∶200)、GAPDH(1∶1 000)一抗,4℃冰箱内保存过夜,次日加入IgG(1∶5 000),室温孵育1 h,经化学发光试剂显影,Myc以GAPDH为内参,应用凝胶成像系统分析蛋白条带灰度值。
1.2.5流式细胞术检测表面活化标记物CD25和CD69的表达 收集各组对数生长期Jurkat T细胞,用anti-CD3/28刺激Jurkat T细胞24 h,用anti-CD4-FITC、anti-CD25-PE、anti-CD69-PE-Cy7抗体标记后,置于流式细胞仪检测,采用FlowJo7.6软件分析CD25和CD69平均荧光强度(MFI)。
1.2.6MTT检测细胞增殖 取各组对数生长期Jurkat T细胞,0.25%胰酶消化,接种至96孔板,每孔细胞密度为5×103个,每孔体积为100 μl,每组设置4个复孔,放入恒温培养箱培养,24 h、48 h、72 h后分别在每孔加入50 μl MTT试剂,然后加入150 μl DMSO,避光室温下孵育10 min,利用酶标仪检测各孔在490 nm波长处的OD值。
1.2.7检测T细胞活化功能 分别将Jurkat T细胞铺于96孔U底板(2×105个/孔),用anti-CD3/28抗体刺激,24 h后收集细胞上清液,采用ELISA法检测IL-2水平,严格按照检测试剂盒说明书操作。
1.2.8双荧光素酶活性检测 收集呈指数式生长的Jurkat T细胞,胰蛋白酶消化,制备细胞悬液,以每孔1×105个细胞接种于24孔细胞培养板,放入恒温培养箱培养,待细胞融合度达到60%左右时进行转染,分别将WT-Myc、MUT-Myc与miR-con共转染至Jurkat T细胞,分别将WT-Myc、MUT-Myc与miR-33b mimic共转染至Jurkat T细胞,转染48 h后弃培养基,然后在每孔加入300 μl 1×Passive Lysis Buffer,放入4℃冰箱内,20 min后取出并混匀,吸取40 μl细胞裂解液置于Lockwell maxisorp检测板,再加入Luciferase Assay Reagent(20 μl),混匀后检测萤火虫荧光素酶荧光值,之后加入Stop & Glo Reagent(20 μl/孔),混匀后室温放置3 min,检测海肾荧光酶荧光值。

2 结果
2.1扩张型心肌病患者CD4+细胞中miR-33b和Myc的表达 通过qRT-PCR法检测DCM患者CD4+细胞中miR-33b及Myc mRNA表达水平,结果显示DCM组患者CD4+细胞中miR-33b表达水平相较于正常组显著降低(t=10.528,P<0.000 1),Myc mRNA表达水平显著升高(t=11.238,P<0.000 1),见图2A、B。Western blot检测结果显示DCM组患者CD4+细胞中Myc蛋白表达水平显著高于正常组(t=8.718,P<0.000 1),见图2C。采用Pearson法分析DCM患者CD4+细胞中miR-33b与Myc蛋白表达水平的相关性,结果显示miR-33b与Myc呈负相关(F=14.091,P<0.05),见图2D。
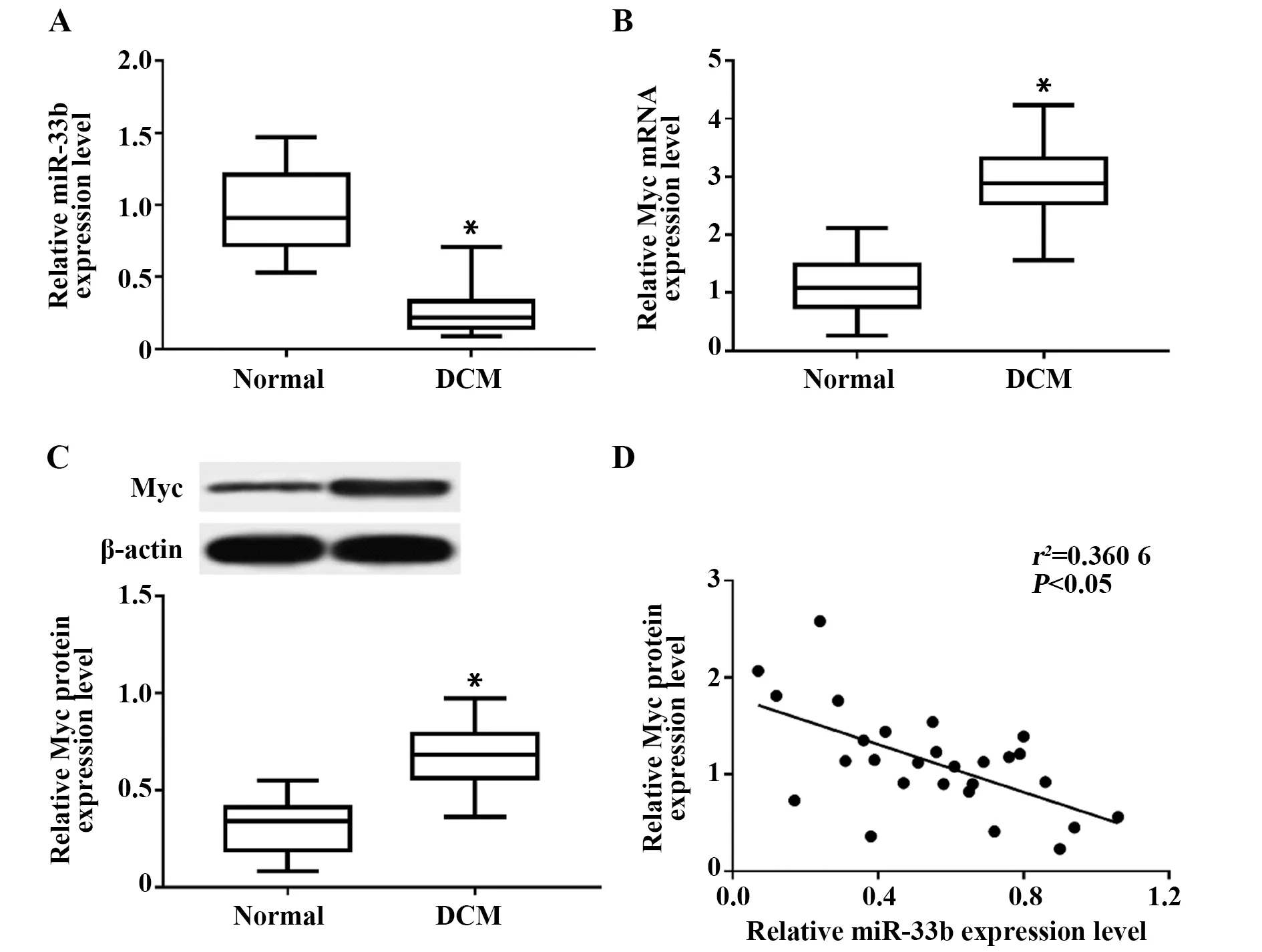
图2 DCM患者CD4+细胞中miR-33b和Myc的表达Fig.2 Expression of miR-33b and Myc in CD4+ cells from DCM patientsNote:A.Down-regulation of miR-33b expression in circulating CD4+ cells in DCM patients compared with normal group;B.Upregulation of Myc mRNA expression in circulating CD4+ cells in DCM patients compared with normal group;C.Upregulation of Myc protein expression in circulating CD4+ cells in DCM patients compared with normal group;D.Negative correlation between Myc protein expression in circulating CD4+ cells in DCM patients.Compared with Normal group,*.P<0.05.
2.2miR-33b对Jurkat T细胞活化的影响 分别将miR-33b mimic、miR-33b抑制剂(anti-miRNA)转染至Jurkat T细胞,转染48 h后采用qRT-PCR法检测Jurkat T细胞中miR-33b表达,结果显示miR-33b组Jurkat T细胞中miR-33b表达水平显著高于miR-con组,anti-miR-33b组Jurkat T细胞中miR-33b表达水平显著低于anti-miR-con组(F=219.514,P<0.000 1),见图3A。提示转染效果良好可用于后续研究。用anti-CD3/28刺激Jurkat T细胞24 h,流式检测表面活化标记物CD25和CD69的表达,结果显示miR-33b组Jurkat T细胞中CD25、CD69 MFI值及IL-2水平均显著低于miR-con组,anti-miR-33b组Jurkat T细胞中CD25、CD69 MFI值及IL-2水平均显著高于anti-miR-con组(FCD25=32.532,FCD69=75.971,FIL-2=38.084,P<0.000 1),见图3B~D。结果表明miR-33b过表达可抑制Jurkat T细胞活化,抑制miR-33b表达可促进Jurkat T细胞活化。

图3 miR-33b调控Jurkat T细胞活化Fig.3 miR-33b regulates Jurkat T cell activationNote:A.Detection of miR-33b expression in Jurkat T cells 48 h after transfection;B,C.After 48 h transfection,Jurkat T cells were stimulated with anti-CD3/28 for 24 h,and the expression of surface activation markers CD25 and CD69 were detected by flow cytometry;D.ELISA for detection of IL-2 concentration in cell supernatant.Compared with miR-con group,*.P<0.05;compared with anti-miR-con group,#.P<0.05.
2.3miR-33b对Jurkat T细胞增殖的影响 MTT检测Jurkat T细胞增殖能力,结果显示miR-33b 组Jurkat T细胞增殖活性显著低于miR-con组,anti-miR-33b组Jurkat T细胞增殖活性显著高于anti-miR-con组(F=23.044,P<0.000 1),见图4。结果表明miR-33b过表达可抑制Jurkat T细胞增殖,抑制miR-33b表达可促进Jurkat T细胞增殖。

图4 miR-33b调控Jurkat T细胞增殖Fig.4 miR-33b regulates Jurkat T cell proliferationNote:Compared with miR-con group,*.P<0.05;compared with anti-miR-con group,#.P<0.05.
2.4miR-33b靶向Myc调控其表达 靶基因预测软件预测出miR-33b与Myc 3′UTR存在结合位点,见图5A。分别将WT-Myc、MUT-Myc与miR-33b mimic共转染至Jurkat T细胞,分别将WT-Myc、MUT-Myc与miR-con组共转染至Jurkat T细胞,检测Jurkat T细胞荧光活性,结果显示野生型WT-Myc与miR-33b mimic共转染Jurkat T细胞荧光活性比WT-Myc与miR-con共转染Jurkat T细胞荧光活性显著降低(t=6.507,P=0.03),突变型MUT-Myc与miR-con共转染相较于MUT-Myc与miR-33b mimic共转染Jurkat T细胞荧光活性差异无统计学意义(t=1.905,P=0.130),见图5B。Western blot法验证miR-33b对Myc蛋白表达的调控作用,结果显示miR-33b组Jurkat T细胞中Myc蛋白表达水平显著降低(P<0.05),anti-miR-33b组Jurkat T细胞中Myc蛋白表达水平显著升高(P<0.05),见图5C。结果表明miR-33b可负向调控靶基因Myc表达。

图5 miR-33b靶向Myc mRNA调控其蛋白表达Fig.5 miR-33b targets Myc mRNA to regulate its protein expressionNote:Compared with miR-con group,*.P<0.05;compared with anti-miR-con group,#.P<0.05.
2.5沉默Myc抑制Jurkat T细胞活化和增殖 将Myc siRNA及其阴性对照质粒转染至Jurkat T细胞,转染48 h后采用Western blot验证转染效果,结果显示si-Myc组Jurkat T细胞中Myc蛋白表达水平显著低于si-con组(F=43.279,P<0.000 1),见图6A,提示转染成功。进一步分析沉默Myc表达对Jurkat T细胞活化和增殖的影响,结果显示si-Myc组Jurkat T细胞CD25、CD69 MFI值及IL-2水平均显著低于si-con组(FCD25=67.278,FCD69=30.855,FIL-2=208.496,P<0.05),Jurkat T细胞活性明显降低(F=13.838,P=0.006),见图6B~E。结果表明沉默Myc 表达可抑制Jurkat T细胞活化并降低细胞增殖能力。

图6 Myc表达对Jurkat T细胞活化和增殖的影响Fig.6 Effect of Myc expression on activation and proliferation of Jurkat T cellsNote:A.Detection of Myc expression in Jurkat T cells after 48 hours of transfection;B,C.Expression of surface activation markers CD25 and CD69;D.ELISA for detection of IL-2 concentration in cell supernatant;E.Detection of Jurkat T cell proliferation.Compared with si-con group,*.P<0.05.
3 讨论
CD4+T细胞介导免疫炎症反应可促进DCM发生及发展,DCM患者外周血CD4+T细胞异常活化可损伤机体免疫功能[10]。miRNA与T细胞激活及分化密切相关,T细胞激活可通过增加细胞代谢进而调节免疫功能,同时还可调控miRNA表达并间接调控靶基因表达进而促进T细胞增殖,miRNA异常表达还可通过调控靶基因表达进而促进T细胞增殖[11-13]。miR-33b在食管鳞状细胞癌中呈低表达并可参与肿瘤发生及发展过程,研究表明miR-33可通过调控ATP结合盒转运蛋白表达进而调节机体免疫反应[14,15]。关于miR-33b在DCM发生过程中的作用尚未有相关研究报道,本研究结果显示DCM患者CD4+T细胞中miR-33b表达水平低于正常组,说明miR-33b可能参与DCM发生过程。提示miR-33b表达水平异常可能通过引起机体免疫系统紊乱进而导致DCM发生。通过靶向预测软件得出Myc与miR-33b基因序列存在结合位点,研究显示抑制Myc表达可抑制T细胞活化及增殖,同时Myc表达水平升高还与白血病病毒感染有关[16,17]。本研究结果显示DCM患者CD4+T细胞中Myc mRNA及蛋白表达水平显著高于正常组,miR-33b与Myc呈负相关,提示miR-33b与Myc异常表达可促进DCM发生及发展。但Myc与miR-33b是否存在直接靶向关系及其对DCM患者T细胞活化及增殖的调控作用如何均需进行深入研究。
CD69可作为T淋巴细胞表面活化的早期标志,抗原刺激T淋巴细胞时CD69表达上调[18]。CD4+T细胞早期免疫活化标志物CD25、CD69表达增加可能是DCM患者免疫激活的重要因素[19]。研究发现IL-2是Myc转录后发挥调控作用中的重要因子,IL-2可诱导CD4+T细胞合成相关miRNA,miRNA又可通过靶向抑制Foxol因子表达进而促进CD4+T细胞增殖[20,21]。提示IL-2在CD4+T细胞活化及增殖过程中发挥重要作用。本研究选用T淋巴细胞系Jurkat T细胞为实验细胞,通过体外实验探讨miR-33b、Myc与T淋巴细胞活化及增殖的关系。本实验将miR-33b过表达及抑制表达后,结果显示miR-33b过表达后Jurkat T细胞中CD25、CD69 MFI值、IL-2水平及细胞增殖能力均显著降低,抑制miR-33b表达后Jurkat T细胞中CD25、CD69 MFI值、IL-2水平及细胞增殖能力均显著升高,说明miR-33b表达水平升高可有效抑制Jurkat T细胞活化及增殖。提示Jurkat T细胞中miR-33b表达水平降低可促进免疫活化及增殖。同时本研究荧光素酶检测结果显示Myc是miR-33b的靶基因,miR-33b可负向调控靶基因Myc表达。提示miR-33b、Myc表达异常可能与DCM过度免疫激活有关。通过沉默Myc表达进一步验证其对T细胞活化的调控作用,结果显示si-Myc组Jurkat T细胞CD25、CD69 MFI值及IL-2水平均显著低于si-con组,Jurkat T细胞活性明显降低,说明降低Myc表达可有效抑制T细胞活化。提示miR-33b可能通过负向调控Myc表达并减少IL-2分泌量进而抑制T细胞增殖及活化。
综上所述,DCM患者CD4+T细胞中miR-33b表达下调并可促进Myc表达进而促使T细胞异常活化,这可能是DCM发病机制之一,为提高DCM治疗效果提供潜在靶标基因。但CD4+T细胞活化及增殖过程较为复杂,涉及转录因子、细胞因子、多种miRNA等调控过程,因而需进一步探究miR-33b与Myc对T细胞活化及增殖的调控机制。
