基于生物信息学的溃疡性结肠炎免疫细胞的浸润模式分析
2021-01-27陶弘武柳越冬林亚南许博佳罗瑞娟姜莎莎
李 娜 陶弘武 柳越冬 林亚南 许博佳 罗瑞娟 王 磊 姜莎莎
(辽宁中医药大学,沈阳 110032)
溃疡性结肠炎(ulcerative colitis,UC)是一种特发性复发性炎症性疾病,发病率较高。虽然UC的病因尚不清楚,但其特征表现为连续性肠道黏膜的炎症,从直肠开始,并可累及整个结肠。环境和生活方式与药物使用、高糖和高脂肪的饮食、污染、较高的社会经济地位、压力与UC有关,免疫反应在UC的全过程中起重要作用。免疫耐受的丧失导致各种免疫炎症因子的增加而诱发炎症。它们刺激抗原特异性效应物的增殖,从而触发适应性免疫系统,导致局部和全身炎症。UC的免疫应答和炎症途径表明,各种类型的细胞,包括抗原呈递细胞、T辅助细胞、调节性T细胞和自然杀伤T细胞,通过调控炎症在UC发病中发挥重要作用。本文利用GEO数据库中UC的微阵列测序, 并利用CIBERSORT[1]计算其免疫细胞组成, 进一步分析其与UC的相关性,并初步评估 UC中免疫细胞浸润情况,为进一步研究 UC 的分子机制提供了新思路。
1 材料与方法
1.1数据下载 数据采集本研究利用了GEO[2]数据库(https://www.ncbi.nlm.nih.gov/gds)的数据。MeSH检索词为“colitis,ulcerative”或“Ulcerative colitis”和“Homo sapiens”和“Expression profiling by array”和“tissue”,GSE11223微阵列测序数据集[3],样本通过Agilent-012391全人类基因组Oligo微阵列测序,平台文件为GPL1708,包括了67例UC患者肠道不同解剖部位的上皮活检分析,病理结果分为炎症组织和非炎症组织,剔除非炎症组织。此外,该数据集还包含了31例正常对照组肠道不同解剖部位上皮组织样本,剔除其中8个病理报告为假膜性结肠炎、例憩室炎、阿米巴病等[3]炎症的组织样本。
1.2数据预处理 使用R软件[4](version 4.0.3,http://r-project.org/)的affy包[5]分别读取两个数据集的原始数据,通过RMA算法[6]分别进行背景校正、数据归一化处理。然后在Bioconductor[7]应用GPL1708平台所对应的基因注释文件对探针矩阵进行注释。将基因表达数据集是使用标准的注释文件和数据上传到CIBERSORT网站门户[8](http://cibersort.stanford.edu/), CIBERSORT是一种基于基因表达的反卷积算法[9]中,对每个样本以CIBERSORT值P<0.05为标准筛选,将过滤后的免疫细胞表达矩阵与 GEO的信息矩阵融合,并对UC的免疫细胞进行评价。
1.3数据处理和免疫细胞浸润的评估 在GSE11223微阵列中,原始样本数目为202,从UC中剔除病理报告为非炎症组织的样本,获得63个样本;同时在正常对照组中,剔除病理报告为炎症组织,获得69个样本,应用CIBERSORT标准,P<0.05进行过滤,有44个UC样本和31个正常样本符合过滤条件。
1.4统计学方法 使用R语言4.0.3版本,应用arrayImpute、arraryMissPattern软件包处理微阵列缺失值,因缺失数据很少,采用简单插补,即用均值来替换变量中的缺失值。使用barplot函数绘制其22种浸润免疫细胞的占比柱状图,应用pheatmap包分别分析和绘制免疫细胞表达热图,采用vioplot包绘制小提琴图,使用corrplot包绘制不同免疫细胞间的占比相关图。P<0.05为差异有统计学意义。
2 结果
2.1样本数据标准化 图1为GSE11223中69个正常对照组样本和63个UC组织样本的基因表达量,用R 语言的ggplot2包和boxplot函数绘制未校正的原始箱式图。随后进一步应用affy包和其中的rma函数,其中normalize.method使用的quantiles方法,无需假设任何参数,对差异表达基因数据进行标准化及处理,然后以箱式图(图2)呈现,使得各个样本数据处于相同的水平,从而得到具有生物学意义的基因表达量的变化情况。

图1 样本未经校正的原始箱式图Fig.1 Uncorrected original box diagram of SamplesNote:The graph is GSE11223 in the normal control group (69 samples) and ulcerative colitis patients (63 samples)gene expression level of boxplot.

图2 样本表达校正箱式图Fig.2 Sample expression correction box diagramNote:The mean value of gene expression after sample normalization[10].
2.2UC组织免疫细胞占比和含量分析 图3和图4联合分析所示, 在UC组织中浸润水平最高的10种免疫细胞类型分别是:幼稚B细胞、静息状态下记忆CD4+T细胞、活化的CD4+记忆性T细胞、M2巨噬细胞、M0巨噬细胞、M1巨噬细胞、CD8+T细胞、静息状态下的肥大细胞、激活的自然杀伤细胞、滤泡辅助性T细胞、调节性T细胞。

图3 GSE11223样本中22种免疫细胞占比的柱状图Fig.3 Histogram of proportion of 22 kinds of immune cells in GSE11223 samples
2.3对UC免疫细胞进行无监督聚类分析 使用免疫细胞比例进行的无监督聚类分析显示了5个亚群,如图4所示。细胞亚群1由树突状细胞(活化)、肥大细胞(活化)、自然杀伤细胞(静息)、单核细胞、调节性T细胞构成。细胞亚群2由活化的 CD4+记忆性T细胞、M1巨噬细胞、CD8+T细胞构成。细胞亚群3由自然杀伤细胞(活化)、M2巨噬细胞、肥大细胞(静息)组成。细胞亚群4由M0巨噬细胞、γδT细胞组成。细胞亚群5由幼稚B细胞、静息状态下记忆CD4+T细胞组成。研究表明,相对于细胞亚群3和细胞亚群4功能的失调,细胞亚群1、细胞亚群2的活跃,上述主要细胞亚群的变化差异是UC的发生发展的直接原因。

图4 GSE11223样本中22 种免疫细胞含量热图Fig.4 Heatmap of 22 immune cells in GSE11223 samplesNote:The blue control group represents the normal control group,and the red Treat group represents ulcerative colitis group.
2.4免疫细胞在正常对照组和UC组的比例差异 与UC组织相比,在正常组织中,M2巨噬细胞、未活化的树突状细胞的比例普遍较高(P<0.05)。与正常组织相比,在UC组织中活化的 CD4+记忆性T细胞、调节性T细胞、单核细胞、中性粒细胞、M0巨噬细胞、活化的肥大细胞、未活化的肥大细胞的比例普遍较高(P<0.05),见图5。

图5 样本免疫细胞占比小提琴图Fig.5 Proportion of immune cells in a violin diagramNote:Samples of normal control group and inflammatory tissue samples of patients with ulcerative colitis from GSE11223.Green represents normal control group,blue represents ulcerative colitis group.
2.5UC组织免疫细胞的相关分析 图6可见,在UC组织中,构成比相关系数较大的免疫细胞包括:负相关的可见未活化的CD4+记忆性T细胞与CD8+T细胞(-0.5),未活化的CD4+记忆性T细胞与活化的CD4+记忆性T细胞(-0.43),幼稚B细胞与浆细胞(-0.52),幼稚B细胞与记忆B细胞(-0.49),幼稚B细胞与M1巨噬细胞(-0.49),M2巨噬细胞与M0巨噬细胞(-0.56),以上负相关提示活化的CD4+记忆性T细胞、CD8+T细胞与未活化的CD4+记忆性T细胞之间在UC疾病进程中相互抑制。正相关的可见活化的肥大细胞与活化的树突细胞(0.64),活化的肥大细胞与中性粒细胞(0.47),活化的树突细胞与中性粒细胞(0.42),上述正相关提示活化的树突细胞、活化的肥大细胞、中性粒细胞三种免疫细胞在UC疾病过程中具有相互协同作用的关系。

图6 UC组织样本中每种免疫细胞占比相关图Fig.6 Correlation of proportion of each immune cell in ulcerative colitis tissue samples
3 讨论
UC是一种慢性结肠特发性炎症性肠病,可引起从直肠向近端结肠持续的黏膜炎症,且炎症程度不一,UC接受药物治疗的患者需要持续长时间应用皮质类固醇控制,因此解决UC免疫反应成为当务之急。固有免疫是病原微生物入侵肠道黏膜的第一道防线。本研究从全人类基因组Oligo微阵列数据分析的角度开展。在正常组织中,巨噬细胞M2(P=0.014)、静息树突状细胞(P=0.012)高表达。而UC参与固有免疫的特征性细胞有单核细胞(P=0.037)、巨噬细胞M0(P=0.001)、中性粒细胞(P=0.011),上述细胞初次与抗原接触即能发挥效应,但无记忆性,也是特异性免疫的基础。
在谈到特异性免疫时,树突状细胞一直被认为是体内唯一能够将抗原提呈给初始状态CD4+T细胞的抗原提呈细胞。树突状细胞转化为适应性免疫反应,活化的树突状细胞停留在上皮屏障附近,和黏膜固有层的巨噬细胞一起激活局部适应性反应[11]。现在已有研究证实B细胞表达的Toll样受体及其信号通路对CD4+T细胞的活化和分化发挥着关键作用,刷新了CD4+T细胞对抗病原微生物过程的反应的认识[12]。
图7系统地展示了本研究的结果。在本项研究中,CD4+记忆性T细胞在UC与正常组织之间存在显著差异(P<0.05),在UC组织中,CD4+记忆性T细胞的比例普遍高于正常组织。生理正常状态下,CD4+记忆性T细胞是体液免疫中由B细胞分化而来的一种免疫细胞。CD4+记忆性T细胞在抗原二次感染细胞时,可直接增殖、分化产生效应T细胞。CD4+记忆性T细胞可在人体内存在数月,甚至几十年,使人体避免受到相应病原体的二次侵入。研究证实病理状态下,肠道内CD4+T细胞[13]、调节性T细胞浸润,CD4+T细胞和调节性T细胞的基线百分比与UC结局相关[14]。 CD4记忆效应T细胞,可以导致IL-7表达水平增高,诱导肠道黏膜固有层炎症发生。而调节性T细胞的IL-8+Foxp3+细胞亚群在UC的微环境中,不仅抑制人体免疫反应,还可诱导关键的炎症细胞因子,调动中性粒细胞聚集和转运,中性粒细胞表达量的显著差异,从侧面支持了中性粒细胞在急性黏膜炎症和损伤中扮演重要角色,由于大量炎症细胞存在于结肠导致的隐窝脓肿[15-17]。甚至促进启动溃疡性大肠癌的发生。
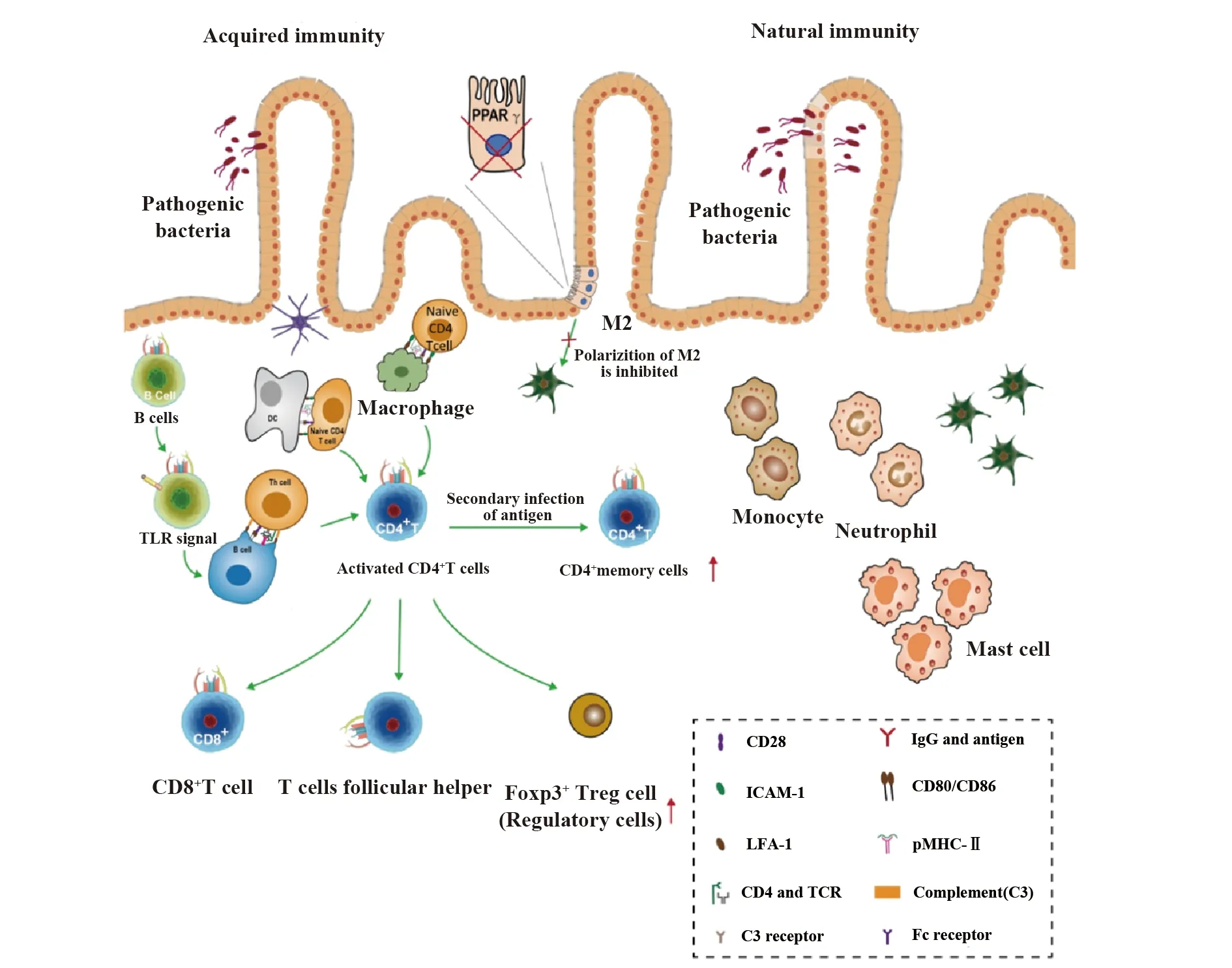
图7 基于GSE11223微阵列数据集,UC免疫特征性细胞在固有性免疫及特异性免疫的差异表达Fig.7 Based on GSE11223 data set, characteristic cells in UC were differentially expressed in innate immuni-ty and specific immunityNote:① In UC tissue, antigen-presenting cells (dendritic cells, macrophages, B cells) react with naive CD4+T cells,which activated CD4+T cells (P<0.05); ②TLR signal expressed by B cells also promotes the activation of CD4+T cells;③CD4+ memory T cells showed significant difference between ulcerative colitis and normal tissue (P<0.05);④The characteristic expression of macrophage M2 is decreased in UC (P<0.05), considering that the polarization of M2 induced by PPAR is inhibited[26-29];⑤The characteristic cells involved in the innate immunity of UC are monocytes (P=0.037), macrophage M0 (P=0.001) and neutrophils (P=0.011).
尽管目前有研究指出UC患者巨噬细胞表型向M1转移,呈现高促炎细胞因子分泌,可增强细胞毒性和吞噬能力[18,19]。而本研究表明,M1巨噬细胞在UC与正常组织之间不存在显著差异(P>0.05,图5所示)。在UC组织中M0巨噬细胞的比例普遍较高(P<0.05)。而在UC组织中M2巨噬细胞的比例普遍较低(P<0.05)。在一项对儿童UC研究的芯片数据集GSE87473进行免疫细胞浸润分析显示[20],儿童UC中调节性T细胞、单核细胞、M0巨噬细胞和活化肥大细胞比例较高,而M2巨噬细胞和活化树突状细胞比例在UC的患者中较低,在该项研究中,M1巨噬细胞也不存在特征性差异,与本研究分析结果具有一致性。目前已知M2 巨噬细胞,参与了溃疡性大肠癌肿瘤血管生成,在克隆恩病和结直肠癌中高表达,其发生机制为IL-4/IL-13和IL-10激活STAT3和STAT6时,增加巨噬细胞M2的极化水平有关[21-23]。但作为巨噬细胞M2的转录因子,PPARγ缺失均导致巨噬细胞M2极化受到抑制[24,25],目前也被认为是导致巨噬细胞M2在溃疡性结肠炎中特征性低表达的原因之一[26-29]。
本研究应用生物信息学分析技术,基于CIBERSORT研究方法,分析了正常结肠组织和UC组织的全人类基因组Oligo微阵列测序,它提供关于UC免疫细胞的明确信息。
本研究结果表明,CD4+记忆性 T 细胞、巨噬细胞M2型、调节性T细胞和UC的发生发展密切相关,而这些特征性免疫细胞可能是药物治疗作用效应的重要决定因素,也是免疫治疗评估的中心焦点,更能为UC患者的治疗评估策略提供标志性参考。
