甘精胰岛素联合格列美脲治疗2 型糖尿病的临床疗效研究
2021-01-26陈剑生
陈剑生
2 型糖尿病(T2DM)是一种具有遗传性的慢性代谢性疾病,受人口老龄化及饮食结构变化的影响,其发病率逐年升高,而且我国形势最为严峻,患病例数高达1 亿以上[1]。因此,提高血糖控制率刻不容缓。胰岛素是降糖效果最好的药物,但是血糖达标率依然不理想,而且随着胰岛素剂量的增加,低血糖的发生风险也随之增加[2]。既往研究发现,采用胰岛素泵和口服降压药联合治疗T2DM,可进一步改善患者空腹血糖(FBG)及餐后2 h 血糖(2 h PG)水平,而且在减少胰岛素剂量的同时还能降低血糖发生风险[3]。格列美脲属于新型磺脲类口服降糖药,与传统磺脲类药物相比,具有长效、用量少、不良反应少的优点[4]。本研究旨在探讨甘精胰岛素联合格列美脲治疗T2DM 的临床疗效,以期能够为临床制定更好的血糖控制方案提供参考。
1 对象与方法
1.1 研究对象 选取2019 年7 月—2020 年7 月武汉长动医院收治的T2DM 患者109 例作为研究对象,采用随机数字表法将其分为对照组(n=54)和观察组(n=55)。2 组性别、年龄、体质指数(BMI)、FBG、糖化血红蛋白(HbA1c)、糖尿病家族史比较,差异无统计学意义(P>0.05),具有可比性。见表1。本研究已获得武汉长动医院医学伦理委员会批准,且所有患者已签署知情同意书。

表1 2 组基础资料比较
1.2 纳入与排除标准 纳入标准:(1)符合T2DM 的诊断标准[5];(2)年龄为18~80 岁;(3)BMI 为18~30 kg/m2;(4)自愿参与本研究。排除标准:(1)1 型糖尿病和其他类型的糖尿病;(2)伴有严重心、肝、肾功能不全者;(3)伴有恶性肿瘤者;(4)合并认知功能障碍者;(5)妊娠或哺乳期女性患者;(6)对本研究所用药物不耐受者。
1.3 治疗方法 对照组采用甘精胰岛素(珠海联邦制药股份有限公司生产,国药准字S20173001,规格3 ml:300 U)进行治疗,皮下注射,起始剂量为0.2 U/kg,睡前注射1 次,根据FBG 调整剂量,每4 d 调整1 次,每次调整2 U/kg,直到FBG达标。观察组在对照组的基础上采用格列美脲〔赛诺菲(北京)制药有限公司生产,国药准字H20057672,规格2 mg/片〕进行治疗,口服,剂量为2 mg,早餐前30 min 服用,1 次/d。2 组患者在治疗过程中严格遵医嘱用药、饮食和运动,连续治疗3 个月。
1.4 观察指标
1.4.1 血糖达标率及其维持时间 以FPG 为4.4~6.1 mmol/L,2 h PG 为4.4~8.0 mmol/L,HbA1c≤7.0%为血糖达标,计算2组血糖达标率(血糖达标率=达标例数/总例数×100%)。采集患者清晨空腹及餐后2 h 肘静脉血,采用全自动生化分析仪(7200-C,日本岛津公司)、利用葡萄糖氧化酶法检测FPG、2 h PG,采用高效液相离子层析法检测HbA1c。通过动态血糖监测系统〔雷兰,圣美迪诺医疗科技(湖州)有限公司〕,将电极植入皮下,佩戴72 h,通过24 h 血糖图谱计算血糖达标维持时间。
1.4.2 血糖波动指标 通过动态血糖监测系统获取2 组血糖波动指标,包括24 h 血糖标准差(SDBG)、最大血糖波动幅度(LAGE)、平均血糖波动幅度(MAGE)及日间血糖平均绝对差(MOOD)。
1.4.3 胰岛功能指标 分别于治疗前、后采集患者清晨空腹肘静脉血,检测胰岛功能指标,包括空腹胰岛素(FINS)、胰岛素分泌指数(HOMA-β)和胰岛素抵抗指数(HOMA-IR)。其中FINS 采用化学免疫发光法检测,仪器为全自动化学发光免疫分析仪(罗氏,E170);HOMA-β 和HOMA-IR 计算方法分别为:HOMA-β=FINS/(FPG-3.5)×20,HOMAIR=FINS×FPG/22.5。
1.4.4 不良反应 统计2 组治疗期间不良反应发生情况,包括低血糖、恶心、腹泻、便秘。
1.5 统计学方法 采用SPSS 22.0 软件对数据进行分析。计量资料均符合正态分布且方差齐,以表示,组内比较采用配对t检验,2 组间比较采用独立样本t检验;计数资料以相对数表示,组间比较采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 血糖达标率及其维持时间 观察组血糖达标率高于对照组,血糖达标维持时间长于对照组,差异有统计学意义(P<0.05)。见表2。
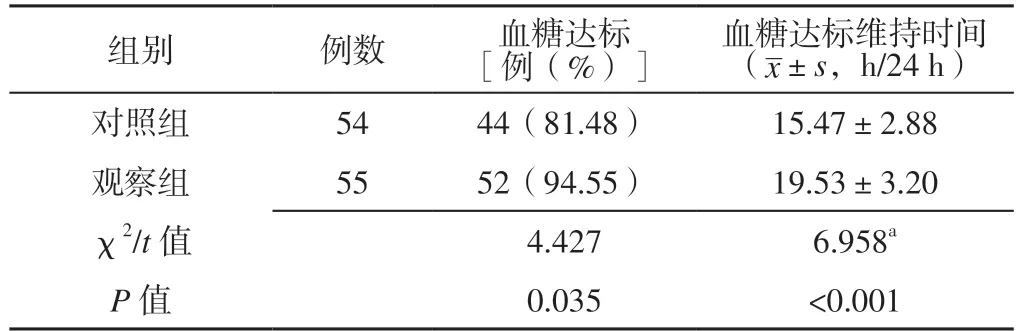
表2 2 组血糖达标率及其维持时间比较
2.2 血糖波动指标 观察组SDBG、LAGE、MAGE 及MOOD低于对照组,差异有统计学意义(P<0.05)。见表3。
表3 2 组血糖波动指标比较(,mmol/L)
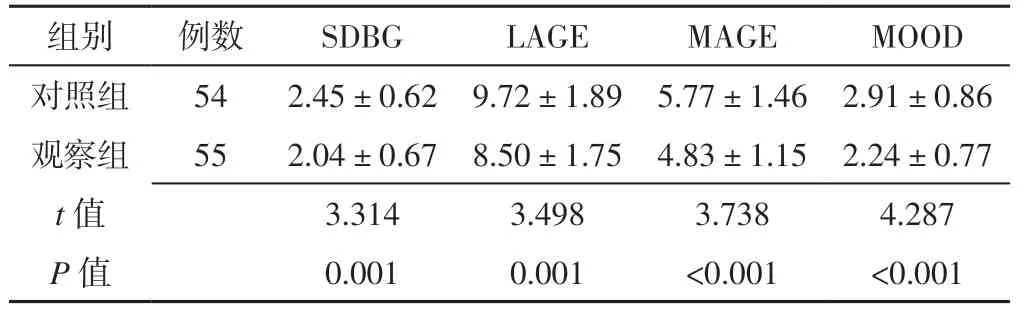
表3 2 组血糖波动指标比较(,mmol/L)
2.3 胰岛功能指标治疗前,2 组FINS、HOMA-β、HOMA-IR 比较,差异无统计学意义(P>0.05);治疗后,观察组FINS、HOMA-β 高于对照组,HOMA-IR 低于对照组,差异有统计学意义(P<0.05)。对照组、观察组治疗后FINS、HOMA-β 分别高于本组治疗前,HOMA-IR 分别低于本组治疗前,差异有统计学意义(P<0.05)。见表4。
表4 2 组胰岛功能指标比较()

表4 2 组胰岛功能指标比较()
注:与本组治疗前比较,aP<0.05
2.4 不良反应 观察组不良反应发生率为12.74%(7/55),对照组不良反应发生率为24.07%(13/54)。2 组不良反应发生率比较,差异无统计学意义(χ2=2.342,P=0.126)。见表5。
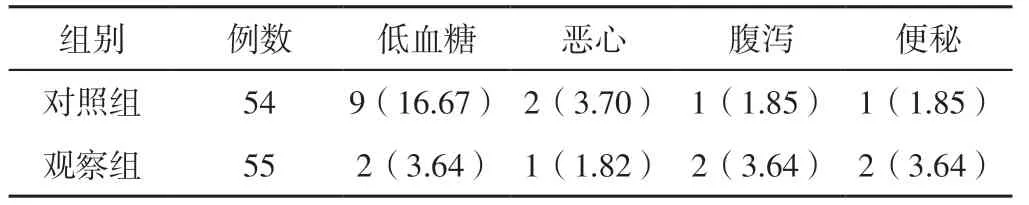
表5 2 组不良反应发生情况 [例(%)]
3 讨论
胰岛素分泌和/或作用缺陷是引起糖尿病的主要原因,患者主要临床表现为血糖持续性升高,主要疾病类型为T2DM,占所有患者的90%以上[6]。研究显示,T2DM 呈进行性发展,伴随着胰岛β 细胞功能下降和胰岛素抵抗,后期多数患者需要胰岛素来维持较好的血糖控制效果[7]。但是在T2DM 的治疗过程中,胰岛素的使用会出现“边际效应”,即随着胰岛素剂量的增加血糖水平接近达标时,降糖效果逐渐降低而达不到预期效果;此外,血糖波动较大,甚至出现低血糖事件[8]。研究表明,在使用胰岛素的基础上联合口服降糖药,可增强血糖控制效果,减少低血糖事件[9]。为进一步验证胰岛素与口服降糖药的联用效果,本研究将甘精胰岛素和格列美列联合用于治疗T2DM。
本研究结果显示,观察组血糖达标率高于对照组,血糖达标维持时间长于对照组,说明与单纯甘精胰岛素相比,甘精胰岛素联合格列美脲对T2DM 患者的血糖控制效果更好。甘精胰岛素属于重组人胰岛素类似物,主要通过抑制肝葡萄糖的输出,增强胰岛素的敏感性来控制血糖,经皮注射后先被中和形成各种微小成分,再缓慢进入血液,作用时间长,而且效果相对平稳[10]。格列美脲是美国食品药品监督管理局(FDA)批准的首个可与胰岛素联合使用的磺脲类降糖药物,具有胰内、胰外双重降糖作用,胰内通过与胰岛β 细胞膜上受体结合使钾离子通道关闭,进而开放钙离子通道,促进胰岛素分泌;而胰外作用则是增加周围组织对葡萄糖的摄入及利用[11]。二者联合使用可以发挥协同作用,故而降糖效果更明显。张丹丹等[12]研究亦显示,甘精胰岛素联合格列美脲治疗T2DM 的疗效更好,患者的血糖达标率更高。
研究显示,大幅度的血糖波动可增加糖尿病相关并发症发生风险,甚至造成患者死亡,因此,临床将减小血糖波动幅度作为管理糖尿病的重要内容[13]。动态血糖检测系统可记录患者短期内的血糖图谱,全面反映患者血糖波动情况,其中MAGE、SDBG、LAGE 是评估24 h 内血糖波动的参数,MOOD 是评估日间血糖波动的参数[14]。本研究结果显示,观察组SDBG、LAGE、MAGE 及MOOD 低于对照组,表明甘精胰岛素联合格列美脲可减小T2DM 患者血糖波动幅度。可能的原因是:(1)格列美脲具有双重降糖作用;(2)甘精胰岛素和格列美脲可完全被胃肠道吸收,而且吸收利用度不受进餐影响;(3)甘精胰岛素联合格列美脲可减少外源性胰岛素的用量。本研究结果还显示,观察组FINS、HOMA-β 高于对照组,HOMA-IR 低于对照组,提示甘精胰岛素联合格列美脲可明显改善T2DM 患者的胰岛β 功能,减少胰岛素抵抗。胰岛β 细胞功能损伤及胰岛素抵抗是造成T2DM 进展的主要原因,既往报道指出,格列美脲与胰岛β 细胞膜上对应的受体结合时间短,加快了胰岛素的分泌,从而减少了外援性胰岛素的用量,延缓了胰岛β 细胞的凋亡[15]。此外,格列美脲较快的结合及解离可激活脂肪组织中的过氧化物酶体增殖物激活受体γ,从而降低组织对胰岛素的抵抗作用。既往研究显示,联合使用格列美脲可明显改善T2DM 患者的胰岛功能[16]。低血糖是T2DM 患者使用甘精胰岛素后的主要不良反应。本研究结果显示,2 组不良反应发生率比较无统计学差异,提示甘精胰岛素联合格列美脲的安全性较高。既往诸多研究均显示,格列美脲联合胰岛素治疗T2DM,可减少低血糖的 发生[17]。
综上所述,甘精胰岛素联合格列美脲治疗T2DM 的效果较好,不仅能促进患者血糖达标,降低血糖波动幅度,还能改善胰岛功能,且安全性较高。
