多表位融合蛋白对减少梅毒抗体测定假反应性的作用*
2021-01-26林勇平杜丽枝邓湘雪刘斯琦林润培刘忠民
雷 雪,林勇平,向 波,杜丽枝,邓湘雪,刘斯琦,林润培,刘忠民△
1.广州医科大学附属第一医院检验科,广东广州 510000;2.广州医科大学金域检验学院,广东广州 510000
1 资料与方法
1.1一般资料 收集2017年3月至2018年3月广州医科大学附属第一医院雅培全自动免疫分析仪Architect i2000(简称Architect i2000)梅毒检测阳性血清标本96份(1≤S/CO≤10),健康人标本50份。血清分装后保存于-80 ℃超低温冰箱。
1.2仪器与试剂 质粒提取和胶回收试剂盒购自天根公司;Premix Ex Taq DNA聚合酶购自TAKARA公司;内切酶XhoⅠ、NcoⅠ、T4 DNA连接酶和蛋白标准相对分子质量购自Thermo Fisher公司;HRP购自Sigma公司;His Trap FF亲和层析柱购自GE公司。
1.3方法
1.3.1重叠PCR基因扩增 根据Genbank中的Tp47基因序列,使用IEDB等预测软件进行B细胞表位预测,选定优势表位基因片段。应用Primer Premier V5.0软件设计引物,委托上海生物工程有限公司合成引物。引物序列见表1。
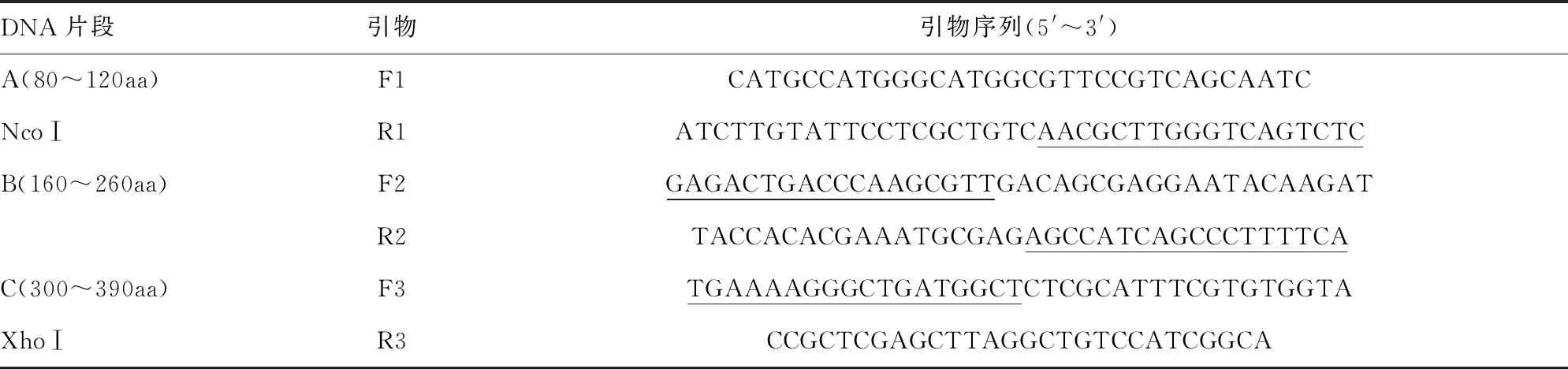
表1 Tp47基因优势抗原表位的引物设计
使用质粒提取试剂盒提取Tp47基因组DNA,以其为模板,PCR扩增、融合3个基因片段获得多表位融合蛋白基因。反应体系共50.0 μL:2×Ex Taq Master Mix 25.0 μL,引物F1和R3 10.0 μmol/L,其余引物各1.0 μmol/L,模板40.0 ng。反应条件:94 ℃ 5 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,35个循环,72 ℃延伸10 min。PCR产物经琼脂糖凝胶电泳鉴定。
1.3.2构建重组质粒 将PCR产物与pET-28b载体进行双酶切,回收目的DNA片段后于22 ℃下连接3 h,将连接片段转导至感受态细胞DH5α中,经卡那霉素筛选阳性克隆,提取质粒双酶切鉴定并测序。测序阳性质粒导入BL21(DE3)感受态细胞中准备诱导。
1.3.3重组蛋白的诱导表达与纯化 将重组工程菌按1∶100的比例接种于含卡那霉素的LB培养基中,待菌液A值为0.6~0.8时,加入异丙基β-D-硫代半乳糖苷(IPTG)至水平为1.0 μmol/L。诱导6 h后收集菌液进行超声碎菌(150 W,超声4 s,暂停4 s,共100次),4 ℃ 12 000 r/min离心10 min后分别收集上清液和沉淀,聚丙烯酰胺凝胶电泳分析目的蛋白。使用ATKA系统(镍离子亲和层析柱法)纯化蛋白后对纯化后的蛋白进行透析除盐和复性。
1.3.4质谱鉴定和免疫印迹试验(WB) 使用基质辅助激光解吸电离飞行时间质谱分析(MALDI-TOF-MS)得到蛋白质指纹图谱,与Blast数据库进行对比。进行梅毒螺旋体颗粒凝集试验(TPPA),阳性血清为一抗,HRP标记的羊抗人IgG为二抗,评估重组蛋白的免疫反应性。
同时,可针对自身特点研发或添置若干新型设备。在联合开发打造先进海缆施工船同时,鉴于舟山现有普通OTDR不能监测海底光缆所受应力变化的实际情况,建议购置增设若干B-OTDR设备以实现对海缆应力变化的动态监测,确保海底光缆运行的安全稳定[7-9]。
1.3.5HRP标记 采用过碘酸钠法,使用商品化的HRP标记重组蛋白,作为双抗原夹心ELISA法的酶标二抗。
1.3.6双抗原夹心ELISA法的建立 以纯化、透析后的多表位融合蛋白作为包被抗原,HRP标记的多表位融合蛋白作为酶标二抗建立双抗原夹心ELISA法。通过棋盘法优化包被抗原和酶标抗原水平、血清稀释度、包被条件、封闭条件和封闭方式等。
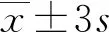
2 结 果
2.1重叠PCR基因扩增结果 经重叠PCR技术获得多表位融合蛋白基因,琼脂糖凝胶电泳分析结果见图1。基因扩增产物为700 bp,与预计相符。
注:M为DL1000 DNA标志物;1为多表位融合蛋白基因PCR产物。
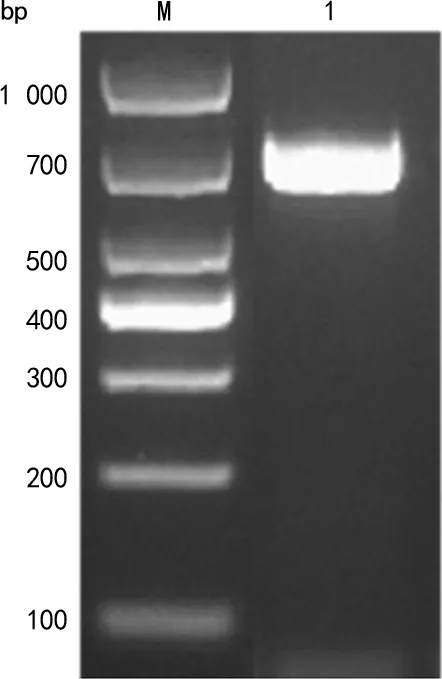
2.2重组质粒载体构建结果 重组载体的双酶切鉴定结果见图2,酶切后的基因片段约为700 bp,符合预期。取阳性质粒送样测序,与数据库中Tp47基因组一致。
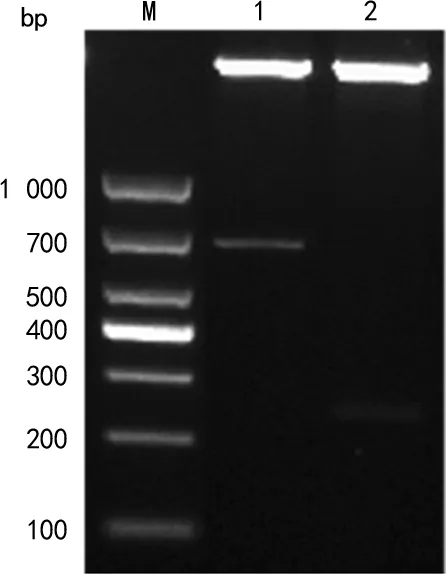
2.3多表位融合蛋白的表达与纯化 重组工程菌在IPTG的诱导下表达,主要以包涵体形式存在,可使用亲和层析柱进行纯化,电泳结果见图3。
2.4质谱鉴定与WB结果 目的蛋白进行MALDI-TOF-MS后,利用Mascot软件在MSDB数据库对质谱结果进行检索。检索结果显示,多表位融合蛋白的肽段序列(GSHMASMTGGQQMGR)与梅毒螺旋体Tp47蛋白相匹配,得分103分,高于阈值分数60分(P<0.05),证明多表位融合蛋白为梅毒螺旋体47×103脂蛋白片段。WB结果表明,多表位融合蛋白能与TPPA阳性血清发生特异性反应,见图4。
注:M为DL1000 DNA标志物;1为pET-28b-多表位融合蛋白基因双酶切产物;2为pET-28b双酶切产物。
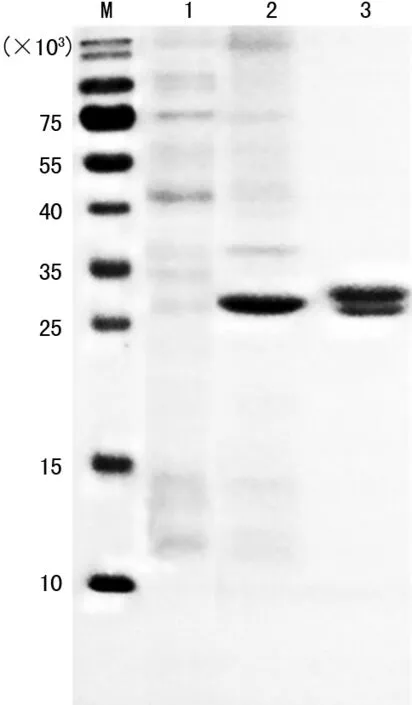
注:M为蛋白标准相对分子质量;1为诱导蛋白上清液;2为诱导蛋白沉淀;3为纯化后的诱导蛋白;3号条带中多表位融合蛋白在包涵体变性纯化阶段可能存在降解,降解片段在后续复性过程中出现沉淀而被分离;聚丙烯酰胺凝胶电泳后,凝胶使用考马斯亮蓝进行染色,脱色后使用Tanon凝胶成像系统进行拍照,故为黑色。

注:M为蛋白标准相对分子质量;1为多表位融合蛋白诱导菌体蛋白;2为pET-28b诱导菌体蛋白(空载诱导蛋白)。
2.5HRP标记 使用过碘酸钠法进行HRP标记,电泳结果显示在170×103上出现蛋白条带,表明标记成功,见图5。

注:M为蛋白标准相对分子质量;1为HRP-多表位融合蛋白;2为HRP;3为多表位融合蛋白;条带使用考马斯亮蓝进行染色,脱色后使用Tanon凝胶成像系统进行拍照,故为黑色。
2.6血清检测结果
2.6.1多表位融合蛋白双抗原夹心ELISA法检测结果 50份Architect i2000梅毒检测阴性(S/CO<1)且TPPA为阴性结果的标本,平均A值为0.107,s为0.051,计算得出临界值为0.258。将A值≥0.26的血清标本判读为阳性,以此临界值作为标准,对96份Architect i2000梅毒检测阳性血清(1≤S/CO≤10)再次进行检测,其中58份为阳性,38份为阴性。以TPPA的结果为标准,多表位融合蛋白双抗原夹心ELISA法的灵敏度和特异度为90.32%(56/62)和94.12%(32/34),与TPPA结果的符合率为91.67%(88/96),见表2。
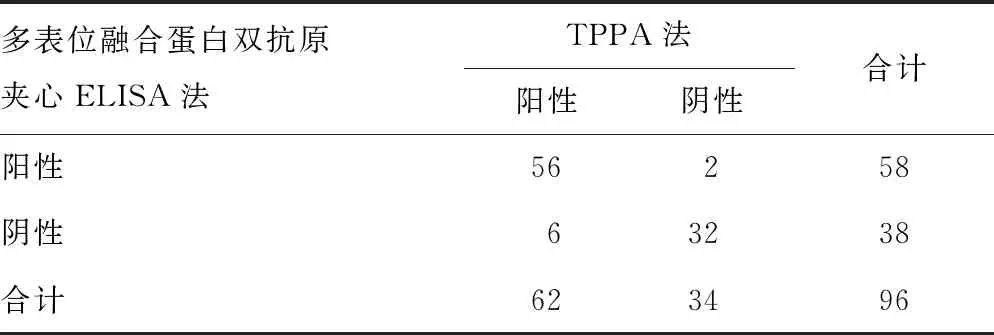
表2 多表位融合蛋白双抗原夹心ELISA法和TPPA法的检测结果比较(n)
2.6.2Tp47蛋白双抗原夹心ELISA法检测结果 50份Architect i2000梅毒检测阴性(S/CO<1)且TPPA为阴性结果的标本,平均A值为0.072,s为0.041,计算得出临界值为0.195。将A值≥0.195的血清标本判读为阳性,以此临界值作为标准,对96份Architect i2000梅毒检测阳性血清(1≤S/CO≤10)再次进行检测,其中65份为阳性,31份为阴性。以TPPA的结果为标准,Tp47蛋白双抗原夹心ELISA法的灵敏度和特异度为93.55%(58/62)和79.41%(27/34),与TPPA结果的符合率为88.54%(85/96),见表3。
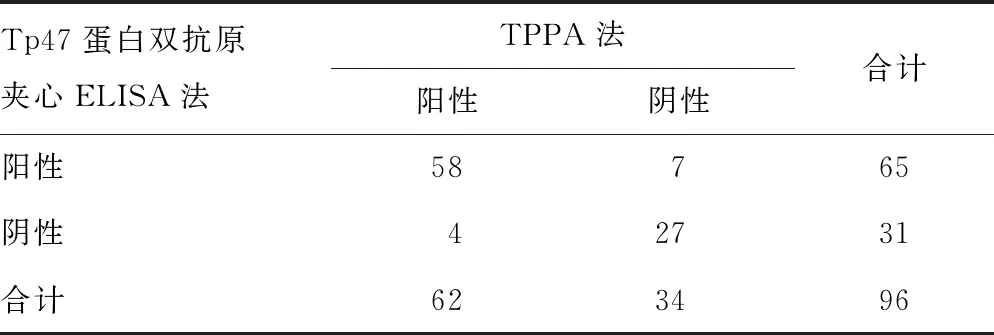
表3 Tp47蛋白双抗原夹心ELISA法和TPPA法的检测结果比较(n)
3 讨 论
本研究利用多表位融合蛋白运用优化后的双抗原夹心ELISA法检测梅毒血清标本,该法与TPPA结果的符合率为91.67%,特异度为94.12%,而基于Tp47蛋白的双抗原夹心ELISA法与TPPA结果的符合率为88.54%,特异度为79.41%。与Tp47蛋白双抗原夹心ELISA法相比,多表位融合蛋白双抗原夹心ELISA法检测的特异度较高,说明通过应用优势表位融合蛋白作为抗原,提高临床梅毒筛查的特异度,解决临床假反应性的方案是可行的。
本研究结果发现,基于多表位融合蛋白的双抗原夹心ELISA法检测中有两份标本出现了假反应性结果,可能是因为血清中存在某些未知的因素引起的交叉反应,目前尚未得知。例如:有6份阳性标本漏检,可能是因为仅仅使用了Tp47的大部分优势表位,存在选择遗漏。TPPA虽然作为目前诊断梅毒的金标准,但所用的诊断抗原为Tp裂解的全天然蛋白抗原,包含众多的复杂表位,因此也存在某些交叉反应而可能导致假反应性结果,在后续试验中应进一步使用多种诊断方法进行评价。
国内外的研究常使用表位预测的方法预测优势表位基因片段,并对其优势表位基因片段进行表达。目前梅毒抗体检测多采用Tp47(Tp0574)、Tp17(Tp0453)和Tp15(Tp0171)等蛋白通过不同的组合作为抗原[10-11],较少有研究针对优势表位基因片段进行融合表达,本研究的创新性在此。有研究通过表达伯氏疏螺旋体特有的表位短肽作为抗原靶标,通过消除非特异性表位,提高了莱姆病检测的特异度[12]。LIN等[13]选用丙型肝炎病毒(HCV)基因组的型特异区段和优势抗原表位合成多表位融合重组抗原,与第二代HCV的血清学检测方法相比,灵敏度和特异度提高了2~4倍。因此,利用优势抗原表位融合蛋白作为抗原进行血清学检测,可能有助于提高诊断的特异度。鉴于以上情况,本研究利用生物信息学技术预测Tp47蛋白的B细胞表位,利用重叠PCR技术连接含多个表位基因的片段,去掉抗原性差的部分构建、表达出多表位融合蛋白,使用HRP标记该多表位融合蛋白,建立双抗原夹心ELISA法,对临床标本进行评估。
本研究仅使用目前主要的诊断梅毒的抗原Tp47蛋白作为试验目标,较为局限,还可以考虑优化其他具有强免疫反应性的蛋白如Tp15、Tp17等,联合多个不同蛋白的多表位融合蛋白作为抗原,提高ELISA法检测的灵敏度和特异度。此外,WANG等[14]通过在ELISA法中添加尿素解离的步骤,选择合适的解离浓度和时间,使假阳性血清标本转为阴性,改进ELISA法的灵敏度(100.00%),为本试验中多表位融合蛋白检测灵敏度较低的情况提供了改进方案。
在未来的研究中,通过联合多种蛋白和改进试验步骤的方式,争取在高灵敏度的前提下,建立高特异度的梅毒血清学筛查方法。还可以利用多表位融合蛋白建立化学发光法以提高梅毒的筛查速度,该策略也可用于目前HIV、HCV等存在高假阳性标本的临床血清学筛查中。
本研究以多表位融合蛋白作为包被抗原,HRP标记该蛋白作为酶标抗原,对临床标本进行检测,与Tp47蛋白相比,具有更好的检测性能。国内外较少有对优势表位基因片段进行融合表达后方法学的建立。本研究为解决梅毒血清学筛查中假反应性问题提供了思路,为新一代的梅毒血清学诊断方法的建立提供了重要的实验依据。
