无创产前筛查中胎儿游离DNA比例的影响因素分析*
2021-01-26冀小平武丽琼侯东霞郭志远张美玲王晓华
王 杰,冀小平,武丽琼,安 槿,侯东霞,朱 博,郭志远,张美玲,王 艳,王晓华△
1.内蒙古自治区妇幼保健院遗传优生科,内蒙古呼和浩特 010020;2.内蒙古大学省部共建草原家畜生殖调控与繁育国家重点实验室,内蒙古呼和浩特 010021
血液中的游离DNA主要是指存在于外周血中的游离于细胞外的DNA片段,主要通过活细胞的主动释放或凋亡、死亡细胞的被动释放而产生,经快速降解后释放到血循环中[1]。1997年,LO等[2]发现孕妇外周血中的游离DNA除了来源于孕妇自身外,还有极少部分是来自于胎儿,其中来源于孕妇的游离DNA占80%~95%,来源于胎儿游离DNA(cffDNA)占5%~20%。孕妇外周血中的cffDNA主要来源于穿过胎盘屏障的胎盘滋养细胞。因此,理论上当胎儿为三体时,孕妇外周血中的cffDNA也同样为三体,这使得该染色体上孕妇外周血cffDNA比例与健康孕妇相比,明显升高。这一发现为无创产前筛查(NIPS)技术打下了理论基础。
由于cffDNA在孕妇外周血中占比极低,因此NIPS检测的可靠性在很大程度上取决于所测试样品中是否有足够的cffDNA。一般来说,孕妇外周血cffDNA比例通常在3%~30%[3]。通常情况下,胎儿非整倍体的产前筛查要求cffDNA比例至少达4%[3]。如果孕妇外周血中的cffDNA比例过低,则可能受相对比例较高的孕妇正常DNA的影响,进而影响检测结果的准确性,甚至造成检测失败。这不仅给孕妇造成了困扰,也影响了该技术在临床中的推广、应用。有研究提示,cffDNA比例与孕周呈正相关,与孕妇体质量、体质量指数(BMI)呈负相关,妊娠期并发症或合并症、孕妇年龄、孕中期唐氏筛查结果、胎儿染色体核型及颈后透明层也是潜在的影响因素[4]。本研究对在内蒙古自治区妇幼保健院进行NIPS检测的4 268例孕妇外周血cffDNA比例与孕周、孕妇BMI、孕妇年龄、妊娠单双胎、标本运输时间等相关因素之间的关系进行了回顾性分析,对所有筛查对象跟踪随访至胎儿出生,以探讨影响cffDNA比例的因素,分析NIPS失败的原因,为不同孕妇制订个体化的产前遗传学检测方案提供参考。
1 资料与方法
1.1一般资料 收集2018年9月至2019年3月于内蒙古自治区妇幼保健院进行NIPS检测的4 268例孕妇,孕周为11+3~36周,其中孕早期(11~12周)157例,孕中期(>12~27周)4 091例,孕晚期(>27~36周)20例;单胎4 158例(97.42%),双胎110例(2.58%);孕妇年龄18~47岁,平均(31±6)岁;BMI为15.62~35.71 kg/m2,中位BMI为23.44 kg/m2。所有研究对象根据孕周、BMI、年龄、妊娠单双胎、标本运输时间分成不同的组别。检测孕周不在最适检测孕周(12+0~22+6周)的孕妇,其中<12+0周6例,>22+6周149例。由临床医生告知研究对象本研究的目的、方法等,研究对象均签署知情同意书,本研究获得医院医学伦理委员会批准。
1.2方法
1.2.1NIPS检测方法 抽取孕妇外周静脉血5 mL,置于cffDNA专用真空采血管(康为世纪,中国)中,分别以1 600×g及16 000×g低温离心10 min后得到血浆标本。应用联合探针锚定聚合测序法,按照胎儿染色体非整倍体(T21、T18、T13)检测试剂盒说明书操作,并借助于BGI500测序平台进行测序,利用高分辨率成像系统及生物信息系统转换得到待测序列。所得序列经与人参考基因组(GRCh37/hg19)比对,确定每一测序reads染色体的定位,计算得出标准化Z值。当标本满足度量标准(有效数据量≥3.5 Mb,无扩增偏倚,cffDNA比例≥3.5%)时根据标准化Z值评估检测结果:若Z值的绝对值≥3,提示高风险;若Z值为>-3~<3,结果为低风险。
1.2.2cffDNA比例的评估方法 (1)Y染色体估算法[3]:健康女性的染色体核型为46,XX,是不含Y染色体的,也就是说一旦在孕妇血浆中检测出了来源于Y染色体的cffDNA片段,则为cffDNA。(2)SeqFF估算法[5]:在孕妇血浆中检测到的cffDNA并非是均匀、散在分布在染色体所有区域的。实际上,在有的染色体区域内,cffDNA占比高,而在有的染色体区域内,cffDNA占比很少。利用cffDNA这一特性,将各常染色体按照每50 kb分割成区间窗口(bin),选出cffDNA片段为100~150 bp的bin,计算这些cffDNA片段长度较短的bin占所有bin的比例,并以GC含量、读段数等指标作为参数,建立一个高度回归模型,即seqFF模型,通过该模型即可估算cffDNA比例。本研究将Y染色体估算法和seqFF估算法综合运用,评估标本中cffDNA比例。选择3.5%作为cffDNA比例最低检测限[6]。
1.2.3妊娠结局随访 查询电子病历记录系统或打电话对孕妇的妊娠结局进行追踪随访。随访内容包括胎儿或新生儿是否表现为典型的21、18、13-三体综合征,孕妇有无流产、引产、双胎之一消失,分娩孕周,以及新生儿出生时健康状况、体格检查结果、有无其他临床诊断和(或)遗传学诊断的异常。
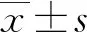
2 结 果
2.1孕妇血浆cffDNA比例与孕周的相关性分析 4 268例孕妇cffDNA比例为1.025%~29.851%,中位cffDNA比例为7.392%,其中孕19+5周最低,孕30+1周最高。相关性分析发现,cffDNA比例与孕周呈正相关(r=0.113,P<0.05)。但cffDNA比例随孕周增长的速度不一致,孕11~22周,cffDNA比例每周约增加0.2%,孕22周以后,每周约增加0.7%。见图1。
在75例cffDNA比例<3.5%的孕妇中,孕15周cffDNA比例<3.5%的孕妇比例最低,为0.41%(2/493),孕19周cffDNA比例<3.5%的孕妇比例最高,为3.36%(11/327)。cffDNA比例<3.5%的孕妇的孕周比较,各组间差异无统计学意义(P>0.05)。见表1。
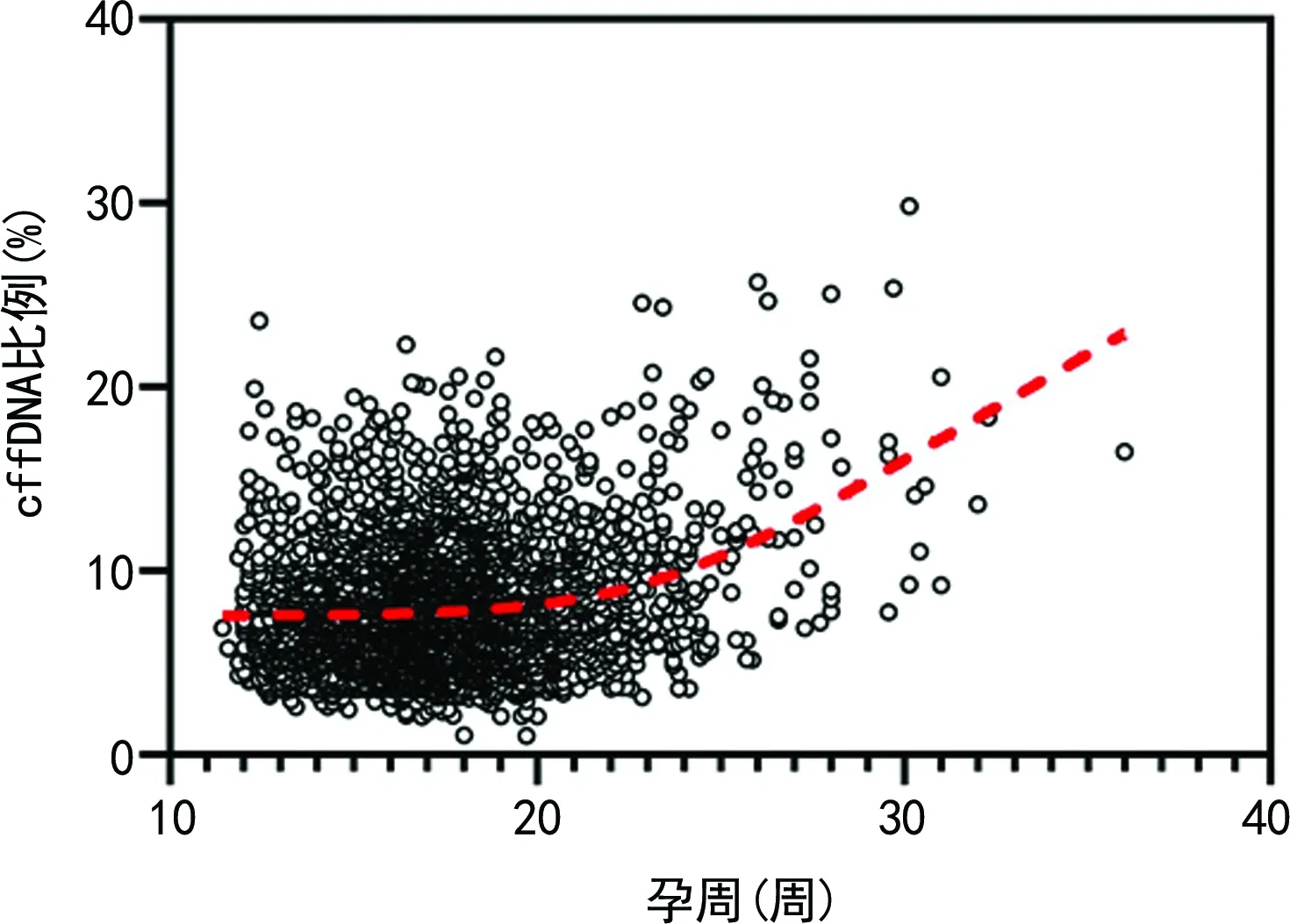
注:曲线为spline拟合曲线。
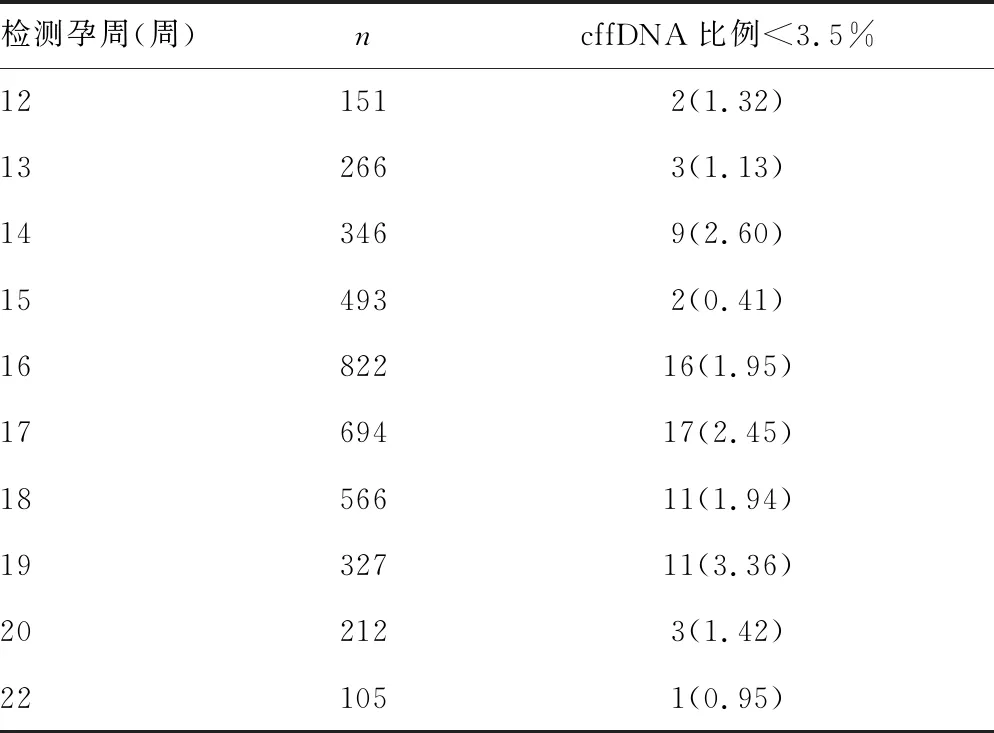
图1 cffDNA比例与孕周的相关性 表1 cffDNA比例<3.5%的孕妇在不同孕周的分布[n(%)]
2.2孕妇血浆cffDNA比例与BMI的相关性分析 相关性分析发现,cffDNA比例与BMI呈负相关(r=-0.261,P<0.05)。依据世界卫生组织(WHO)制定的BMI界限值,将孕妇按照BMI分为4组:低体质量组(BMI<18.50 kg/m2)、正常体质量组(BMI为18.50~<25.00 kg/m2)、超重组(BMI为25.00~<30.00 kg/m2)和肥胖组(BMI≥30.00 kg/m2)。低体质量组、正常体质量组、超重组和肥胖组平均cffDNA比例分别为9.26%、8.29%、7.26%、6.29%,各组之间差异有统计学意义(P<0.05),随着BMI的升高,cffDNA比例明显降低。见图2。
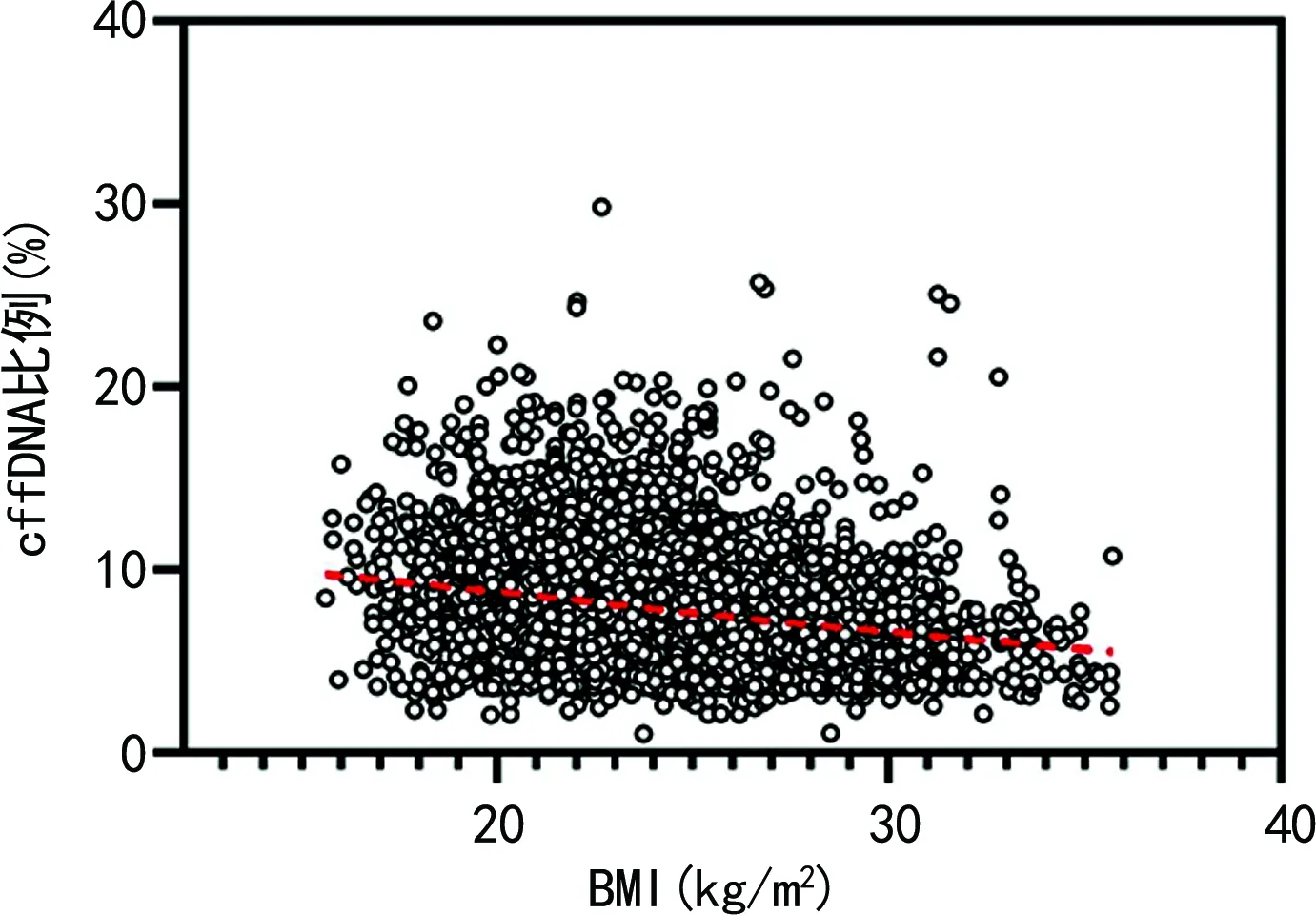
注:曲线为spline拟合曲线。
2.3孕妇血浆cffDNA比例与孕妇年龄的相关性分析 相关性分析发现,cffDNA比例与孕妇年龄呈负相关(r=-0.088,P<0.05)。根据孕妇年龄,将孕妇分为高龄组(≥35岁)和低龄组(<35岁),高龄组、低龄组平均cffDNA比例分别为7.57%、8.11%,经单因素分析后得出两组之间差异有统计学意义(P<0.05),随着年龄的升高,cffDNA比例明显降低。见图3。
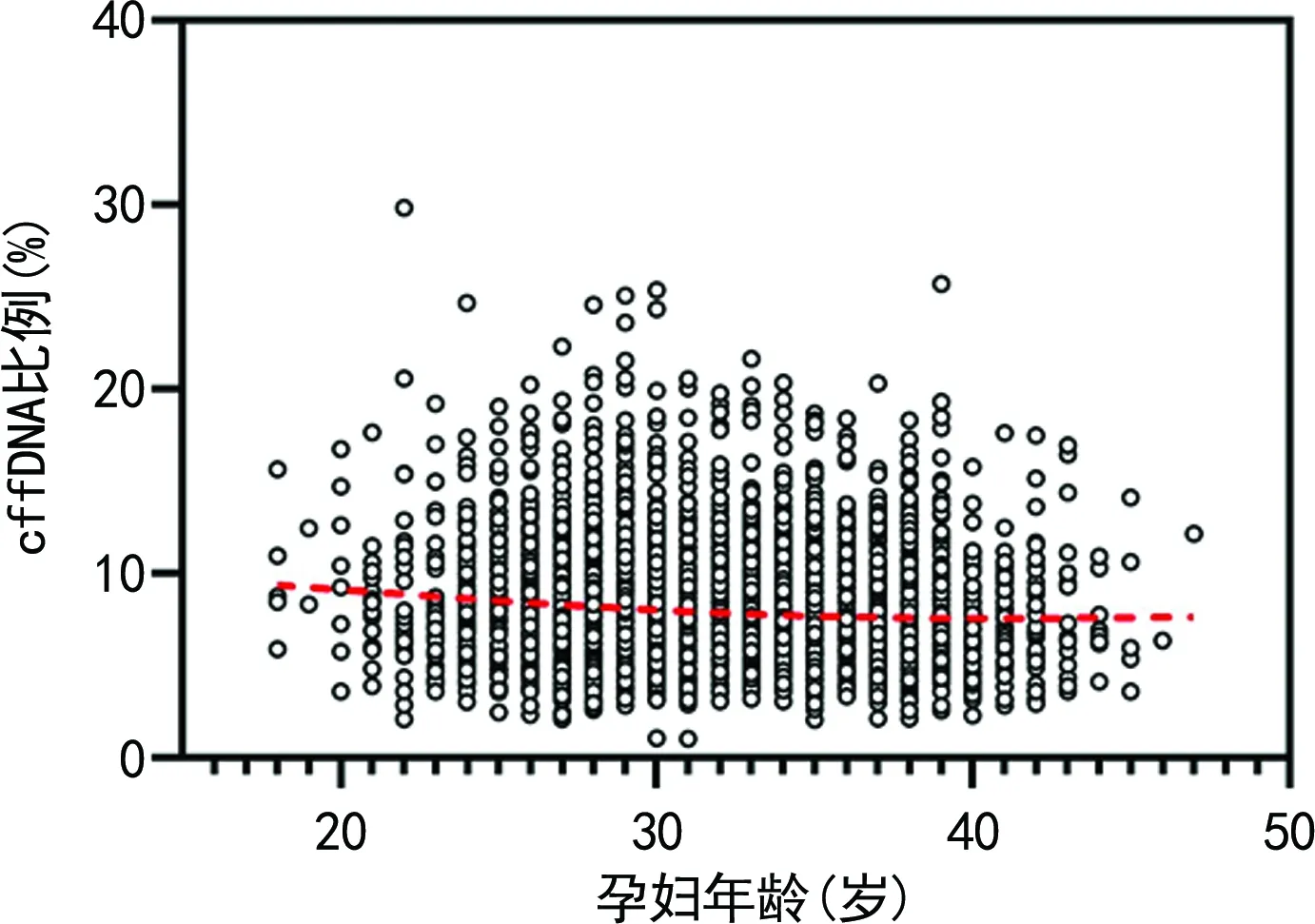
注:曲线为spline拟合曲线。
2.4孕妇血浆cffDNA比例与妊娠单双胎的相关性分析 单胎组、双胎组平均cffDNA比例分别为7.92%、8.47%。经单因素分析后得出两组之间差异无统计学意义(P>0.05)。经相关性分析,妊娠单双胎与cffDNA比例无相关性(r=0.025,P>0.05)。
2.5孕妇血浆cffDNA比例与标本运输时间的相关性分析 使用cffDNA专用采血管采集全血,按照相关标准运输,放置于6~35 ℃环境中,96 h内运送至实验室并处理。将运输时间分为4组:<24 h组、24~<48 h组、48~<72 h、72~<96 h组。各组平均cffDNA比例分别为7.92%、7.83%、8.05%、8.14%。经单因素分析后得出4组之间差异无统计学意义(P>0.05)。经相关性分析,标本运输时间与cffDNA比例无相关性(r=0.021,P>0.05)。见图4。
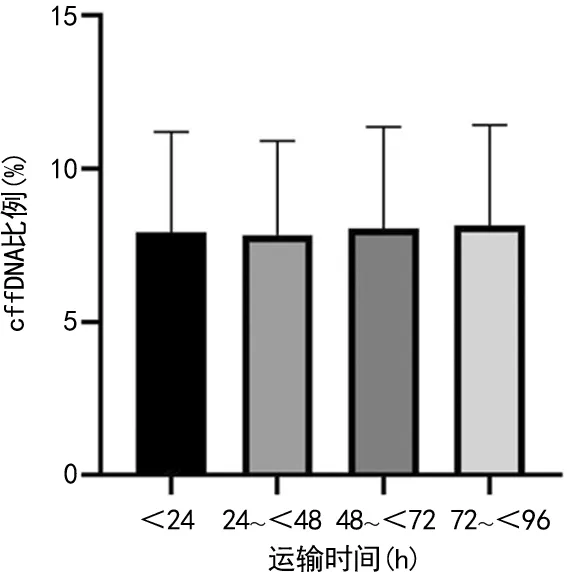
图4 cffDNA比例与运输时间的相关性
2.6cffDNA比例<3.5%的标本重新采血后的检测结果 对16例cffDNA比例<3.5%的标本(孕12+5~19+4周)进行了重新取样检测,中位间隔时间为17.1 d。其中8例标本经重新取样检测后cffDNA比例>3.5%,中位间隔时间17.3 d;另有8例标本经重新取样检测后cffDNA比例依旧<3.5%,中位取样间隔时间16.9 d,这8例孕妇超重3例,肥胖2例。经随访,妊娠结局均未发现明显异常。
3 讨 论
近年来,随着高通量测序技术的成熟及测序成本的不断降低,基于孕妇外周血cffDNA的NIPS技术越来越多地被应用于胎儿染色体数目异常相关疾病的检测。NIPS技术要有效地检测出胎儿染色体数目异常,cffDNA比例十分重要[7]。
研究表明,cffDNA比例受孕妇和胎儿两方面因素的影响,孕妇因素包括孕周、体质量、妊娠期并发症或合并症、年龄、孕中期唐氏综合征血清学筛查的危险系数、血清妊娠相关蛋白A和游离β-人绒毛膜促性腺激素的变化[8]。其中cffDNA比例与孕周呈正相关,与孕妇BMI呈负相关。胎儿因素包括胎儿的单胎或多胎、胎儿染色体核型及胎儿颈后透明层厚度等,这些也是潜在的影响因素[4,7,9]。此外,标本运输时间或实验室提取方法的差异也会对cffDNA比例产生一定影响。
3.1孕妇自身因素对cffDNA比例的影响 在本研究中cffDNA比例与孕妇采血时的孕周呈正相关。随着孕周的增加,胎盘体积逐渐增大,凋亡的滋养层细胞增多,因此释放到孕妇血液中的DNA片段增加。但是本研究发现,cffDNA比例在不同孕周增长速度不一致,孕11~22周,cffDNA比例每周约增加0.2%,22周以后,每周约增加0.7%,这与之前报道的在孕10~21周,cffDNA每周约增加0.1%,21周后,每周约增加1.0%类似[10]。在孕19周时,cffDNA比例<3.5%的比例相对较高,较少见相关的报道。
本研究还发现cffDNA比例与孕妇BMI之间存在负相关性,与之前的研究结果一致[11]。可能的原因是受到孕妇血液中总体游离DNA水平的影响,随着孕妇体质量的增加,血容量增加,导致血液中的总体游离DNA水平升高,从而稀释了外周血中的cffDNA,使cffDNA比例降低。另一方面,由于肥胖孕妇具有的更多的脂肪组织,可通过脂肪细胞坏死或基底层的血管组织凋亡进行活跃的脂肪重建。脂肪细胞裂解后,cffDNA释放入血,从而导致血中来源于孕妇的DNA含量更高,而cffDNA含量不变,因此导致cffDNA比例更低[12]。针对高BMI对cffDNA比例的影响,2016年美国医学遗传学与基因组学学会指南指出,肥胖孕妇外周血中的cffDNA比例通常较低,建议肥胖孕妇直接使用传统筛查方法,而不采用NIPS。我国的相关技术规范也将肥胖孕妇列入NIPS慎用人群。与年龄的相关性分析发现,cffDNA比例与孕妇年龄呈负相关,与HOU等[11]的研究结果相符。
3.2妊娠单双胎及运输时间对cffDNA比例的影响 本研究发现,适宜孕周内的妊娠单双胎以及按照采血管要求的运输条件下的运输时间与cffDNA比例无相关性。这一发现对于地广人稀,东西、南北跨度均较大的内蒙古地区至关重要,在合适的运输条件下96 h内cffDNA比例没有明显差异,有助于偏远地区标本的收集及检测,为NIPS在欠发达地区的普及提供可能。
3.3cffDNA比例<3.5%的标本2次采样的可行性评估 对首次检查发现cffDNA比例低的孕妇建议重新采血进行第二次检测,有50%的孕妇经第2次检测后会得到结果,这与之前的研究结果一致[13-14]。二次采血后cffDNA仍偏低的标本中BMI≥25.00 kg/m2的占65.5%(5/8),推测在最适的检测孕周,BMI是影响cffDNA比例的主要因素。另有3例BMI在正常范围的孕妇cffDNA比例仍<3.5%,可能是受其他因素的影响。目前对于重新采血时机的选择及再次行NIPS获得结果的可能性尚未达成共识,因为重新采血时,随着孕周的增加,孕妇体质量和BMI也会增加。美国医学遗传与基因组学学会在2016年发布的关于NIPS在胎儿染色体非整倍体疾病筛查的应用指南中建议:如果孕妇是在合适的检测孕周出现了cffDNA比例低导致NIPS失败,可建议孕妇直接进行产前诊断,而不是重新采血再次进行NIPS检测[15]。我国目前多采用先重新采血检测,而不直接进行有创产前诊断,对于第2次NIPS失败的孕妇,建议接受进一步的遗传咨询、全面的超声评估和产前诊断[16]。
综上所述,孕周越小、BMI越大、年龄越大,cffDNA比例越低,NIPS的失败率越高。因此,临床需要告知孕妇相关风险,可根据筛查对象的BMI、年龄、孕周制订个体化的采血时间,对于肥胖、年龄较大的孕妇可适当将筛查孕周后移。对首次采血cffDNA比例未达标的标本,可以先进行重新采血检测,对于第2次NIPS失败的孕妇,建议接受进一步的遗传咨询、全面的超声评估和产前诊断,并对胎儿结局进行随访。仍有一部分cffDNA比例低导致NIPS失败的孕妇,具体原因不明,后续关于胎儿染色体核型、孕期并发症/合并症、重新采血时机和其他影响cffDNA比例因素的研究需要进一步完善。同时,也需要不断研究新的cffDNA富集方法,提高cffDNA比例,不断提高NIPS的检出率。
